Тема №12 «Соли»
Оглавление
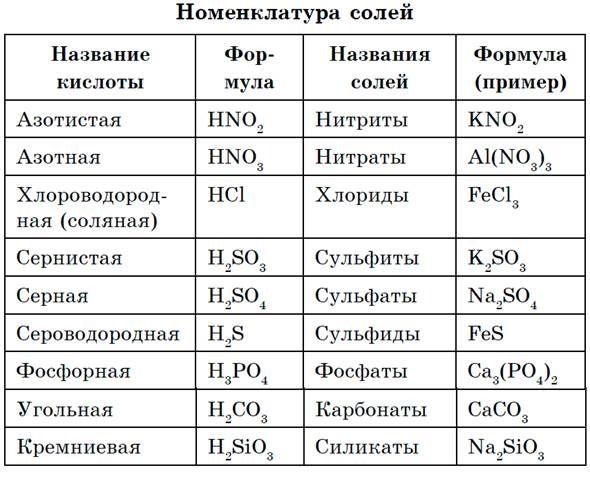
Номенклатура солей
Определение солей в рамках теории диссоциации. Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла, в кислых солях они замещены только частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Существуют также некоторые другие типы солей, например двойные соли, в которых содержатся два разных катиона и один анион: СаСО3 • MgCO3 (доломит), КСl • NaCl (сильвинит), KAl(SO4)2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: СаОСl2 (или Са(ОСl)Сl); комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами: K4[Fe(CN)6] (желтая кровяная соль), K3[Fe(CN)6] (красная кровяная соль), Na[Al(OH)4], [Ag(NH3)2]Cl; гидратные соли (кристаллогидраты), в которых содержатся молекулы кристаллизационной воды: CuSO4 • 5H2O(медный купорос), Na2SO4 • 10Н2О (глауберова соль).
Название солей образуют из названия аниона, за которым следует название катиона.
Для солей бескислородных кислот к названию неметалла добавляют суффикс ид, например хлорид натрия NaCl, сульфид железа(Н) FeS и др.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляют в случае высших степеней окисления окончание —am, в случае низших степеней окисления окончание -ит. В названиях некоторых кислот для обозначения низших степеней окисления неметалла используют приставку гипо-, для солей хлорной и марганцовой кислот используют приставку пер-, например: карбонат кальция СаСО3, сульфат железа(III) Fe2(SO4)3, сульфит железа(II) FeSO3, гипохлорит калия КОСl, хлорит калия КОСl2, хлорат калия КОСl3, перхлорат калия КОСl4, перманганат калия КМnO4, дихромат калия К2Сг2O7.
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначают приставкой гидро-, группу ОН — приставкой гидрокси, NaHS — гидросульфид натрия, NaHSO3 — гидросульфит натрия, Mg(OH)Cl — гидроксихлорид магния, Аl(ОН)2Сl — дигидроксихлорид алюминия.
В названиях комплексных ионов сначала указывают лиганды, завершают названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках). В названиях комплексных катионов используют русские названия металлов, например: [Cu(NH3)4]Cl2 — хлорид тетраамминмеди(П), [Ag(NH3)2]2SO4 — сульфат диамминсеребра(1). В названиях комплексных анионов используют латинские названия металлов с суффиксом -ат, например: К[Аl(ОН)4] — тетрагидроксиалюминат калия, Na[Cr(OH)4] — тетра- гидроксихромат натрия, K4[Fe(CN)6] — гексацианоферрат(Н) калия.
Названия гидратных солеи (кристаллогридратов) образуются двумя способами. Можно воспользоваться системой названий комплексных катионов, описанной выше; например, медный купорос [Cu(H2O)4]SO4 • Н20 (или CuSO4 • 5Н2O) можно назвать сульфат тетрааквамеди(П). Однако для наиболее известных гидратных солей чаще всего число молекул воды (степень гидратации) указывают численной приставкой к слову «гидрат», например: CuSO4 • 5Н2O — пентагидрат сульфата меди(И), Na2SO4 • 10Н2О — декагидрат сульфата натрия, СаСl2 • 2Н2O — дигидрат хлорида кальция.
Растворимость солей
По растворимости в воде соли делятся на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
1. Растворимы все соли азотной кислоты — нитраты.
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей Na + и K + .
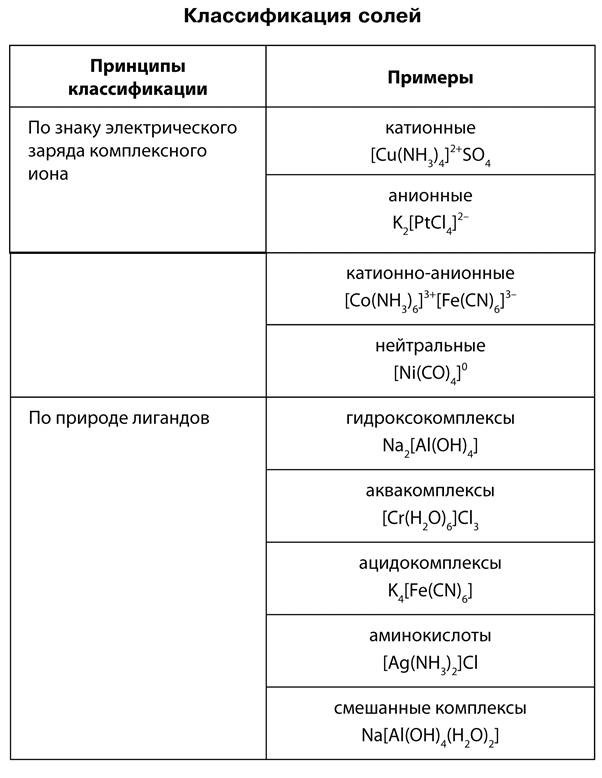
Классификация солей
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде. В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные. Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
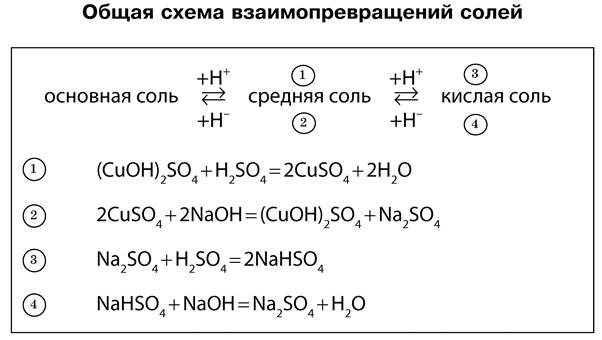
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл. К кислым солям относят, например, питьевую соду NaHCO3, которая состоит из катиона металла Na + и кислотного однозарядного остатка HCO3 — . Для кислой кальциевой соли формула записывается так: Ca(HCO3)2. Названия этих солей складываются из названий средних солей с прибавлением приставки гидро-, например:
Диссоциируют кислые соли следующим образом:
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например, к таким солям относится знаменитый малахит (CuOH)2CO3, о котором вы читали в произведениях П. Бажова. Он состоит из двух основных катионов CuOH + и двухзарядного аниона кислотного остатка CO3 2- . Катион CuOH + имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион CO3 2- объединены в электронейтральную соль.
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением приставки гидроксо-, (CuOH)2CO3 — гидроксокарбонат меди (II) или AlOHCl2 — гидроксохлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
Свойства солей
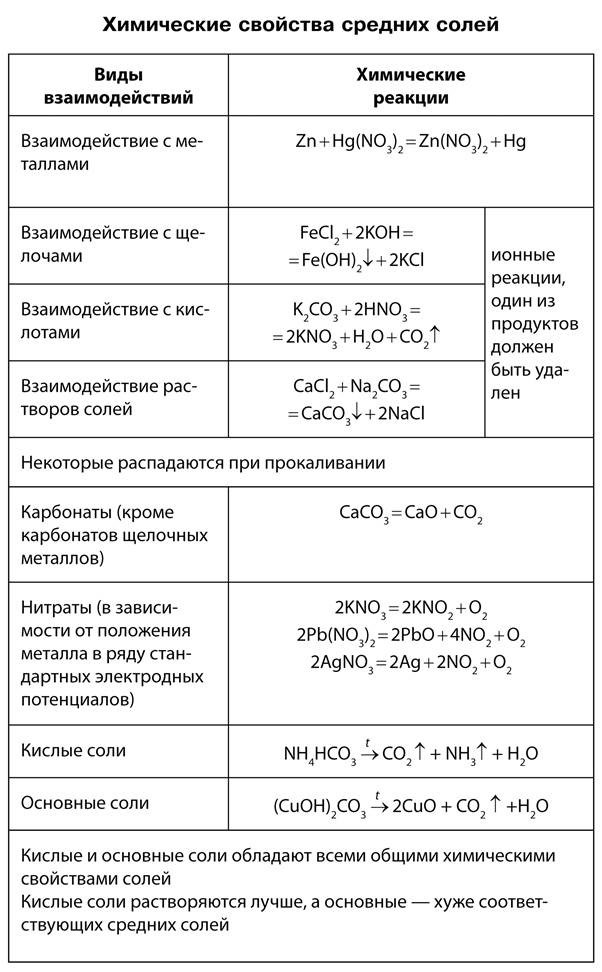
Типичные реакции солей:
Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:
Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов (см. «Электрохимический ряд напряжений металлов»). Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это соблюдается при выполнении следующих условий:
1) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
2) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) не вытесняют другие металлы из растворов солей.

Способы получения солей
Способы получения и химические свойства солей. Соли могут быть получены из неорганических соединений практически любого класса. Наряду с этими способами соли бескислородных кислот могут быть получены при непосредственном взаимодействии металла и неметалла (Cl, S ит. д.).
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
Источник
Способы получения растворимых солей
** §8.8 Соли. Получение и химические свойства.
Рассмотрим важнейшие способы получения солей.
1. Реакция нейтрализации . Этот способ уже неоднократно встречался в предыдущих параграфах. Растворы кислоты и основания смешивают (осторожно!) в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например:
H 2 SO 4
K 2 SO 4
сульфат калия
2 . Реакция кислот с основными оксидами . Этот способ получения солей упоминался в параграфе 8-3. Фактически, это вариант реакции нейтрализации. Например:
H 2 SO 4
сульфат меди
3 . Реакция оснований с кислотными оксидами (см. параграф 8.2). Это также вариант реакции нейтрализации:
карбонат кальция
Если пропускать в раствор избыток СО 2 , то получается избыток угольной кислоты и нерастворимый карбонат кальция превращается в растворимую кислую соль – гидрокарбонат кальция Са(НСО 3 ) 2 :
СаСО 3 + Н 2 СО 3 = Са(НСО 3 ) 2 (раствор)
4 . Реакция основных и кислотных оксидов между собой :
сульфат кальция
5 . Реакция кислот с солями . Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
CuS↓ (осадок)
сульфид меди
6 . Реакция оснований с солями . Для таких реакций подходят только щелочи (растворимые основания). В этих реакциях образуется другое основание и другая соль. Важно, чтобы новое основание не было щелочью и не могло реагировать с образовавшейся солью. Например:
хлорид натрия
7 . Реакция двух различных солей . Реакцию удается провести только в том случае, если хотя бы одна из образующихся солей нерастворима и выпадает в осадок:
AgCl↓ (осадок)
хлорид серебра
нитрат калия
Выпавшую в осадок соль отфильтровывают, а оставшийся раствор упаривают и получают другую соль. Если же обе образующиеся соли хорошо растворимы в воде, то реакции не происходит: в растворе существуют лишь ионы, не взаимодействующие между собой:
NaCl + KBr = Na + + Cl — + K + + Br —
Если такой раствор упарить, то мы получим смесь солей NaCl, KBr, NaBr и KCl, но чистые соли в таких реакциях получить не удается.
8 . Реакция металлов с кислотами . В способах 1 – 7 мы имели дело с реакциями обмена (только способ 4 – реакция соединения. Но соли образуются и в окислительно-восстановительных реакциях. Например, металлы, расположенные левее водорода в ряду активности металлов (таблица 8-3), вытесняют из кислот водород и сами соединяются с ними, образуя соли:
H 2 SO 4 (разб.)
сульфат железа II
9 . Реакция металлов с неметаллами . Эта реакция внешне напоминает горение. Металл «сгорает» в токе неметалла, образуя мельчайшие кристаллы соли, которые выглядят, как белый «дым»:
хлорид калия
10 . Реакция металлов с солями . Более активные металлы, расположенные в ряду активности левее , способны вытеснять менее активные (расположенные правее ) металлы из их солей:
порошок меди
сульфат цинка
Теперь рассмотрим химические свойства солей.
Наиболее распространенные реакции солей – реакции обмена и окислительно-восстановительные реакции. Сначала рассмотрим примеры окислительно-восстановительных реакций.
1 . Окислительно-восстановительные реакции солей .
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка, если в этом кислотном остатке какой-либо атом способен менять степень окисления.
а) Реакции за счет иона металла .
Поскольку в солях содержится ион металла в положительной степени окисления, они могут участвовать в окислительно-восстановительных реакциях, где ион металла играет роль окислителя. Восстановителем чаще всего служит какой-нибудь другой (более активный) металл. Приведем пример:
Hg 2+ SO 4
Sn 2+ SO 4
соль менее активного металла (окислитель)
более активный металл (восстановитель)
Принято говорить, что более активные металлы способны вытеснять другие металлы из их солей. Металлы, находящиеся в ряду активности левее , являются более активными. Нетрудно заметить, что это те же реакции металлов с солями (см. пункт 10 предыдущего раздела).
б) Реакции за счет кислотного остатка .
В кислотных остатках часто имеются атомы, способные изменять степень окисления. Отсюда – многочисленные окислительно-восстановительные реакции солей с такими кислотными остатками. Например:
Na 2 S –2
2 NaBr –1
соль сероводородной кислоты
H 2 O 2 –1
H 2 SO 4
K 2 SO 4
2 H 2 O –2
соль иодоводородной кислоты
2 KMn +7 O 4
16 HCl –1
5 Cl 2 0
2 Mn +2 Cl 2
соль марганцовой кислоты
хлорид марганца
2 Pb(N +5 O 3 –2 ) 2
4 N +4 O 2
соль азотной кислоты
при нагревании
2 . Обменные реакции солей .
Такие реакции могут происходить в растворах, когда соли реагируют: а) с кислотами, б) с щелочами, в) с другими солями. Например:
а) CuSO 4 + H 2 S = CuS↓ (осадок) + H 2 SO 4
AgNO 3 + HCl = AgCl↓ (осадок) + HNO 3
б) FeCl 3 + 3 NaOH = Fe(OH) 3 ↓ (осадок) + 3 NaCl
CuSO 4 + 2 KOH = Cu(OH) 2 ↓ (осадок) + K 2 SO 4
в) BaCl 2 + K 2 SO 4 = BaSO 4 ↓ (осадок) + 2 KCl
CaCl 2 + Na 2 CO 3 = CaCO 3 ↓ (осадок) + 2 NaCl
Некоторые из этих реакций уже встречались в опытах из первой части параграфа.
Во всех случаях один из продуктов обменной реакции обязательно должен покидать реакционную смесь в виде осадка или газообразного вещества. Либо должно получаться прочное соединение, не распадающееся в растворе на ионы (например, вода в реакции нейтрализации). Если эти условия не выполняется, то при смешивании реагентов в лучшем случае образуется смесь не реагирующих между собой ионов — реакция не идет.
8.27 (ФМШ). Продолжите уравнения реакций и уравняйте их. Если есть продукты, выпадающие в осадок или выделяющиеся в виде газа, поставьте после них стрелку вниз или вверх.
1) AgNO 3 + FeCl 3 =
2) Pb(NO 3 ) 2 + K 2 S =
3) Ba(NO 3 ) 2 + Al 2 (SO 4 ) 3 =
4) CaCl 2 + Na 3 PO 4 =
6) (NH 4 ) 2 SO 4 + KOH =
7) K 2 CO 3 + H 2 SO 4 =
8) Ba(HCO 3 ) 2 + H 2 SO 4 =
9) Al 2 O 3 + KOH (избыток) =
11) NaHCO 3 + HCl =
12) NaHCO 3 + NaOH =
13) [Cu(OH)] 2 SO 4 + KOH =
14) [Cu(OH)] 2 SO 4 + H 2 SO 4 =
17) K 2 S + HNO 3 = кислая соль + .
18) Mg(OH) 2 + H 2 SO 4 = основная соль + .
Источник