- Лабораторные способы получения неорганических веществ
- Получение углекислого газа в лаборатории
- Получение угарного газа в лаборатории
- Получение сероводорода в лаборатории
- Получение аммиака в лаборатории
- Получение азотной кислоты в лаборатории
- Получение ортофосфорной кислоты в лаборатории
- Получение кремния в лаборатории
- Получение кислорода в лаборатории
- Получение водорода в лаборатории
- Получение хлора в лаборатории
- Получение хлороводорода в лаборатории
- Добавить комментарий Отменить ответ
- Получение простых веществ
- Нахождение в природе и общие принципы получения простых веществ
- Нахождение в природе и общие принципы получения простых веществ
Лабораторные способы получения неорганических веществ
Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений.
Лабораторные способы получения веществ отличаются от промышленных:
| Лабораторные способы получения веществ | Промышленные способы получения веществ |
| Реагенты могут быть редкими и дорогими | Реагенты распространенные в природе и дешевые |
| Условия реакции мягкие, без высоких давлений и сильного нагревания | Условия реакции могут быть довольно жесткими, допустимы высокие давления и температуры |
| Как правило, реагенты — жидкости или твердые вещества | Реагенты — газы или жидкости, реже твердые вещества |
Получение углекислого газа в лаборатории
Углекислый газ CO2 в лаборатории получают при помощи аппарата Киппа при взаимодействии соляной кислоты с мелом или мрамором:
Получение угарного газа в лаборатории
В лаборатории угарный газ проще всего получить, действуя концентрированной серной кислотой на муравьиную кислоту:
HCOOH → H2O + CO
Получение сероводорода в лаборатории
Сероводород в лаборатории легко получить действием разбавленной серной кислоты на сульфиды металлов, например, сульфид железа (II):
Эта реакция также проводится в аппарате Киппа.
Получение аммиака в лаборатории
Аммиак в лаборатории получают при нагревании смеси солей аммония с щелочами.
Например , при нагревании смеси хлорида аммония с гашеной известью:
Эти вещества тщательно перемешивают, помещают в колбу и нагревают.
Получение азотной кислоты в лаборатории
Азотную кислоту в лаборатории получают действием концентрированной серной кислоты на кристаллический нитрат натрия и калия при небольшом нагревании:
При этом менее летучая кислота вытесняет более летучую кислоту из соли.
При более сильном нагревании образуется сульфат натрия, но и образующаяся азотная кислота разлагается.
Получение ортофосфорной кислоты в лаборатории
При взаимодействии ортофосфата кальция с серной кислотой при нагревании образуется ортофосфорная кислота:
Получение кремния в лаборатории
В лаборатории кремний получают при взаимодействии смеси чистого песка с порошком магния:
2Mg + SiO2→ 3MgO + Si
Получение кислорода в лаборатории
Кислорода в лаборатории можно получить при разложении целого ряда неорганических веществ.
Чаще всего в лаборатории кислород получают разложением перманганата калия:
Выделяющийся кислород можно собрать вытеснением воздуха:
Также кислород можно собирать методом вытеснения воды:
Обнаружить кислород можно очень просто: тлеющая лучинка вспыхивает в атмосфере кислорода.
Кислород можно получить также разложением пероксида водорода:
Реакция катализируется оксидом марганца (IV) MnO2.
Разложение бертолетовой соли KClO3 — еще один способ получения кислорода в лаборатории:
2KClO3 → 2KCl + 3O2
Реакция также протекает в присутствии катализатора, оксида марганца (IV) MnO2.
Получение водорода в лаборатории
Водород в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
При взаимодействии минеральных кислот (не сильных окислителей) с активными металлами и металлами средней активности также образуется водород.
Например , соляная кислота реагирует с цинком с образованием водорода:
Zn + 2HCl → ZnCl2 + H2
Собирать водород можно методом вытеснения воздуха, так как водород — гораздо более легкий газ, чем воздух.
Также для собирания водорода подходит метод вытеснения воды, так как водород плохо растворим в воде:
Водород выделяется также при взаимодействии активных металлов (расположенных в ряду активности до магния) с водой.
Например , натрий активно реагирует с водой с образованием водорода:
2Na + 2H2O → 2NaOH + H2
Получение хлора в лаборатории
Стр. 162в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
При взаимодействии минеральных кислот (не сильных окислителей) с активными металлами и металлами средней активности также образуется водород.
Получение хлороводорода в лаборатории
Стр. 162в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник
Получение простых веществ



Металлы, расположенные в ряду напряжений (активности) от Li до Al получают путем электролиза расплава солей. Алюминий получают путем электролиза расплава Al2O3, который представляет собой соль Al[AlO3] и диссоциирует при расплавлении по схеме: Al[AlO3] → Al 3+ + AlO 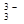
На катоде восстанавливается алюминий:
Катод: Al 3+ + 3ē → Al 0 – процесс восстановления,
а на аноде окисляется атом О -2 входящий в состав аниона AlO 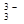
Анод: 4AlO 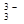
Суммарное уравнение электролиза:

Остальные металлы чаще всего получают путем восстановления при взаимодействии их оксидов с каким-либо восстановителем (С, СО, Н2, Si, активные металлы): PbO + С → Pb + CO.
Если оксиды металлов в природе не встречаются, то их сначала получают путем термического разложения карбонатов металлов или окислением (обжигом) сульфидных руд по схемам:
MnCO3 
(CuOH)2CO3 
Неметаллы в промышленности получают несколькими путями – электролизом растворов и расплавов солей галогеноводородных кислот (хлор), путем восстановления из оксидов: SiO2 + 2Mg → Si + 2MgO, и другими способами.
Источник
Нахождение в природе и общие принципы получения простых веществ





Нахождение в природе и общие принципы получения простых веществ
- Общий принцип бытия в природе и получения простых веществ. Большинство элементов в природе находятся в сдержанном состоянии. Янии-в виде compounds. In кроме того, общая форма соединения является особенно Она характерна и определяется прежде всего активностью элемента.
- Естественный Соединения металлов зависят от их активности. Когда металлы становятся более активными、 Его соединения в природе имеют более выраженные солеподобные свойства. Поэтому щелочные металлы могут быть использованы в качестве галогенидов, нитратов、 Сульфаты, иногда карбонаты(содовые озера).Все эти соединения хороши.
Растворенный в воде, он определяет удельное распределение осадка Земля: море и море, соленые озера, подземные минеральные источники、 Людмила Фирмаль
Отложений (хлористый натрий, галит, и т. д.)、 Сильвинит NaCl-KCl и др.) образуется в результате испарения водных объектов、 Он имеет происхождение от отложений. Для чуть менее активной щелочной почвы Меньше отложений галогенидов и нитратов металлов и магния Характерно, но иногда встречается[карнарит KCbMgCl2 Людмила Фирмаль
Типичный восстановитель В металлургии, водорода, углерода, активных металлов(алюминиевые, цинковые, магниевые, Калифорния、 Щелочные металлы.)Выбор подходящего восстановителя、 Вероятность возникновения самой окислительно-восстановительной реакции (отрицательная Значение DG важно), но также возникновением чрезмерных побочных эффектов Редуктор с использованием редуцированного металла.
Многие переходные металлы могут быть уменьшены Залейте оксиды и углерод. Но он образует много металлов и хрупкость Огнеупорная фаза реализации. Иногда этот эффект используется сознательно、 Например, при углеродном термическом восстановлении железной руды в доменной печи Чугунная печь. Во многих металлах восстановленный оксид является оксидом.
Таким образом, сульфидная руда обжигается для превращения ее в оксидную форму. Металл, такой как Mo, W, Re Такой водород является относительно мягким восстановителем. Утилизация тепла углерода Новинка используется в производстве Fe, Co, Ni, Pb, Sn, Cu, Zn, Mn и др. Восстановитель энергии-металлический алюминий. Алюминий Хром широко используется для получения таких металлов, как Cr, Mn и Fe (алюминий Металл), щелочноземельные металлы.
Восстановление оксида Металл алюминий течет с выделением большого количества тепла, но это не так Высокое сродство алюминия к кислороду. Еще более энергичен в качестве восстановителя Действует на магний используемый для уменьшения обоих оксидов( Например, BrO3), а при получении Галогенида (например, титана и его аналита) Бревно.)
Наконец, наиболее активные металлы-алюминий, магний, щелочноземельные- Щелочная и щелочно-расплавленная соль (обычно получаемая электролизом хлора Дов или фторид).Катод электролизера、 Восстановитель энергии является прямым донором электронов. Относительно инертные неметаллические вещества, встречающиеся в природе В свободном состоянии (B, Si, Ge, P, As, Sb) он также отделен в свободном состоянии Действие подходящего восстановителя.
Поэтому бор и кремний восстанавливаются Они магний термально от окиси, водопода от хлорида (BCI3, SiCl4), и сливк. также цинк от niy-SiCl4.Германий выделяется в состоянии свободной воды получено естественное восстановление веог-пниктогена (кроме азота и фосфора) Восстановление углерода и теплота сгорания оксидов E2O3 и фосфора Восстановление САЗ (PO4J-наиболее активный неметалл-галоген Он отделяется от природных соединений только окислением.
Бром и йод Выталкивают раствор бромида и йодида с более активными окислителями- Хлор. Хлор и фтор получают электролизом, при использовании хлора Раствор хлоридов и фтора-поскольку фтор наиболее растворим, он только растворяется Активные окислители, активно разлагающие воду с выделением многих побочных веществ Products.
In все эти процессы, анод клетки является наиболее активным. Окислитель в качестве прямого акцептора электронов. Простых веществ(металлов и talls) — метод, основанный на пиролизе (пиролизе Или неустойчивый галоидный дисбаланс: Sil4 Si + 2I2; 2TiCl2 Ti + TiCl4; Til4; Ti + 2I2
Таким образом вы получите бор (ввгз, разборка Б1з).Кремний, металлическая подгруппа Особенности этих способов, например титановые, в результате реакции Пиролиз и нелояльные вещества получаются очень высокими Степень чистоты. Поэтому все чаще используются методы этой группы. Нью-Йорк с современным technology. In стол. 21.、 Простая оценка.





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник
















