Получение простых веществ



Металлы, расположенные в ряду напряжений (активности) от Li до Al получают путем электролиза расплава солей. Алюминий получают путем электролиза расплава Al2O3, который представляет собой соль Al[AlO3] и диссоциирует при расплавлении по схеме: Al[AlO3] → Al 3+ + AlO 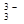
На катоде восстанавливается алюминий:
Катод: Al 3+ + 3ē → Al 0 – процесс восстановления,
а на аноде окисляется атом О -2 входящий в состав аниона AlO 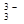
Анод: 4AlO 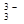
Суммарное уравнение электролиза:

Остальные металлы чаще всего получают путем восстановления при взаимодействии их оксидов с каким-либо восстановителем (С, СО, Н2, Si, активные металлы): PbO + С → Pb + CO.
Если оксиды металлов в природе не встречаются, то их сначала получают путем термического разложения карбонатов металлов или окислением (обжигом) сульфидных руд по схемам:
MnCO3 
(CuOH)2CO3 
Неметаллы в промышленности получают несколькими путями – электролизом растворов и расплавов солей галогеноводородных кислот (хлор), путем восстановления из оксидов: SiO2 + 2Mg → Si + 2MgO, и другими способами.
Источник
Нахождение в природе и общие принципы получения простых веществ





Нахождение в природе и общие принципы получения простых веществ
- Общий принцип бытия в природе и получения простых веществ. Большинство элементов в природе находятся в сдержанном состоянии. Янии-в виде compounds. In кроме того, общая форма соединения является особенно Она характерна и определяется прежде всего активностью элемента.
- Естественный Соединения металлов зависят от их активности. Когда металлы становятся более активными、 Его соединения в природе имеют более выраженные солеподобные свойства. Поэтому щелочные металлы могут быть использованы в качестве галогенидов, нитратов、 Сульфаты, иногда карбонаты(содовые озера).Все эти соединения хороши.
Растворенный в воде, он определяет удельное распределение осадка Земля: море и море, соленые озера, подземные минеральные источники、 Людмила Фирмаль
Отложений (хлористый натрий, галит, и т. д.)、 Сильвинит NaCl-KCl и др.) образуется в результате испарения водных объектов、 Он имеет происхождение от отложений. Для чуть менее активной щелочной почвы Меньше отложений галогенидов и нитратов металлов и магния Характерно, но иногда встречается[карнарит KCbMgCl2 Людмила Фирмаль
Типичный восстановитель В металлургии, водорода, углерода, активных металлов(алюминиевые, цинковые, магниевые, Калифорния、 Щелочные металлы.)Выбор подходящего восстановителя、 Вероятность возникновения самой окислительно-восстановительной реакции (отрицательная Значение DG важно), но также возникновением чрезмерных побочных эффектов Редуктор с использованием редуцированного металла.
Многие переходные металлы могут быть уменьшены Залейте оксиды и углерод. Но он образует много металлов и хрупкость Огнеупорная фаза реализации. Иногда этот эффект используется сознательно、 Например, при углеродном термическом восстановлении железной руды в доменной печи Чугунная печь. Во многих металлах восстановленный оксид является оксидом.
Таким образом, сульфидная руда обжигается для превращения ее в оксидную форму. Металл, такой как Mo, W, Re Такой водород является относительно мягким восстановителем. Утилизация тепла углерода Новинка используется в производстве Fe, Co, Ni, Pb, Sn, Cu, Zn, Mn и др. Восстановитель энергии-металлический алюминий. Алюминий Хром широко используется для получения таких металлов, как Cr, Mn и Fe (алюминий Металл), щелочноземельные металлы.
Восстановление оксида Металл алюминий течет с выделением большого количества тепла, но это не так Высокое сродство алюминия к кислороду. Еще более энергичен в качестве восстановителя Действует на магний используемый для уменьшения обоих оксидов( Например, BrO3), а при получении Галогенида (например, титана и его аналита) Бревно.)
Наконец, наиболее активные металлы-алюминий, магний, щелочноземельные- Щелочная и щелочно-расплавленная соль (обычно получаемая электролизом хлора Дов или фторид).Катод электролизера、 Восстановитель энергии является прямым донором электронов. Относительно инертные неметаллические вещества, встречающиеся в природе В свободном состоянии (B, Si, Ge, P, As, Sb) он также отделен в свободном состоянии Действие подходящего восстановителя.
Поэтому бор и кремний восстанавливаются Они магний термально от окиси, водопода от хлорида (BCI3, SiCl4), и сливк. также цинк от niy-SiCl4.Германий выделяется в состоянии свободной воды получено естественное восстановление веог-пниктогена (кроме азота и фосфора) Восстановление углерода и теплота сгорания оксидов E2O3 и фосфора Восстановление САЗ (PO4J-наиболее активный неметалл-галоген Он отделяется от природных соединений только окислением.
Бром и йод Выталкивают раствор бромида и йодида с более активными окислителями- Хлор. Хлор и фтор получают электролизом, при использовании хлора Раствор хлоридов и фтора-поскольку фтор наиболее растворим, он только растворяется Активные окислители, активно разлагающие воду с выделением многих побочных веществ Products.
In все эти процессы, анод клетки является наиболее активным. Окислитель в качестве прямого акцептора электронов. Простых веществ(металлов и talls) — метод, основанный на пиролизе (пиролизе Или неустойчивый галоидный дисбаланс: Sil4 Si + 2I2; 2TiCl2 Ti + TiCl4; Til4; Ti + 2I2
Таким образом вы получите бор (ввгз, разборка Б1з).Кремний, металлическая подгруппа Особенности этих способов, например титановые, в результате реакции Пиролиз и нелояльные вещества получаются очень высокими Степень чистоты. Поэтому все чаще используются методы этой группы. Нью-Йорк с современным technology. In стол. 21.、 Простая оценка.





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник
Урок№9. Простые и сложные вещества.
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ
Железо Fe , медь Cu , алюминий Al , ртуть Hg , золото Au , серебро Ag и другие
Уголь С, сера S , фосфор P , йод I 2 , кислород O 2 , водород H 2 и другие.
1. Твёрдое агрегатное состояние (исключение – ртуть)
2. Металлический блеск
3. Хорошие проводники тепла и электричества.
4. Пластичные и ковкие.
1. Твёрдые (Уголь С, сера S , фосфор P , йод I 2 ), жидкие (бром Br 2 ) и газообразные (кислород O 2 , водород H 2 ).
2. Металлическим блеском не обладают (исключение йод)
3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ.
» jsaction=»rcuQ6b:WYd;»>
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В химии кроме терминов “атом” и “молекула” часто употребляется понятие “элемент” . Что общего и чем эти понятия различаются?
Химический элемент – это атомы одного и того же вида . Так, например, все атомы водорода – это элемент водород; все атомы кислорода и ртути – соответственно элементы кислород и ртуть.
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
По элементному составу различают простые вещества , состоящие из атомов одного элемента (H 2 , O 2 , Cl 2 , P 4 , Na, Cu, Au), и сложные вещества , состоящие из атомов разных элементов (H 2 O, NH 3 , OF 2 , H 2 SO 4 , MgCl 2 , K 2 SO 4 ).
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
На 2019 год в периодической таблице – 118 химических элементов, которые образуют около 500 простых веществ.
Самородное золото — простое вещество
Способность одного элемента существовать в виде различных простых веществ, отличающихся по свойствам, называется аллотропией . Например, элемент кислород O имеет две аллотропные формы — кислород O 2 и озон O 3 с различным числом атомов в молекулах. Аллотропные формы элемента углерод C — алмаз и графит — отличаются строение их кристаллов. Существуют и другие причины аллотропии.
Сложные вещества часто называют химическими соединениями , например, оксид ртути(II) HgO (получается путем соединения атомов простых веществ — ртути Hg и кислорода O 2 ), бромид натрия (получается путем соединения атомов простых веществ — натрия Na и брома Br 2 ).
Итак, подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое соединение»
Сложные вещества часто называют химическими соединениями.
Попробуйте ответить на вопросы:
1.Чем отличаются по составу смеси от химических соединений?
2. Сопоставьте свойства смесей и химических соединений?
3. Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
4. Можно ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная характеристика смесей и химических
Источник









