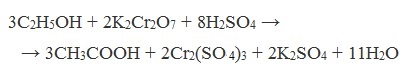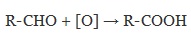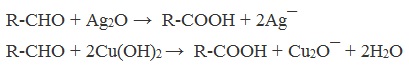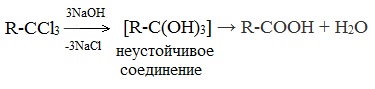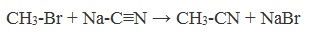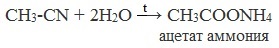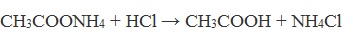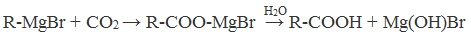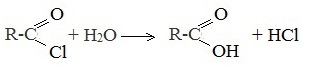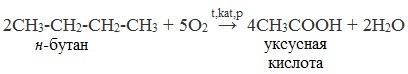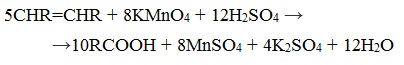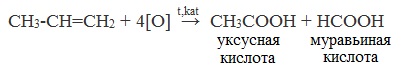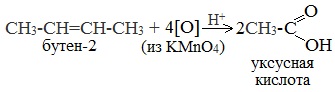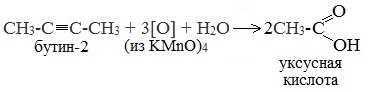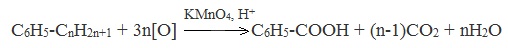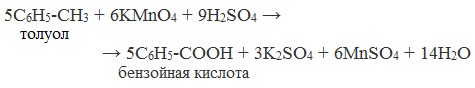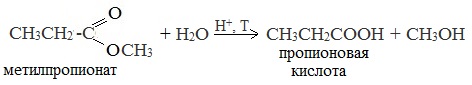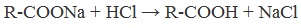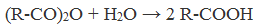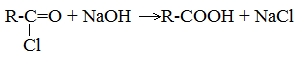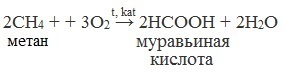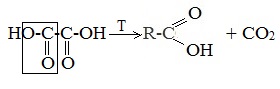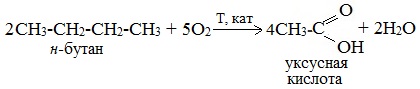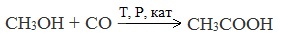- Пропановая кислота
- Содержание
- Физические и химические свойства
- История
- Получение
- Производные
- Применение
- Безопасность
- Формула пропановой кислоты, свойства, риски и использование
- Физико-химические свойства
- Реактивность и опасности
- биохимия
- приложений
- Способы получения пропановой кислоты
- Общие способы получения карбоновых кислот
- В промышленности
- В лаборатории
- Специфические способы получения важнейших кислот
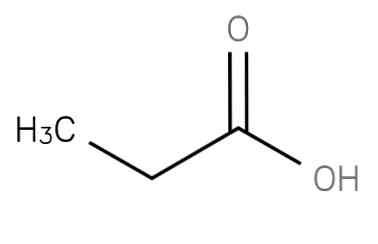
Пропановая кислота
Пропановая кислота
| Пропионовая кислота | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пропионовая кислота |
| Химическая формула | CH3CH2COOH |
| Молярная масса | 74,08 г/моль |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Термические свойства | |
| Температура плавления | -21 °C |
| Температура кипения | 141 °C |
| Температура вспышки | 54 °C |
| Химические свойства | |
| pKa | 4,88 |
| Структура | |
| Дипольный момент | 0,63 Дебай |
| Классификация | |
| номер CAS | 79-09-4 |
| RTECS | UE5950000 |
Пропионовая кислота (пропановая кислота, метилуксуcная кислота, консервант E280) — бесцветная едкая жидкость с резким запахом. Пропионовая кислота (с греческого «protos» — первый, «pion» — жир;) названа так, потому что она является наименьшей H(CH2)nCOOH кислотой, проявляющей свойства жирных кислот.
Содержание
Физические и химические свойства
Смешивается с водой и органическими растворителями.
По химическим свойствам — типичный представитель насыщеных карбоновых кислот; образует эфиры, амиды, галогенангидриды и т. д.
История
Пропионовая кислота впервые была описана в 1844 году Йоханом Готлибом (Johann Gottlieb), который нашёл ее среди продуктов разложения сахара. В течение следующих нескольких лет, другие химики получали пропионовую кислоту различными способами, не осознавая, что они получали одно и тоже вещество. В 1847 году, французский химик Жан-Батист Дюма (Jean-Baptiste Dumas) установил, что полученные кислоты были одним и тем же веществом, которое он назвал пропионовой кислотой.
Получение
В природе пропионовая кислота найдена в нефти, образуется при брожении углеводов. В промышленности её получают карбонилированием этилена по реакции Реппе; каталитическим окислением пропионового альдегида в присутствии кобальта или ионов марганца; как побочный продукт при парофазном окислении углеводородов C4 − C10 . Большое количество пропионовой кислоты раньше получали как побочный продукт при производстве уксусной кислоты, но современные способы получения уксусной кислоты сделали этот метод второстепенным источником пропионовой кислоты.
Пропионовую кислоту также получают биологически при метаболическом разложении жирных кислот, содержащих нечётное число атомов углерода, и при разложении некоторых аминокислот. Бактерии рода Propionibacterium производят пропионовую кислоту, как конечный продукт своего анаэробного метаболизма. Эти бактерии часто встречаются в желудке жвачных животных, и, отчасти, из-за их деятельности швейцарский сыр имеет свой аромат.
Производные
Пропионаты — соли и эфиры пропионовой кислоты. Щёлочные и щёлочноземельные соли пропионовой кислоты хорошо растворимы в воде и не растворимы в органических растворителях. Эфиры пропионовой кислоты плохо растворимы в воде, смешиваются с органическими растворителями.
Применение
Пропионовая кислота и ее производные применяют в производстве гербицидов (пропанол, дихлорпрол), лекарственных средств (ибупрофен, феноболин и др.), душистых веществ (бензил-, фенил-, геранил-, линалоил- пропионаты), пластмасс (например, поливинилпропионата), растворителей (пропил-, бутил-, пентилпропионата и др.), винилпластификаторов и ПАВ (гликолевые эфиры).
Пропионовая кислота препятствуется росту плесени и некоторых бактерий. Поэтому большая часть производимой пропионовой кислоты используется как консервант в продуктах, потребляемых человеком, и в продуктах для животных. В продуктах для животных применяется непосредственно пропионовая кислота, либо ее аммониевая соль (пропионат аммония). В продуктах, потребляемых людьми, особенно в хлебе и в других хлебобулочных изделиях, пропионовая кислота используется как натриевая (пропионат натрия) или кальциевая (пропионат кальция) соли.
Безопасность
Основная опасность пропионовой кислоты — это химические ожоги, которые могут произойти при контакте с концетрированной кислотой. В исследованиях на лабораторных животных, единственным неблагоприятным эффектом, связанным с долговременным употреблением небольшого количества пропионовой кислоты, было образование язв в пищеводе и желудке из-за разъедающих свойств вещества. При исследованиях не было обнаружено, что пропионовая кислота токсична, мутагенна, канцерогенна или негативно влияет на репродуктивные органы. В организме пропионовая кислота быстро окисляется, метаболизирует и выводится из организма как углекислый газ в цикле Кребса, не накапливаясь в организме.
Источник
Формула пропановой кислоты, свойства, риски и использование
пропановая кислота представляет собой насыщенную жирную кислоту с короткой цепью, содержащую этан, связанный с атомом углерода карбоксигруппы. Его формула CH3-СН2-COOH. Анион CH3CH2COO-, а также соли и эфиры пропановой кислоты известны как пропионаты (или пропаноаты)..
Он может быть получен из отходов древесной массы в процессе ферментации с использованием бактерий рода Propionibacterium. Его также получают из этанола и оксида углерода с использованием катализатора на основе трифторида бора (O’Neil, 2001)..
Другим способом получения пропановой кислоты является окисление пропиональдегида в присутствии ионов кобальта или марганца. Эта реакция быстро развивается при температурах до 40-50 ° C:
Это соединение естественно присутствует в молочных продуктах на низких уровнях и производится в общем виде вместе с другими короткоцепочечными жирными кислотами в желудочно-кишечном тракте человека и других млекопитающих как конечный продукт микробного переваривания углеводов..
Обладает значительной физиологической активностью у животных (База данных метаболома человека, 2017).
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 Биохимия
- 4 использования
- 5 ссылок
Физико-химические свойства
Пропановая кислота представляет собой бесцветную и маслянистую жидкость с резким, неприятным и прогорклым запахом. Его внешний вид показан на рисунке 2 (Национальный центр биотехнологической информации, 2017).
Пропановая кислота имеет молекулярную массу 74,08 г / моль и плотность 0,992 г / мл. Температура замерзания и кипения составляет -20,5 ° C и 141,1 ° C соответственно. Пропановая кислота представляет собой слабую кислоту, чья рКа составляет 4,88.
Соединение очень хорошо растворяется в воде, способно растворять 34,97 грамма соединения на 100 мл растворителя. Он также растворим в этаноле, эфире и хлороформе (Royal Society of Chemistry, 2015).
Пропановая кислота имеет промежуточные физические свойства между свойствами более мелких карбоновых кислот, муравьиной и уксусной кислот и более крупных жирных кислот..
Он показывает общие свойства карбоновых кислот и может образовывать производные амидов, сложных эфиров, ангидридов и хлоридов. Он может подвергаться альфа-галогенированию с бромом в присутствии PBr3 в качестве катализатора (реакция HVZ) с образованием CH3CHBrCOOH.
Реактивность и опасности
Пропановая кислота является легковоспламеняющимся и горючим материалом. Он может воспламениться от жары, искр или пламени. Пары могут образовывать взрывоопасные смеси с воздухом, способные перемещаться к источнику воспламенения и взрываться.
Большинство паров тяжелее воздуха. Они будут распространяться по земле и будут собираться в низких или ограниченных областях (канализация, подвалы, резервуары). Опасность взрыва пара в помещении, на улице или в канализации.
Вещества, обозначенные (P), могут полимеризоваться взрывоопасно при нагревании или в огне. Контейнеры могут взорваться при нагревании (PROPIONIC ACID, 2016).
Смесь следует хранить вдали от источников тепла и источников возгорания. При нагревании до разложения выделяет едкий дым и раздражающие пары.
Пропановая кислота раздражает кожу, глаза, нос и горло, но не оказывает острого системного действия и не обладает явным генотоксическим потенциалом. При попадании на кожу следует промыть их большим количеством воды (паспорт безопасности материала Пропионовая кислота, 2013).
биохимия
Основание конъюгата пропановой кислоты, пропионат, образуется в качестве концевого фрагмента из трех атомов углерода (активированного коэнзимом А в виде пропионил-КоА) при окислении нечетных углеродных жирных кислот и окислении боковой цепи холестерин.
Эксперименты с радиоактивными изотопами пропионата, введенными крысам натощак, показывают, что он может появляться в гликогене, глюкозе, промежуточных продуктах цикла лимонной кислоты, аминокислотах и белках..
Путь метаболизма пропановой кислоты включает взаимодействие с коферментом А, карбоксилирование с образованием метилмалонил-кофермента А и превращение в янтарную кислоту, которая входит в цикл лимонной кислоты.
Пропановая кислота может окисляться без образования кетоновых тел и, в отличие от уксусной кислоты, входит в состав углеводов, а также липидов (Bingham, Cohrssen, & Powell, 2001).
Пропионовая ацидурия является одной из наиболее частых органических ацидозов, заболеванием, которое включает в себя множество различных.
Результаты пациентов, родившихся с пропионовой ацидурией, имеют слабые паттерны интеллектуального развития: 60% имеют IQ менее 75 и требуют специального образования.
Успешные пересадки печени и / или почек у нескольких пациентов привели к улучшению качества жизни, но не обязательно предотвратили неврологические и висцеральные осложнения.
Эти результаты подчеркивают необходимость постоянного метаболического мониторинга, независимо от терапевтической стратегии..
приложений
Пропановая кислота подавляет рост бактерий и плесени на уровне от 0,1 до 1% по весу. В результате большая часть производимой пропановой кислоты потребляется в качестве консерванта для кормов и пищевых продуктов для потребления человеком, таких как зерновые и злаки..
Консервация кормов, зерновых и продуктов питания, а также производство пропионата кальция и натрия, который составляет почти 80% мирового потребления пропановой кислоты в 2016 году, по сравнению с 78,5% в 2012 году..
Приблизительно 51% мирового потребления пропановой кислоты используется для кормления животных и сохранения зерна, в то время как почти 29% используется для производства пропионатов кальция и натрия, которые также используются в пищевой и кормовой промышленности..
Другими важными рынками сбыта пропановой кислоты являются производство гербицидов и диэтилкетона. Области применения с меньшим объемом включают ацетон пропионат целлюлозы, фармацевтические препараты, сложные эфиры растворителей, ароматизаторы и ароматизаторы, пластификаторы, красители и вспомогательные вещества для текстиля, кожу и резину..
Потребность в пропановой кислоте в значительной степени зависит от производства кормов и круп, за которыми следуют фасованные продукты и хлебобулочные изделия..
Перспективы глобального роста пропановой кислоты и ее солей в кормах для животных / зерновых и консервирования продуктов питания являются значительными (IHS Markit, 2016).
Другие быстрорастущие рынки включают сложные эфиры пропионата для растворителей, такие как н-бутилпропионат и пентил; Эти сложные эфиры все чаще используются в качестве заменителей растворителей, включенных в список опасных загрязнителей воздуха..
Источник
Способы получения пропановой кислоты
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
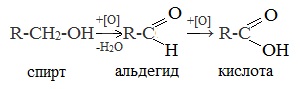
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
В качестве окислителей применяют KMnO4 и K2Cr2O7.
Например:
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.
А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
4. Использование реактива Гриньяра (по схеме)
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
Специфические способы получения важнейших кислот
Способы получения НСООН
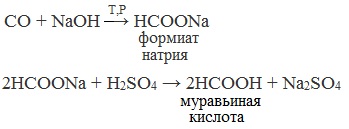
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
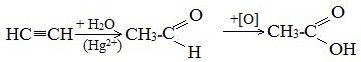
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
Источник