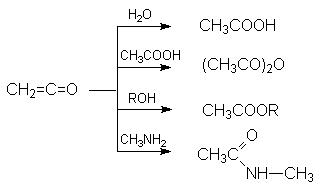
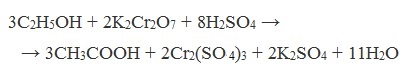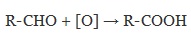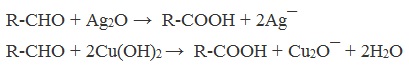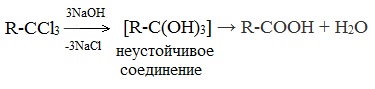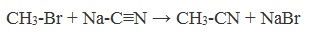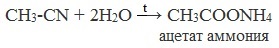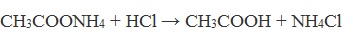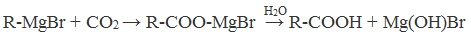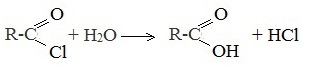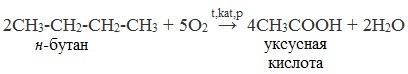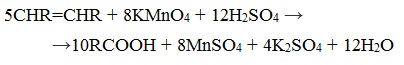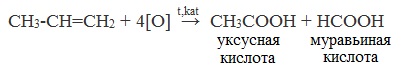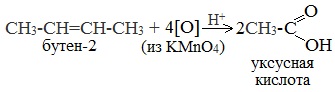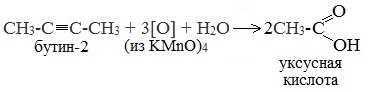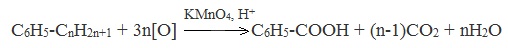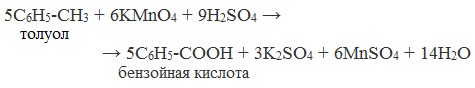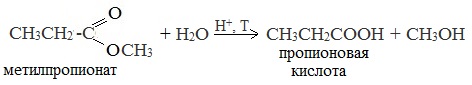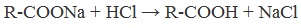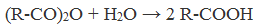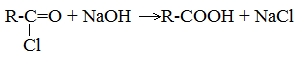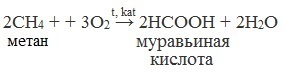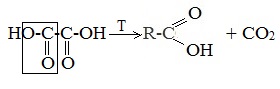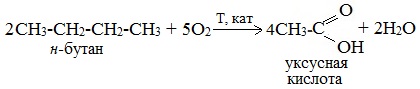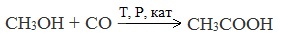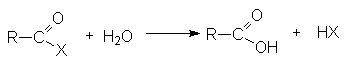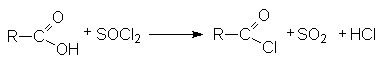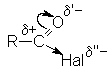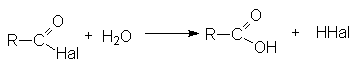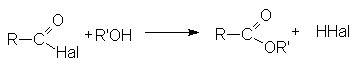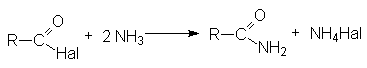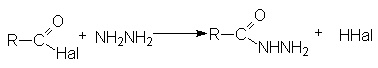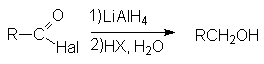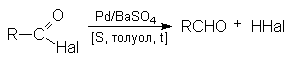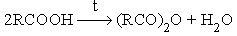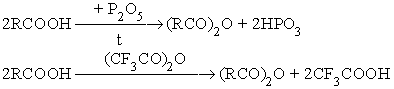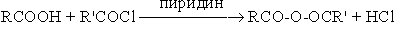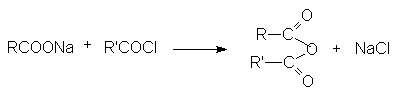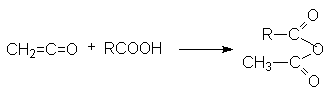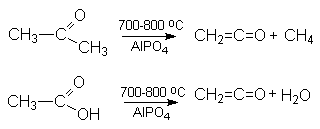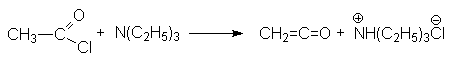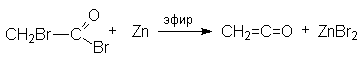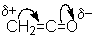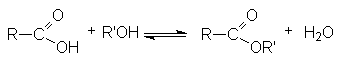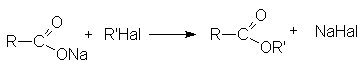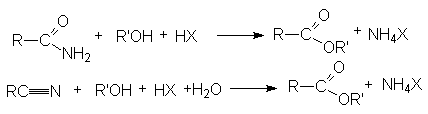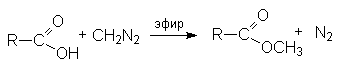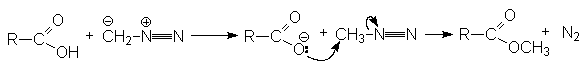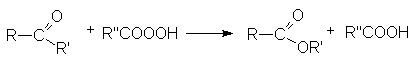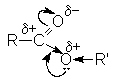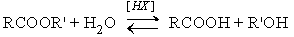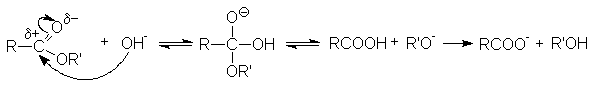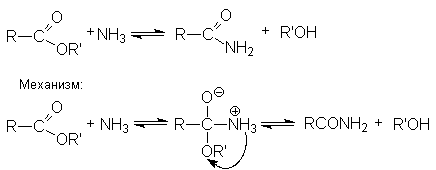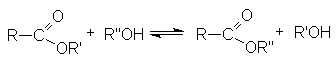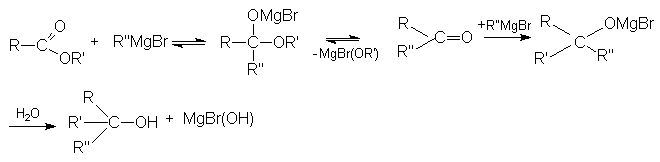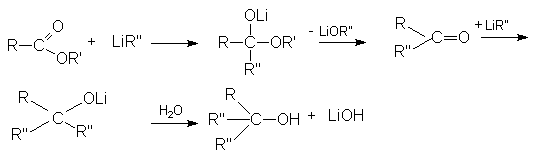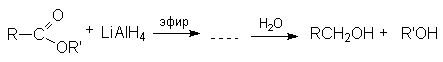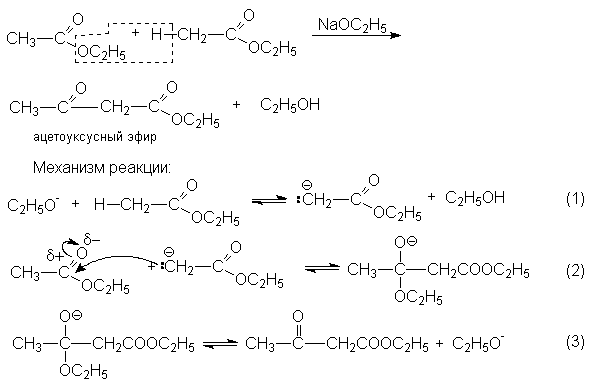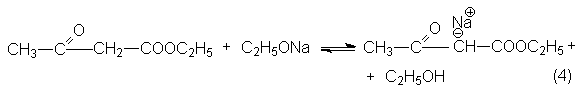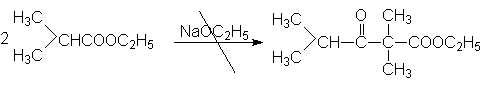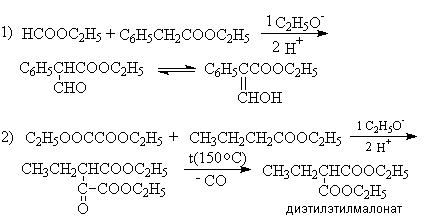Способы получения производных карбоновых кислот
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
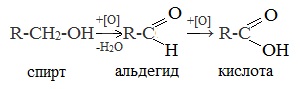
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
В качестве окислителей применяют KMnO4 и K2Cr2O7.
Например:
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.
А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
4. Использование реактива Гриньяра (по схеме)
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
Специфические способы получения важнейших кислот
Способы получения НСООН
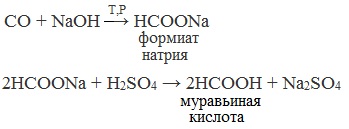
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
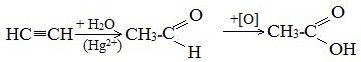
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
Источник
ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ



- Классификация. Номенклатура.
- Галогенангидриды карбоновых кислот. Методы синтеза. Физические и химические свойства.
- Ангидриды карбоновых кислот. Методы синтеза и химические свойства.
- Сложные эфиры. Методы получения. Химические свойства.
- Синтезы на основе эфиров 1,3-кетокислот.
- Амиды карбоновых кислот. Методы получения и химические свойства. Нитрилы карбоновых кислот.
- Производные угольной кислоты.
Функциональные производные карбоновых кислот можно рассматривать как результат замещения гидроксильной группы кислоты на какую-либо другую группу Х. Эти вещества могут быть гидролизованы в кислоту в соответствии с уравнением.
К таким соединениям относят
| галогенангидриды | 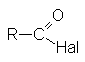 |
| сложные эфиры | 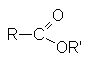 |
| ангидриды | 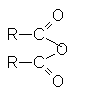 |
| амиды | 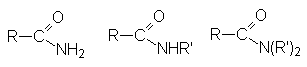 |
| имиды | 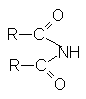 |
Общим элементам структуры этих соединений является ацильная группа
Однако нитрилы R-Cº N также часто рассматриваются как производные карбоновых кислот, поскольку их гидролиз приводит к карбоновым кислотам.
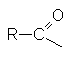
ГАЛОГЕНАНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
Соединения этого ряда выражаются формулой:
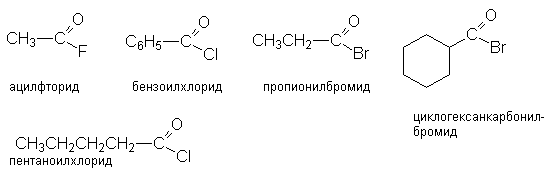
Названия соединений этого ряда складывается из названия ацильного радикала и галогена с окончанием «ид».
- Взаимодействие карбоновых кислот с галогенангидридами неорганических кислот (SOCl2, SO2Cl2, PCl3, POCl3, PCl5, PBr5, COCl2)
Так получают бромиды и хлориды.
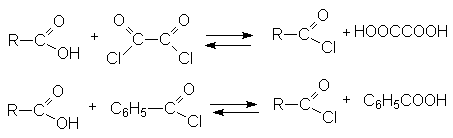
- Реакции диспропорционирования с галогенангидридами органических кислот (оксалилхлорид, бензоилхлорид).
Эти реакции лежат в основе синтеза ацилхлоридов.
Физические свойства и строение
Ацилгалогениды представляют собой бесцветные жидкости или кристаллические вещества с острым запахом, легколетучие, на воздухе «дымят». Низшие ацилфториды газообразны. В воде растворяются плохо, но быстро с ней реагируют. В ацильной группе заряд на карбонильном углероде существенно завышен по сравнению с карбонильным углеродом карбоновых кислот из-за сильных электроакцепторных свойств атомов галогенов
Это обусловливает высокую склонность галогенангидридов к взаимодействию с нуклеофильными реагентами.
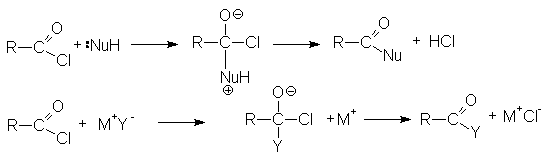
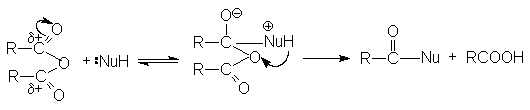
Реакции нуклеофильного замещения
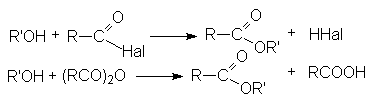
Ацилгалогениды легко реагируют с различными нуклеофильными реагентами, причем эти реакции не требуют катализа. Общая схема этих реакций может быть представлена уравнениями
Важными реакциями нуклеофильного замещения по ацильному углероду являются:
- Взаимодействие со спиртами (этерификация)
- Взаимодействие с аммиаком и аминами (аммонолиз)
- Взаимодействие с гидразином и его производными
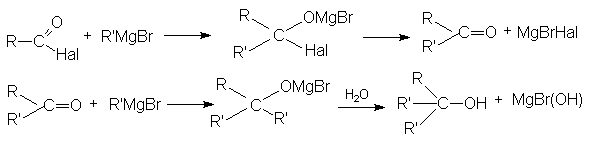
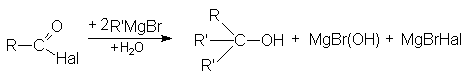
- Взаимодействие с металлоорганическими соединениями
По этому суммарно реакцию можно представить следующей схемой
- Восстановление натрийборгидридом или литийалюминий гидридом.
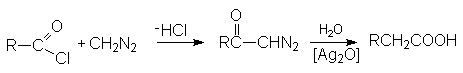
Реакция с диазометаном (реакция Арндта-Эйстерта)
Эта реакция является синтетическим средством увеличения длины углеводородных цепей органических соединений на один атом углерода.
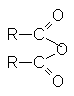
АНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
Строение ангидридов выражается следующей общей формулой
- Термическая дегидратация карбоновых кислот.
- Взаимодействие карбоновых кислот с водоотнимающими агентами.
- Взаимодействие ацилгалогенидов с карбоновыми кислотами.
Таким способом получают несимметричные ангидриды.
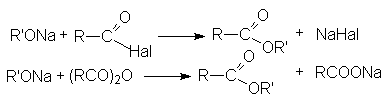
- Взаимодействие ацилгалогенидов с солями карбоновых кислот.
- Взаимодействие кетена и карбоновых кислот.
Химические свойства ангидридов карбоновых кислот
Одна ацильная группа действует на другую как сильный акцептор, поэтому на карбонильном атоме углерода концентрируется достаточно высокий положительный заряд. Это обусловливает высокую реакционную способность ангидридов в реакциях нуклеофильного замещения
Реакция нуклеофильного замещения
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами, хотя скорость реакции меньше, чем в случае ацилгалогенидов.
Общий механизм реакции ангидридов карбоновых кислот с нуклеофилом может быть представлен схемой:
Можно видеть, что в результате реакции кроме продукта нуклеофильного

замещения 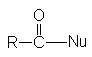
Важнейшими реакциями нуклеофильного замещения с участием ангидридов карбоновых кислот является:
(RCO)2O + R’OH ® RCOOR’ + RCOOH
- Взаимодействие с аммиаком и аминами (аммонолиз).
Кетен формально может рассматриваться как ангидрид уксусной кислоты.
Кетен получают следующими методами:
- Пиролизом кетонов или карбоновых кислот на фосфатных катализаторах.
- Отщепление галогеноводорода от ацилхлоридов в присутствии сильного органического основания, например, третичного амина.
- Дегалогенирование a — галогенацилгалогенида
Химическое поведение кетена определяют два фактора: напряженность
молекулы и высокий положительный заряд на карбонильном углероде
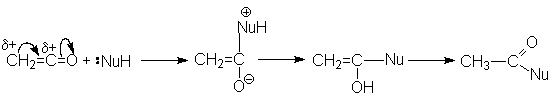
Наиболее типичными реакциями кетенов являются реакции нуклеофильного присоединения.
Наиболее важными среди этих являются реакции гидратации, образования ангидридов сложных эфиров и амидов карбоновых кислот:
Поскольку в результате этих реакций не образуется каких-либо других продуктов, то кетен является идеальным ацилирующим агентом.
Сложные эфиры – производные карбоновых кислот, которые можно рассматривать как результат замещения гидроксильной группы карбоновой кислоты на алкоксирадикал
Методы получения сложных эфиров:
- Этерификация карбоновых кислот (см. химические свойства карбоновых кислот).
- Ацилирование спиртов галогенангидридами и ангидридами карбоновых кислот.
- Ацилирование алкоголятов галогенангидридами и ангидридами карбоновых кислот.
- Алкилирование солей карбоновых кислот.
- Этерификация амидов и нитрилов карбоновых кислот.
- Синтез метиловых эфиров взаимодействием карбоновых кислот с диазометаном.
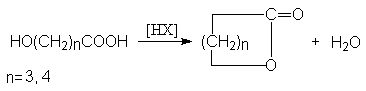
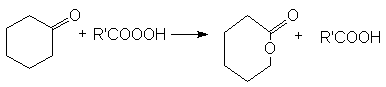
Методы синтеза лактонов (циклических сложных эфиров)
- Внутренняя этерификация g — и d -оксикарбоновых кислот.
Физические свойства и строение сложных эфиров
Сложные эфиры являются бесцветными жидкостями или кристаллическими веществами с приятным запахом. Температура кипения сложных эфиров обычно ниже чем температура близких по молекулярной массе карбоновых кислот. Это свидетельствует об уменьшении межмолекулярных взаимодействий, что объясняется отсутствием межмолекулярных водородных связей.
Полярность связей в молекуле сложного эфира подобна полярности связи в карбоновых кислотах.
Основное отличие от карбоновых кислот – отсутствие подвижного протона, вместо него находится углеводородный остаток. Электрофильный центр находится на карбонильном и алкильном углеродном атоме. В то же время карбонильный кислород обладает основностью.
Объектами нуклеофильной атаки могут быть ацильный или алкильный углерод. В то же время кислотность водородных атомов при a -углеродном атоме радикала кислоты обусловливает склонность сложность эфиров к реакции конденсации.
Реакции нуклеофильного замещения
Различают кислотнокаталитический гидролиз и основной гидролиз (омыление). Кислотный гидролиз представляет собой обратимую реакцию.
Механизм этой реакции – см в разделе Кислотно-каталитическая этерификация – Химические свойства карбоновых кислот.
Реакция омыления необратима. Основание не только ускоряет реакцию гидролиза, но выступает в качестве реагента. Эффективность реакции обусловлена высокой нуклеофильной активностью гидроксил-анионов.
RCOOR’ + NaOH ® RCOONa + R’OH
Реакция катализируется кислотами или основаниями.
- Взаимодействие с магний- и литий-органическими соединениями.
а) Реакция с магнийорганическими соединениями подобна реакции с галогенангидридами.
б) Взаимодействие с Li-органическими соединениями.
Конденсация Кляйзена – наиболее важная в синтетическом отношении реакция. Ее стехиометрический результат заключается в автоконденсации этилацетата, катализируемая этилатом натрия.
Условия равновесия неблагоприятны для всех трех стадий. Поэтому равновесие брутто-реакций существенно смещено в левую сторону.
Факторами смещения равновесия могут быть: отгонка этилового спирта, применение избытка этилата натрия. Последний метод оказывается эффективным, так как этанол более слабая кислота, чем енол сложного эфира, и избыток этилата смещает равновесие нацело вправо вследствие превращения b -кетоэфира в соль енола.
Очевидно, что продукт конденсации необходимо получить из соли енола и выделять в условиях, предотвращающих обратную реакцию распада на исходные реагенты. Наилучшим методом оказывается «замораживание» реакционной смеси для чего ее вливают в избыток холодной кислоты.
Для протекания конденсации Кляйзена необходимы следующие структурные предпосылки: исходный эфир должен иметь водородный атом при a -углеродном атоме, чтобы могли осуществиться реакции, представленные в механизме (реакции (1)-(3)) и два водородных атома при a -углероде, для того чтобы оказалось возможным смещение равновесия реакции в сторону продукта за счет образования енолят-аниона ацетоуксусного эфира.
Очевидно, что этилизобутират не вступает в присутствии этилата натрия в реакцию автоконденсации, поскольку в продукте конденсация отсутствует a -водородные атомы.
Конденсация Кляйзена может быть проведена между двумя сложными эфирами, но поскольку при этом возможно образование четырех различных продуктов, в результате реакции часто получают сложные смеси. Этого удается избежать, если один из сложных эфиров не содержит a -водородных атомов и легко реагируется с карбанионом. Реакции в этом случае напоминают перекрестную альдольную конденсацию. К числу применимых для этой цели сложных эфиров, не содержащих a -водородные атомы и обладающих высокой реакционной способностью относятся эфиры бензойной, муравьиной, щавелевой и угольной кислот.
Примеры:
Источник