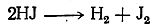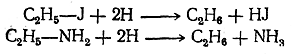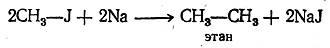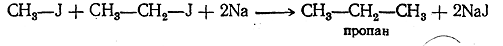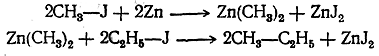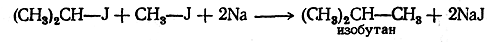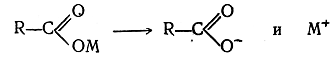- Способы получения предельных углеводородов при которых число атомов углерода остается тем же
- Как написать хороший ответ?
- Способы получения предельных углеводородов (алканов)
- I. Получение из соединений с тем же числом атомов углерода в молекуле:
- //. Получение из соединений с меньшим числом атомов углерода в молекуле:
- ///. Получение из соединений с большим числом атомов углерода в молекуле (реакции расщепления):
- Цикл лекций по теме «Предельные углеводороды»
- Презентация к уроку
Способы получения предельных углеводородов при которых число атомов углерода остается тем же
Вопрос по химии:
Помогите пожалуйста.
Предложите способы получения предельных углевдордов, у которых число атомов углерода:а) остоётся тем же самым б) уменьшается на единицу в) увеличивается в двое
Ответы и объяснения 1
Думаю, что так, но насчет первого не уверена на все 100%
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
Способы получения предельных углеводородов (алканов)
Как было уже сказано, каждый класс органических соединений характеризуется определенными особенностями строения. Мы знаем также, что от строения зависят физические и химические свойства веществ. Следовательно, вещества, принадлежащие к одному классу соединений, должны обладать многими общими или правильно изменяющимися при изменении состава физическими и химическими свойствами. Но не только физические свойства и химически-е реакции, т. е. настоящее и будущее веществ близкого строения, должны иметь много общего; в прошлом таких веществ, т. е. в способах их образования из веществ других классов, также должно быть много общего.
Общие способы получения предельных алифатических углеводородов можно разбить на три группы:
I. Получение из соединений, содержащих в молекуле столько же атомов углерода, сколько их имеется в получаемом углеводороде.
II. Получение из соединений с меньшим числом атомов углерода в молекуле; эти способы можно назвать синтетическими.
III. Получение из соединений с большим числом атомов углерода в молекуле; эти способы относятся к реакциям расщепления молекул.
I. Получение из соединений с тем же числом атомов углерода в молекуле:
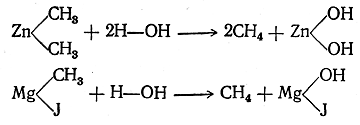
1. Получение из производных введением водорода вместо заместителя. Получение углеводородов из соединений с тем же числом атомов углерода, но содержащих, кроме углерода и водорода, другие атомы или группы, т. е. получение углеводородов из их производных, очевидно, должно состоять в замене этих атомов или групп на атомы водорода (элиминирование заместителя). Иначе говоря, реакции этого рода можно рассматривать как реакции восстановления. Замена указанных атомов или групп на водород в различных органических веществах происходит с различной степенью трудности. Например, в таких металлоорганических соединениях, как цинкорганические или магнийорганические, атомы металла легко заменяются на атомы водорода уже при действии воды:
Как показал Вертело (1868), особенно энергично восстанавливает органические вещества иодистоводородная кислота (при нагревании) вследствие ее способности диссоциировать на водород и иод:
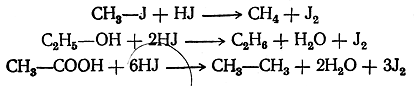
При этом водород в момент выделения (in statu nascendi) действует чрезвычайно энергично как восстановитель. Таким образом, можно различные вещества, даже столь трудно восстанавливающиеся, как органические кислоты, восстановить до углеводородов, согласно следующим примерным уравнениям:
Газообразный водород является при обыкновенной температуре веществом инертным. Чтобы водород вступал в реакции восстановления, нужно действовать им в момент его выделения из соединений, пользуясь, например, цинком или амальгамой натрия и соляной кислотой или литийалюминийгидридом LiAlH. В этом случае реакции сводятся к прямому замещению различных атомов и остатков на водород, например:
2. Получение из непредельных углеводородов. К реакциям восстановления относят и реакции получения предельных углеводородов из непредельных, т. е. содержащих двойные и тройные связи. Здесь речь идет о непосредственном присоединении атомов водорода (реакции гидрирования), например:
Эти реакции также протекают при действии таких восстановителей, как иодистоводородная кислота, но могут идти и с газообразным водородом. Однако в последнем случае, вследствие инертности водорода при обыкновенной температуре, приходится прибегать к помощи катализаторов.
Наиболее сильными катализаторами для реакции восстановления водородом являются металлы группы платины в мелко раздробленном состоянии, особенно сама платина, палладий и осмий. В присутствии этих металлов водород легко вступает в реакции даже при обычной температуре (С. А. Фокин; Вильштеттер).
Чрезвычайно важное значение имело открытие, сделанное французскими учеными Сабатье и Сандераном. Ими было найдено (1905), что очень активным катализатором для реакций присоединения водорода является мелко раздробленный никель при температуре выше 100 °С. Кроме металлического никеля, для этой цели теперь применяют также окись никеля, мелко раздробленную медь и ряд других катализаторов. Очень активным катализатором реакций восстановления водородом являет-
ся так называемый скелетный никелевый катализатор («никель Ренея»); он получается из сплава никеля с алюминием — в остатке после выщелачивания большей части алюминия рас-твором едкого натра.
3. Получение из кетонов. Большое значение имеет реакция Н. М. Кижнера, позволяющая получать углеводороды из соответствующих альдегидов и кетонов.
//. Получение из соединений с меньшим числом атомов углерода в молекуле:
1. Получение из галоидных алкилов. Одной из важнейших синтетических реакций получения предельных углеводородов является действие натрия на галоидные алкилы (реакция Вюрца). Механизм этой реакции подробно изучен П. П. Шорыгиным.
При действии натрия на галоидное соединение галоид отщепляется, а два углеводородных остатка соединяются, образуя молекулу углеводорода:
При этом можно взять два различных галоидных алкила:
Аналогично галоидные алкилы реагируют и с некоторыми другими металлами.
Реакцию можно разделить на две фазы: а) образование металлоорганических соединений и б) действие на них галоидных соединений, приводящее к синтетическому образованию углеводородов, например:
Реакция Вюрца имеет большое значение не только для синтеза углеводородов, но и для доказательства их строения, Подбирая галоидные соединения с соответствующими радикалами, можно получить углеводород любого строения, например.
Обозначая одновалентные углеводородные остатки, или радикалы, буквой R, можно изобразить уравнение реакции Вюр-да в самой общей форме:
R — J + R’— J + 2Na——> R — R’ + 2NaJ
2. Электролиз солей одноосновных органических кислот (реакция Кольбе). В растворах соли одноосновных органических кислот распадаются на ионы:
При электролизе ион металла, теряя на электроде заряд, действует на воду с выделением водорода и образованием едкой щелочи, а ион кислотного остатка, потеряв свой заряд, распадается на радикал R· и двуокись углерода СО2. Два радикала R· соединяются в молекулу R—R.
Согласно сказанному, при пропускании электрического тока через раствор уксуснокислого калия происходит реакция:
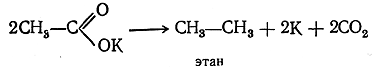
///. Получение из соединений с большим числом атомов углерода в молекуле (реакции расщепления):
Из реакций получения индивидуальных предельных углеводородов, происходящих с расщеплением углеродной цепи, важнейшей является сплавление солей одноосновных предельных кислот с едкими щелочами. Реакция идет по уравнению
Источник
Цикл лекций по теме «Предельные углеводороды»
Презентация к уроку
Цели:
- сформировать представление о строении молекул алканов, гибридизации молекул, общей молекулярной формуле, гомологическом ряде алканов, а также электронном и пространственном строении предельных углеводородов;
- сформировать умение составлять молекулярные формулы алканов и определять тип гибридизации атомов углерода в молекулах углеводородов.
Оборудование:
- компьютер, интерактивная доска, мультимедийный проектор, презентация «Алканы»;
- на столах у учащихся: наборы для собирания моделей молекул.
Актуализация опорных знаний:
На первом этапе урока с учащимися проводится беседа о расшифровке понятия «углеводороды» и истории понятия алканы.
Углеводороды – это органические соединения, состоящие из двух элементов – углерода и водорода. Таких соединений очень много. Это самые простые органические вещества, что отнюдь не умоляет их значения. Напротив, по определению немецкого химика Карла Шорлеммера, «органическая химия есть химия углеводородов и их производных».
Общую формулу углеводородов можно представить в виде CxHy, где x и y связаны между собой определенным соотношением, определяющим класс углеводорода. Единственный углеводород – метан – имеет в своем составе один атом углерода; в остальных углеводородах число x колеблется от двух до нескольких тысяч.
Метан относится к первой группе углеводорода, которые по международной номенклатуре носят общее название «алканы». Алканы – группа предельных углеводородов. Историческое название алканов – парафины (лат. Parrumaffinis– малоактивный). По сравнению с другими углеводородами они относительно менее активны.
Общая формула алканов – CnH2n+2, где n – целое число, показывающее, сколько атомов углерода содержится в молекуле данного углеводорода.
– Напишите молекулярную формулу углеводорода, если в его молекуле содержится 10 атомов углерода. (С10Н2*10+2 или С10Н22 – декан).
Строение молекулы метана.
Далее учащимся предлагается проанализировать структурную и электронную формулы метана,
а также схему гибридизации s- и p-электронных облаков в атоме углерода
и ответить на следующие вопросы:
- Сколько гибридных орбиталей и какой формы образуется при sp3-гибридизации?
- Каков валентный угол между гибридными орбиталями?
- Сколько химических связей и какого типа образуется в молекуле метана?
- Каково пространственное расположение химических связей в молекуле метана?
На рисунке показано, как происходит гибридизация, т.е. взаимное выравнивание s- и p-электронных облаков в атоме углерода (а и б). Эти облака после гибридизации располагаются в пространстве так, что их оси оказываются направленными к вершинам тетраэдра (в). При образовании молекул метана СН4 вершины этих гибридных облаков перекрываются с облаками электронов атомов водорода (г).
Так как в этом случае в гибридизации участвуют один s-электрон и три p-электрона, то такой ее вид называется sp3-гибридизацией. Все связи в молекуле метана относятся к σ-связям. Все четыре углерод-водородные связи направлены к вершинам тетраэдра (правильной треугольной пирамиды). Валентный угол НСН равен 109 o 28′.
Для закрепления и более четкого представления учащимися особенностей строения метана им предлагается собрать модель молекулы метана, используя наборы шариков для составления моделей молекул.
Гомологический ряд метана
Ученикам предлагается сравнить молекулярные формулы метана (СН4) и этана (С2Н6).
– Отнимите математически от молекулы этана молекулу метана. Чем отличаются эти две молекулы предельных углеводородов?
(Если отнять от молекулы этана молекулу метана, то можно заметить между ними разницу в один атом углерода и два атома водорода – СН2).
Если начиная с метана прибавлять группу СН2, то первой получаем молекулу этана, прибавив к которой ту же группу – получаем следующий углеводород – пропан и так далее. Таким образом – каждый последующий углеводород отличается от предыдущего группой атомов СН2, которую называют гомологической разностью. Родоначальников всех предельных углеводородом является метан, а углеводороды, различающиеся на гомологическую разность – гомологичными.
Электронное и пространственное строение предельных углеводородов
Электронное и пространственное строение других представителей предельных углеводородов сходно со строением молекулы метана. В молекуле этана С2Н6 химическая связь образуется между двумя атомами углерода перекрыванием двух гибридных электронных облаков.
Так как гибридные электронные облака атомов углерода направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109º 28´.
Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь поэтому принимает зигзагообразную форму, но при изображении формул эти углы не показывают (СН3–СН2–СН2–СН2–СН3 и другие).
Изомерия и номенклатура алканов.
Нахождение в природе. Получение алканов
Цели:
- Сформировать умение у учащихся давать название изомерам алканов по привила ИЮПАК.
- Показать основные способы получения предельных углеводородов.
Этот материал является продолжением предыдущего и начать его целесообразно с проверки качества усвоения учебного материала с помощью заданий различного уровня сложности . Далее приступаем к изучению нового материала.
Изомерия и номенклатура
Так как углеводородов очень много, то для них международным союзом теоретической и прикладной химии принята специальная номенклатура – International Union of Pure and Applied Chemistry, сокращенно IUPAC (ИЮПАК). Она была уточнена в 1979 году. Чтобы пользоваться ею, необходимо более подробно ознакомиться с понятием «радикал» и явлением изомерии.
В таблице даны формулы десяти первых предельных углеводородов. Если мысленно вычесть из их формул по одному атому водорода, то получаются группы атомов, которые называются радикалами. Названия радикалов образуются от названий соответствующих углеводородов путем изменения суффикса -ан на -ил, например: метил СН3, этил СН3–СН2–, пропил СН3–СН2–СН2– и т.д.
Многочисленность углеводородов объясняется явлением изомерии. С возрастанием числа атомов углерода в молекуле число изомеров резко увеличивается. Так, например, у бутана их 2, у пентана – 3, у гексана – 5, а у декана – уже 75.
Для предельных углеводородов характерен один единственный вид изомерии – углеродного скелета (структурная изомерия). Именно тот факт, что явление изомерии имеет место, в органической химии необходимо применять структурные, а не молекулярные формулы. Необходимо отметить, что изомеры отличаются друг от друга не только строением, но и физическими свойствами, например температурой кипения. Углеводороды с разветвленной цепью кипят при более низкой температуре, чем соответствующие им соединения нормального строения, а температура плавления, наоборот, выше у изомеров с разветвленной цепью.
Далее целесообразно познакомить учащихся с правилами номенклатуры углеводородов:
1. Выбирают в формуле наиболее длинную углеродную цепь и символы атомов углерода в ней нумеруют, начиная с того конца цепи, к которому ближе разветвление
2. Называют радикалы (начиная с простейшего) и при помощи цифр указывают их место у нумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых радикала, тогда номер повторяют дважды. Число одинаковых радикалов указывают при помощи чисел на греческом языке («ди» – два, «три» – три, «тетра» – четыре и т.д.):
3. Полное название данному углеводороду дают по числу атомов углерода в нумерованной цепи:
а) 2-метилпентан
б) 2,2-диметилбутан
в) 3-метилпентан
г) 2,3-диметилбутан
Составление формулы алкана по его названию идет в обратном порядке. Сначала изображают главную цепь и нумеруют ее (как удобно, но лучше слева направо). Затем расставляют заместители к тем атомам углерода, которые указаны в названии. В конце к атомам углерода в главной цепи дописывают недостающие атомы водорода.
Затем следует учащимся предложить выполнить задания №№ 26, 27 для закрепления умения давать названия изомерам.
Нахождение в природе
Простейший представитель предельных углеводородов – метан – образуется в природе в результате разложения остатков растительных и животных организмов без доступа воздуха. Этим объясняется появление пузырьков газа в заболоченных водоемах. Иногда метан выделяется из каменноугольных пластов и накапливается в шахтах. Метан составляет основную массу природного газа (80-97 %). Он содержится и в газах, выделяющихся при добыче нефти. В состав природного газа и нефтяных газов входят также этан, пропан, бутан и некоторые другие. Газообразные, жидкие и твердые предельные углеводороды содержатся в нефти.
Получение
В лаборатории метан получают прокаливанием безводного ацетата натрия с натронной известью. Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция
Тщательно перемешаем натронную известь с ацетатом натрия и поместим в пробирку. Закроем пробирку пробкой с газоотводной трубкой. Нагреем смесь. Через некоторое время начинает выделяться метан:
Этан и другие предельные углеводороды с более длинной углеродной цепью можно получить при взаимодействии однородных галогенопроизводных предельных углеводородов с металлическим натрием:
Первым эту реакцию в 1855 г. осуществил французский химик А. Вюрц (реакция Вюрца). Замечательная особенность реакции Вюрца – удвоение числа атомов углерода в продукте по сравнению с исходным веществом.
Примером специфического способа получения алканов является гидролиз карбида алюминия. Этимология слова гидролиз (от греч. слов hidor – вода и lisis– распад, разложение) позволяет определить такие реакции, как процесс разложения сложного соединения на два и более новых веществ под действием воды:
Для закрепления материала рекомендуется решить ряд задач на способы получения алканов, а также вспомнить задачи на нахождение формулы вещества по массовым долям элемента.
Список литературных источников:
1. Габриелян О.С., Остроумов И.Г. Настольная книга учителя химии. 10 класс. – М.: «Блик и Кº», 2001.
2. Губанова Ю. К. Сборник задач по органической химии с решениями. — Саратов: «Лицей», 1999.
3. Оржековский П.А. ЕГЭ 2009. Химия. Сборник заданий / П.А. Оржековский, Н.Н. Богданова, Е.Ю. Васюкова и др. – М.: Эксмо, 2009.
4. Рудзитис Г.Е. Химия: Орган. химия: Учеб. для 10 кл. общеобразоват. учреждений. / Г.Е. Рудзитис, Ф.Г. Фельдман. – 8-е изд. – М.: Просвещение, 2001
5. Самое полное издание типовых вариантов заданий ЕГЭ: 2011: Химия / авт.-сост. А.А. Каверина, Д.Ю. Добротин, А.С. Корощенко, М.Г. Снастина. – М.: АСТ: Астрель, 2011.
Источник