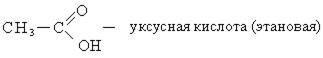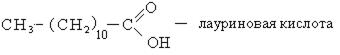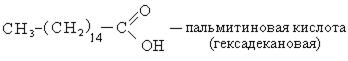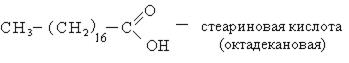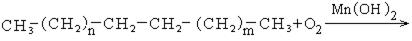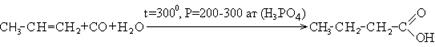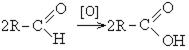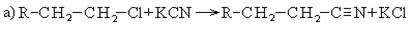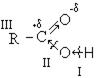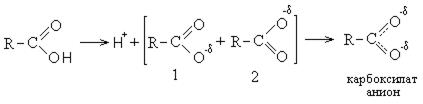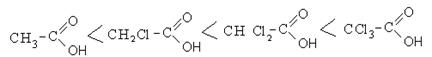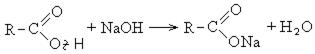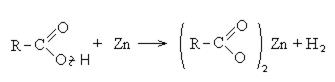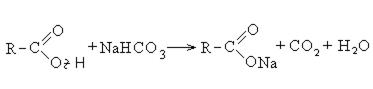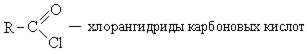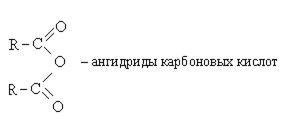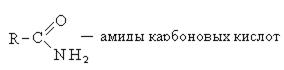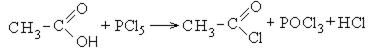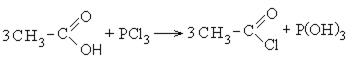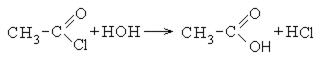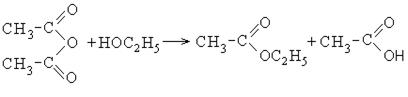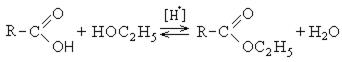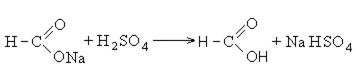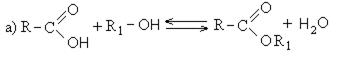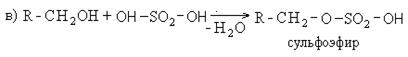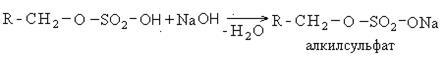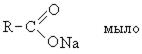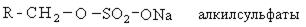Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
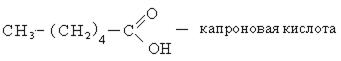
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
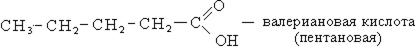
- Пентановая — C4H9-COOH — валериановая кислота
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
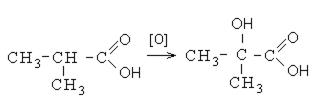
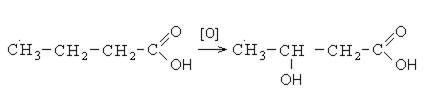
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
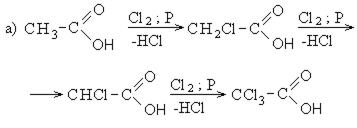
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.
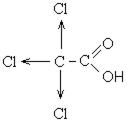
Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
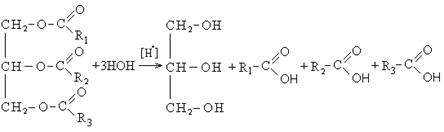
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
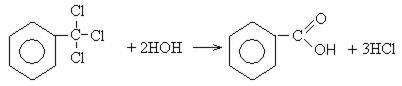
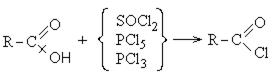
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Предельные одноосновные карбоновые кислоты
Номенклатура. В ряду карбоновых кислот чаще всего используют тривиальные названия, многие из которых указывают на источник получения карбоновых кислот.
По систематической номенклатуре название карбоновых кислот образуется от названия соответствующих алканов с добавлением окончания «овая» и слова «кислота». Нумерацию углеводородной цепочки начинают с углерода карбоксильной группы.
Способы получения. Известен ряд общих способов получения кислот.
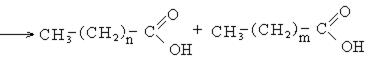
1. Каталитическое окисление парафиновых углеводородов кислородом воздуха:
В промышленности для получения карбоновых кислот используют парафиновые углеводороды с числом углеродных атомов С20 – С40 и получают кислоты С10 – С20.
2. Реакция оксосинтеза:
3. Окисление альдегидов:
Необходимые для синтеза кислот, альдегиды получают по реакции Кучерова или каталитическим дегидрированием спиртов.
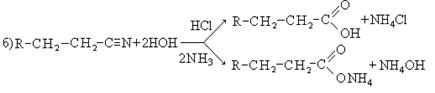
4. Гидролиз нитрилов:
5. Гидролиз геминальных галогенпроизводных:
6. Гидролиз жиров:
Химические свойства карбоновых кислот.Химические свойства карбоновых кислот определяются теми электронными эффектами, которые действуют в карбоксильной группе и молекуле в целом.
Электронная структура молекулы позволяет выделить следующие основные направления протекания химических реакций карбоновых кислот:
― реакции с разрывом связи О-Н (направление I);
― реакции с разрывом связи С-О (направление II);
― реакции в углеводородном радикале (направление III).
I. Кислотно-основные свойства кислот (направление I). Влияние кислорода карбонильной группы приводит к накапливанию частично положительного заряда на атоме углерода, что в свою очередь, за счет индукционного эффекта, приводит к значительному снижению электронной плотности на кислороде гидроксильной группы, вследствие чего протон практически не удерживается, легко отрывается и кислоты обладают ярко выраженными кислотными свойствами.
Диссоциация кислот с отрывом протона выгодна и энергетически, так как при этом образуется карбоксилат анион, стабилизированный резонансом и обладающий меньшей энергией, чем исходная кислота. Карбоксилат-анион является гибридом двух структур (1 и 2), стабилизированных резонансом. В карбоксилат-анионе атом находится в состоянии sp 2 — гибридизации. Не спаренный p- электрон углерода одинаково равномерно перекрывается с p- электроном двух атомов кислорода.
Присутствие галогена в алкильном радикале усиливает кислотные свойства кислот. Наиболее сильной кислотой является трихлоруксусная кислота. Легкость отрыва протона в трихлоруксусной кислоте объясняется отрицательным индукционным эффектом галогена, что уменьшает электронную плотность на карбоксилат-анионе и дестабилизирует его.
Кислотность галогензамещенных карбоновых кислот изменяется в следующем порядке:
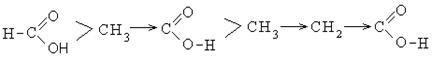
Присутствие донорных заместителей в алкильном радикале увеличивает электронную плотность на карбоксилат-анионе и протон сильнее удерживается им.
В этом ряду муравьиная кислота обладает большими кислыми свойствами, чем уксусная.
Карбоновые кислоты взаимодействуют с активными металлами, гидроксидами металлов, солями:
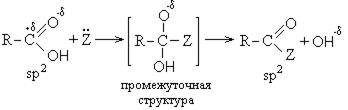
II Реакции с разрывом связи С-ОН (направление II).
Реакции с разрывом связи С-ОН протекают по механизму нуклеофильного замещения (SN) и приводят к образованию так называемых функциональных производных карбоновых кислот. К ним относятся:
Механизм реакций нуклеофильного замещения сводится к следующему:
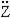
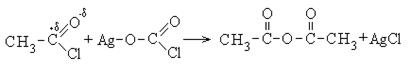
1. Образование хлорангидридов карбоновых кислот:
Хлорангидриды карбоновых кислот являются реакционно способным классом соединений и широко используются в органическом синтезе для получения диоксикетонов и карбоновых кислот:
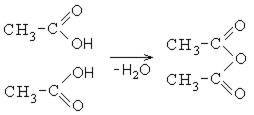
2. Образование ангидридов карбоновых кислот:
Ангидриды карбоновых кислот также являются реакционно-способными соединениями. Ангидрид уксусной кислоты используется как ацелирующий агент:
При растворении уксусного ангидрида в воде образуется уксусная кислота.
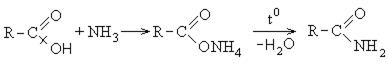
3. Образование амидов карбоновых кислот:
4. Образование сложных эфиров:
III. Реакции в углеводородном радикале (направление III). Эти реакции протекают по механизму радикального замещения (SR):
Кроме выше перечисленных направлений взаимодействия карбоновые кислоты вступают в реакции окисления. Окисление карбоновых кислот протекает в жестких условиях с образованием оксикислот. В неразветвленных карбоновых кислотах окисление проходит в β- положении, а в разветвленных – в α-положении к углероду карбонильной группы:
Применение карбоновых кислот.Муравьиная кислота – жидкость с резким запахом. В промышленности муравьиную кислоту получают из формиата натрия, который образуется при пропускании оксида углерода через раствор едкого натра.
Полученную соль действием серной кислоты переводят в свободную кислоту:
Муравьиная кислота широко распространена в природе. Она содержится в крапиве, хвое, является продуктом жизнедеятельности муравьев. Муравьиная кислота используется как консервирующий агент. Раствор её в этаноле известен как муравьиный спирт.
Уксусная кислота. Эту кислоту называют еще ледяной, так как при +16,5 0 С она застывает в кристаллическую массу. Уксусная кислота обладает характерным острым запахом и смешивается с водой в любых соотношениях. 3-5% раствор уксусной кислоты известен под названием уксуса, а 70-80 % раствор как уксусная эссенция. Для пищевых целей уксусную кислоту получают уксусно-кислым брожением.
Высокомолекулярные карбоновые кислоты (пальмитиновая и стеариновая). Смесь этих кислот называют стеарином. Стеарин применяется для изготовления свеч, создания основы для губных помад, обувных кремов. Стеарин получают возгонкой гидролизованного жира. Высокомолекулярные карбоновые кислоты с числом углеродных атомов С10-С20 используется для получения активной основы синтетических моющих средств.
В качестве активной основы моющих средств обычно выступают алкилсульфаты. Общая схема получения алкилсульфанатов сводится к следующему:
Содержание алкилсульфатов в рецептурах синтетических моющих средств составляет 30%. Они являются поверхностно активными веществами и обладают высокой моющей способностью.
Моющее действие поверхностно-активных веществ. Поверхностно-активными веществами называются соединения, способные адсорбироваться на поверхности раздела фаз и изменять их поверхностное натяжение. К поверхностно активным веществам, обладающим моющими свойствами, относятся:
Структуру поверхностно-активных веществ можно рассматривать состоящей из двух фрагментов: гидрофильная часть, то есть растворимая в воде и гидрофобная часть, представленная длинноцепочным углеводородным радикалом, нерастворимая в воде.
Моющее действие поверхностно-активных веществ объясняется следующими факторами: при гидролизе поверхностно активных веществ создается щелочная среда, которая вызывает эмульгирование жиров с поверхности. Сами поверхностно-активные вещества обеспечивают стабильность этих эмульсий. Стойкие эмульсии образуются за счет адсорбции поверхностно-активных веществ на поверхности жировых капель, что не позволяет этим каплям (грязи) соединяться друг с другом и грязь не оседает на ткани, а остается в водной среде и удаляется.
Дата добавления: 2015-03-19 ; просмотров: 4006 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник