- Фосфорная кислота: получение и свойства
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Способы получения ортофосфорной кислоты
- Ортофосфорная кислота
- Строение молекулы
- Физические свойства
- Химические свойства
- Получение
- Ортофосфорная кислота. Получение и применение.
- Как получают ортофосфорную кислоту
- Ортофосфорная кислота в разных сферах жизни человека: где применяется
- Сельское хозяйство и фермерство
- Пищевая промышленность
- Производство бытовой химии и стройматериалов
- Молекулярная биология
- Медицина
- Вредна ли ортофосфорная кислота для человека
- Ортофосфорная кислота
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Термический способ
- Экстракционный способ
- Концентрирование и очистка
- Экономические и экологические аспекты
- Применение
- Авиационная промышленность
- Пищевая промышленность
- Сельское хозяйство
- Стоматология
- Безопасность
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Источник
Способы получения ортофосфорной кислоты
Степень окисления фосфора равна +5.
Оксид фосфора (V), взаимодействуя с водой, образует метафосфорную кислоту, последняя при кипячении переходит в ортофосфорную, при нагревании ортофосфорной кислоты образуется пирофосфорная кислота.
Метафосфорная кислота HPO3 неустойчива и в чистом виде не выделена, так же как не выделены из растворов её соли. Существует в виде полимеров. Относится к сильным кислотам, ей не свойственны окислительные и восстановительные свойства.
Ортофосфорная кислота
Среди оксокислот фосфора наибольшее значение имеет ортофосфорная кислота Н3РО4, она является наиболее устойчивой из всех кислот фосфора.
Строение молекулы
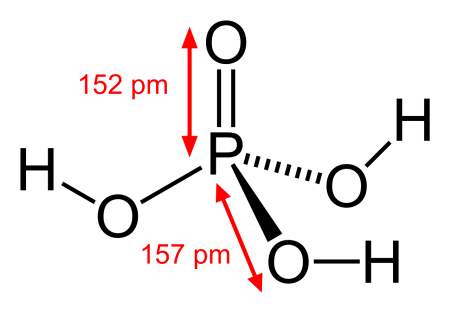
В газовой фазе молекула имеет форму тетраэдра с атомом фосфора в центре, в вершинах тетраэдра находятся атом кислорода и три гидроксогруппы. Поэтому фосфорная кислота является трехосновной.
В кристаллическом виде она построена из молекул РО(ОН)3, связанных водородными связями в двухмерные слои. Твердую фосфорную кислоту получить очень сложно: благодаря большому числу водородных связей концентрирование растворов приводит к образованию вязких сиропов, которые кристаллизуются лишь со временем.
Физические свойства
Бесцветные гигроскопичные кристаллы моноклинной сингонии, плотность 1,88 г/см 3 , температура плавления 42,5 °С. Расплывается на воздухе, смешивается с водой в любых соотношениях. Не ядовита.
Химические свойства
При комнатной температуре довольно инертна, при нагревании проявляет свойства кислот, относится к кислотам средней силы.
- Диссоциация в водном растворе:
Реагирует с металлами, стоящими в ряду напряжений металлов до водорода:
С оксидами металлов:
Не проявляет ни окислительных, ни восстановительных свойств.
Получение
Термический способ получения фосфорной кислоты основан на окислении элементарного фосфора в избытке воздуха с последующей гидратацией и образующегося оксида фосфора (V) и конденсацией фосфорной кислоты:
Также ортофосфорную кислоту получают при переработке апатитов:
Источник
Ортофосфорная кислота. Получение и применение.
Автор: Tyorkin · Опубликовано 27 января, 2013 · Обновлено 7 июля, 2018
Ортофосфорная (иногда встречается название фосфорная) кислота — кислота неорганического происхождения, средней мощности действия. Она представляет собой простую химическую формулу и обозначается как H3PO4.
При соблюдении типичных условий и оптимальных температур хранения имеет вид аккуратных гигроскопичных кристаллов без цвета. В случаях, если температура разогревается до отметок от +42 до +213 градусов по Цельсию, упомянутое вещество преобразовывается в пирофосфорную кислоту с похожей химической формулой — H4P2O7.
Чаще всего ортофосфорной кислотой называют приблизительно 85%-й раствор на основе воды, который не имеет аромата и характеризуется в меру густым сиропоподобным видом. Кроме воды, упомянутая кислота отлично растворяется также в спирте и иных популярных растворителях.
Как получают ортофосфорную кислоту
Дабы получить упомянутое химическое соединение, не нужно иметь много денежных средств или времени. Как и лимонная, ортофосфорная кислота ныне очень востребована и производится в огромных количествах. На сегодняшний день специалистам известно три верных метода добычи ортофосфорной кислоты:
1. Гидролизом пентахлорида фосфора;
2. Получение из фосфата (экстракционный метод);
3. Смешиванием оксида фосфора(V) с обычной водой, полученного путем сжигания фосфора в кислороде (термический метод).
Так как реакция с водой проходит очень оживленно, оксид фосфора(V) обрабатывают разогретым до 200 градусов по Цельсию концентрированным раствором ортофосфорной кислоты.
Незначительное количество вещества можно без труда получить в лабораторных условиях методом окисления фосфора. А вот для производства такого соединения в серьезных, промышленных масштабах не обойтись без экстракционного и термического способа.
Ортофосфорная кислота в разных сферах жизни человека: где применяется
Сфера применения фосфорной кислоты сегодня весьма интересна и разнообразна. Так, упомянутое химическое вещество является незаменимым в разных отраслях промышленности, среди каких — пищевая.
Ортофосфорная кислота имеет едва выраженные кислотные свойства, легко вступает в реакцию с солями слабоактивных кислот, всевозможными металлами, основными оксидами, основаниями, аммиаком. Доступная цена сделала ортофосфорную кислоту востребованной в совершенно разных сферах.
Сельское хозяйство и фермерство
Соединение является очень распространенной добавкой для изготовления востребованных фосфорных либо комбинированных удобрений: солей аммония, кальция, натрия, марганца. По статистике, около 90% фосфорсодержащей руды расходуется для производства удобрений. Фосфор важен для растений при формировании семян и плодов. При этом, странами-производителями таких удобрений принято считать Соединенные Штаты Америки, Россию и Марокко, а странами-потребителями — практически все страны Африки, Азии и Европейского Союза.
На фермерских хозяйствах ветеринары часто советуют осуществлять выпойку животных раствором фосфорной кислоты с целью предотвращения возникновения камней в почках и желчном пузыре, повышения уровня кислотности желудка.
Пищевая промышленность
Особый интерес вызывает применение химических элементов, в том числе и фосфорной кислоты в пищевой промышленности. Так, в данной сфере ортофосфорная кислота выступает в роли регулятора кислотности и обозначается маркировкой Е338. Она — отличный антиоксидант, сохраняет цвет и продлевает срок годности различных напитков и продуктов питания.
В частности, добавку Е338 часто добавляют в такие востребованные среди населения продукты: разные колбасные изделия, плавленные сырки, разрыхлители, хлебобулочные и кондитерские изделия, молоко и детское питание, подслащенные газированные напитки и так далее.
Самый популярный напиток, в котором содержится ортофосфорная кислота — «Coca-cola». Как известно, такой напиток способен даже очистить металлические поверхности от ржавчины. При этом, концентрация кислоты в данном напитке не такая высокая, чтобы серьезно навредить желудку человека при употреблении в небольших количествах.
Производство бытовой химии и стройматериалов
Благодаря активному применению ортофосфорной кислоты и ее доступности, производители выпускают на рынок стройматериалов устойчивые к возгоранию лакокрасочные материалы, среди каких: лак, эмаль, пропитки, деревянные плиты и прочие материалы для строительства и ремонта. Незаменима фосфорная кислота и для производства спичек.
Растворы ортофосфорной кислоты активно применяются мастерами на деревообрабатывающих хозяйствах. Благодаря пропитке древесины данным веществом, дерево становится огнестойким.
Соли ортофосфорной кислоты отлично смягчают хлорированную воду, они содержатся в составе многих средств бытовой химии. Например, это стиральные порошки и гели, средства для мытья посуды, жидкости для устранения ржавчины и жира на поверхностях и так далее.
Молекулярная биология
Используется специалистами для проведения различных экспериментов и исследований.
Медицина
Интересно, что в медицине ортофосфорная кислота — компонент активированного угля. Также много лет она активно используется в стоматологии — при пломбировании. В незначительных количества этот состав присутствует в зубных пастах и отбеливателях для зубов.
Мало кто догадывается, что фосфорная кислота также является элементом протиток для изготовления непромокаемой и непродуваемой верхней одежды, в частности — горнолыжных костюмов.
Вредна ли ортофосфорная кислота для человека
Помните, что все хорошо в меру. Ортофосфорная кислота считается относительно безопасным химическим соединением при соблюдении норм ее потребления. Избыток потребления ортофосфорной кислоты вместе с продуктами питания может привести к плохому самочувствию, отвращению к еде, потере веса, хрупкости костей. Поэтому лучше избегать чрезмерного употребления продуктов с пищевой добавкой Е338.
При попадании кислоты в виде концентрированного раствора на кожу и слизистые человека, возможны ожоги. Также некоторые врачи-стоматологи заметили, что ортофосфорная кислота вредит верхнему слою зубной эмали при частом использовании для лечения зубов.
Источник
Ортофосфорная кислота
| Ортофосфорная кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Ортофосфорная кислота |
| Хим. формула | H3PO4 |
| Состояние | твёрдое |
| Молярная масса | 98,0 г/моль |
| Плотность | 1,685 (жидк) |
| Динамическая вязкость | 2,4-9,4 сПуаз |
| Т. плав. | +42,35 °C |
| Т. кип. | +158 °C |
| Давление пара | 0,03 ± 0,01 мм рт.ст. |
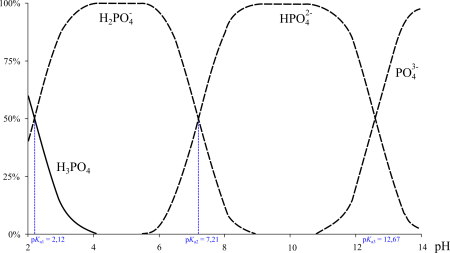
| pKa | 2,12; 7,21; 12,67 |
| Растворимость в воде | 548 г/100 мл |
| ГОСТ | ГОСТ 10678-76 ГОСТ 6552-80 |
| Рег. номер CAS | 7664-38-2 |
| PubChem | 1004 |
| Рег. номер EINECS | 231-633-2 |
| SMILES | |
| Кодекс Алиментариус | E338 |
| RTECS | TB6300000 |
| ChEBI | 26078 |
| Номер ООН | 1805 |
| ChemSpider | 979 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ортофосфорная кислота (фосфорная кислота) — неорганическая кислота средней силы с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 %-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле и других растворителях.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Термический способ
- 3.2 Экстракционный способ
- 3.3 Концентрирование и очистка
- 3.4 Экономические и экологические аспекты
- 4 Применение
- 4.1 Авиационная промышленность
- 4.2 Пищевая промышленность
- 4.3 Сельское хозяйство
- 4.4 Стоматология
- 5 Безопасность
Физические свойства
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллы имеют моноклинную сингонию. Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
Из 85 %-ой фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O.
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40-50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой.
Химические свойства
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10 –3 (pKa1 2,12); K2 = 6,2⋅10 –8 (pKa2 7,20); K3 = 5,0⋅10 –13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична.
| H3PO4(aq) + H2O(l) ⇌ H3O(aq) + + H2PO4(aq) − |
| H2PO4(aq) − + H2O(l) ⇌ H3O(aq)+ + HPO4(aq) 2− |
| HPO4(aq) 2− + H2O(l) ⇌ H3O(aq) + + PO4(aq) 3− |
Как следствие, фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами. Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик.
Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок:
Качественной реакцией на ион H2PO4 − является образование ярко-жёлтого осадка молибденофосфата аммония:
H3PO4 + 12[NH4]2MoO4 + 21HNO3 → [NH4]3PMo12O40 ⋅ 6H2O↓ + 21NH4NO3 + 6H2O 
Получение
Впервые фосфорную кислоту из оксида фосфора(V) получил Роберт Бойль в 1694 году. Лабораторный метод получения заключается в окислении фосфора азотной кислотой:
Термический способ
В промышленности используют два основных способа получения фосфорной кислоты: термический и экстракционный. Термический способ заключается в сжигании фосфора до оксида фосфора(V) и реакции последнего с водой:
Технически этот процесс реализуется по-разному. В так называемом IG-процессе (от названия фирмы IG) обе реакции проводятся в одной реакционной колонне. Сверху в неё сжатым воздухом или паром под давлением 1,5 МПа через сопло подаётся фосфор, который сгорает при температуре >2000 °C. Полученный оксид фосфора(V) поглощается фосфорной кислотой, которая стекает сверху по стенкам колонны, целиком покрывая их. При этом она одновременно выполняет несколько функций: растворяет оксид фосфора(V), отводит теплоту из реакции сгорания и защищает стенки колонны от пламени. Полученная фосфорная кислота собирается под колонной, пропускается через теплообменник и подаётся в верхнюю часть колонны, откуда снова стекает по стенкам. Материалом для установки по получению фосфорной кислоты служит нержавеющая сталь с низким содержанием углерода. До 100 °C она устойчива к концентрированной фосфорной кислоте.
Получаемая этим способом фосфорная кислота практически не содержит примесей соединений фосфора в низших степенях окисления (содержание фосфористой кислоты H3PO3 составляет всего 0,1 %). Однако её необходимо очистить от примесного мышьяка, который в низких концентрациях содержится даже в очень чистом фосфоре. Эта очистка осуществляется воздействием сероводорода (для его получения в фосфорную кислоту вводят сульфид натрия) и осаждением сульфида мышьяка с последующим фильтрованием.
На этих реакциях основан также TVA-процесс (от Tennessee Valley Authority ), однако сжигание фосфора и поглощение оксида фосфора(V) проводится отдельно. Фосфор и воздух подаются в стальную камеру сгорания с внешним охлаждением, после чего продукты сгорания через верхнюю часть камеры подпадают в камеру поглощения, где и образуется фосфорная кислота. В Хёхст-процессе (от названия фирмы Hoechst) сгорание и поглощение проводятся отдельно, однако он отличается тем, что теплота сгорания фосфора там используется для генерирования пара.
Экстракционный способ
Экстракционный способ производства фосфорной кислоты заключается в обработке природных фосфатов неорганическими кислотами (в странах СНГ преимущественно хибинского апатитового концентрата и фосфоритов Каратау). Фосфаты обрабатывали серной кислотой ещё в середине 1880-х гг., однако развитие этой области началось после Второй мировой войны благодаря повышенному спросу на минеральные удобрения.
Разложение сырья происходит по следующей схеме (x от 0,1 до 2,2):
Побочным продуктом этой реакции является сульфат кальция, который в зависимости от температуры и концентрации фосфорной кислоты может выпадать в виде дигидрата (CaSO4·2H2O) или гемигидрата (CaSO4·0,5H2O). По этому признаку экстракционные процессы получения фосфорной кислоты делят на дигидратные, гемигидратные и комбинированные (дигидратно-гемигидратный и гемигидратно-дигидратный). Существует также ангидритный метод (с осаждением безводного сульфата кальция), который, однако, в промышленности не используется, так как он связан с серьёзными коррозионными проблемами.
Дигидратный процесс является классическим методом получения фосфорной кислоты. Его преимущества заключаются в относительно низкой температуре, благодаря чему удаётся избежать коррозии. Кроме того, можно использовать различное фосфатное сырьё и перерабатывать его в больших количествах. Для начала сырьё измельчают до размера частиц меньше 150 мкм. Фосфат и серная кислота подаются в реактор по отдельности, чтобы образование слоя сульфата кальция на частицах не затрудняло дальнейшего разложения. Температура процесса составляет 70-80 °С, а концентрация фосфорной кислоты в системе равна 28-31 % в пересчёте на P2O5. В этих условиях сульфат кальция образуется в виде дигидрата. Недостатком метода является то, что исходное сырьё необходимо перемалывать, а полученную фосфорную кислоту дополнительно концентрировать до 40-55 % и даже до 70 % P2O5.
Гемигидратный процесс был разработан для того, чтобы избежать необходимости концентрирования полученной фосфорной кислоты. Он проводится при более высокой температуре (80-100 °С) — в условиях, когда более устойчивой формой является гемигидрат сульфата кальция. Фосфорная кислота при этом получается в концентрации 40-48 %. Гемигидратно-дигидратный процесс разработан в Японии в связи с тем, что он позволяет получать практически чистый гипс, залежи которого в этой стране отсутствуют. Обработка сырья ведётся при высокой температуре, и образуется гемигидрат сульфата кальция, однако затем его перекристаллизовывают в дигидрат.
Концентрирование и очистка
Для концентрирования фосфорной кислоты, полученной дигидратным процессом, используют вакуумное испарение, хотя на старых заводах до сих пор применяют погружное горение. Иногда используют последовательно несколько испарителей, так что пары с одного испарителя используются для нагрева раствора в следующем испарителе. Кроме того, при испарении воды из фосфорной кислоты также удаляется фтор в виде смеси SiF4 и HF. Так, при повышении концентрации фосфорной кислоты с 30 до 50 % P2O5 из неё удаляется 50-60 % фтора. Поскольку выбросы фтора регулируются законами, эти вещества направляют на производство кремнефтористоводородной кислоты H2SiF6.
Разнообразные неорганические примеси удаляют осаждением и экстракцией. Осаждать необходимо примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты), а также примеси катионных металлов (обработкой гидроксидом натрия). Экстракция основана на переводе фосфорной кислоты в органическую фазу и промывках водой, разбавленной фосфорной кислотой и растворами фосфатов. При этом удаляются как катионные, так и анионные примеси. Сама фосфорная кислота отделяется от растворителя перегонкой. В качестве растворителей используют бутанол-1, амиловый спирт, метилизобутилкетон, трибутилфосфат, диизопропиловый эфир и др.
Экономические и экологические аспекты
Мировая потребность в фосфорной кислоте по состоянию на 1989 г. оценивается в 40,6 млн тонн в год в пересчёте на P2O5. Экстракционный способ производства является преобладающим (95 % от общего количества), поскольку он потребляет меньше энергии. Остальные 5 % производятся термическим способом. Основным производителем (и потребителем) экстракционной фосфорной кислоты являются США: их доля от общего производства фосфорной кислоты составляет 90 %.
В 1980-е гг. произошло сокращение производства фосфорной кислоты из-за отказа от фосфорсодержащих детергентов и минеральных удобрений. Это было связано с загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоёмов.
Экстракционное производство фосфорной кислоты связано с образованием отвалов сульфата кальция: на 1 т P2O5 производится 4,5-5,5 т загрязнённого сульфата кальция, который необходимо утилизировать. По состоянию на 2008 год существует три варианта:
- затопление в водоёмах (10 %);
- сваливание на суше (около 88 %);
- использование в качестве сырья.
При затоплении в водоёмах сульфат кальция быстро растворяется: его растворимость в морской воде составляет 3,5 г/л, а природное содержание — 1,6 г/л. Примеси оксида кремния и оксида алюминия остаются нерастворёнными. Загрязнение воды тяжёлыми металлами мало по сравнению с существующими концентрациями, однако загрязнение кадмием значительно.
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В авиационной промышленности ортофосфорная кислота используется в составе гидрожидкости НГЖ-5У и её иностранных аналогов.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного pH желудка и мочекаменной болезни.
Также ее применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.
Безопасность
Фосфорная кислота не оказывает специфического токсического действия. Системная токсичность низкая. Её растворы раздражают глаза, дыхательные пути и слизистые оболочки. При концентрации > 10 % она оказывает раздражающее действие, а выше 25 % — также коррозионное. При глотании большого количества возникает тошнота, рвота, диарея, кровавая рвота и гиповолемический шок. Концентрированные растворы вызывают ожоги слизистой оболочки рта, пищевода и желудка. При попадании рекомендуется промыть кожу или промыть глаза тёплой водой или физиологическим раствором. При глотании фосфорной кислоты в качестве первой помощи необходимо поддерживать дыхание и внутривенно восполнять жидкость.
У добровольцев, получавших фосфорную кислоту перорально в количестве 2-4 г/кг в день в течение 10 дней или 3,9 г/кг в день в течение 14 дней, не обнаружено негативных для метаболизма последствий. Допускается использовать 0,5–1 г/л фосфорной кислоты в напитках.
Источник