Оксиды: классификация, получение и химические свойства
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Источник
Получение оксидов неметаллов



а) Из простого вещества — взаимодействием простых веществ: S+O2 = SO2, C+O2 = CO2
б) Из кислоты — дегидратацией — разложением на воду и оксид: H2SO3 = SO2 + H2O, H2CO3 = CO2 + H2O
в) Из соли — термическим разложением — разложением на оксид металла и оксид неметалла: MgSO3 = MgO + SO2, ZnCO3 = ZnO + CO2
153. a) BaO — основной оксид, т.к. взаимодействует только с кислотами: BaO + 2HCl = BaCl2 + H2O
б) Al2O3, — амфотерный оксид, т.к. взаимодействует и с кислотами и со щелочами: Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 2NaOH = 2NaAlO2 + H2O
в) Cl2O7 — кислотный оксид, т.к. взаимодействует только со щелочами: Cl2O7 + 2NaOH = 2NaClO4 + H2O
154. Sn(OH)2 — амфотерный гидроксид, т.к. взаимодействует и со щелочами и с кислотами: Sn(OH)2 + 2NaOH = Na2[Sn(OH)4], Sn(OH)2 + 2HCl = SnCl2 + 2H2O.
155. Доказательством амфотерности указанных соединений служит тот факт, что оксид и гидроксид хрома (III) растворяются как в щелочах, так и в кислотах:
156. Для получения формулы кислоты необходимо прибавить математически к формуле ангидрида формулу воды и, если это необходимо, сократить коэффициенты:
157. Для получения формулы ангидрида необходимо вычесть математически из формулы кислоты формулу воды, предварительно, если количество протонов нечетное, умножив формулу кислоты на 2:
158. a) CaO — основной оксид, взаимодействует только с кислотами: CaO+2HCl = CaCl2 + H2O
б) Al2O3, — амфотерный оксид, взаимодействует и с кислотами и со щелочами: Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 2NaOH = 2NaAlO2 + H2O
в) P2O5 — кислотный оксид, взаимодействует только со щелочами: P2O5 + 6NaOH = 2Na3PO4 + 3H2O
159. а) Разделить BaO и MgO можно, обработав их водой: гидроксид магния выпадет в осадок, а гидроксид бария останется в растворе.
б) Разделить CdO и ZnO можно, обработав их NaOH: гидроксид цинка растворится, т.к. он амфотерен, а гидроксид кадмия останется в осадке, т.к. он имеет основные свойства: ZnO + 2NaOH = Na2ZnO2 + H2O
в) Разделить СО и СО2 можно при помощи сорбентов: силикагель поглощает СО2, но не абсорбирует СО.
г) Разделить Al(OH)3 и La(OH)3 можно, обработав их щелочью: амфотерный гидроксид алюминия растворяется в щелочах, а основный гидроксид лантана нет: Al(OH)3 + 3NaOH = Na3[Al(OH)6].
160. С повышением степени окисления металла в гидроксиде (оксиде), свойства гидроксида (оксида) становятся более кислотными и менее основными: CrO — основный, Cr2O3 — амфотерный, CrO3 — кислотный.
161. Получение нитрата калия:
а) Основание с кислотой: KOH + HNO3 = KNO3 + H2O
в) Основание с кислотным оксидом: 2KOH + N2O5 = 2KNO3 + H2O
г) Основной оксид с кислотой: K2O + 2HNO3 = 2KNO3 + H2O
162. Получение хлорида магния:
а) Металл с кислотой: Mg + 2HCl = MgCl2 + H2
б) Оксид с кислотой: MgO + 2HCl = MgCl2 + H2O
в) Основание с кислотой: Mg(OH)2 + 2HCl = MgCl2 + 2H2O
163. 2Fe + O2 = 2FeO, FeO + SO3 = FeSO4, FeSO4 + 2KOH = Fe(OH)2 + K2SO4, 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3, Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O, 2Fe(NO3)3 =нагрев= Fe2O3+ 3N2O5, Fe2O3 + H2 = 2FeO + H2O, FeO + H2 = Fe + H2O
164. 2Zn + O2 = 2ZnO, ZnO + HNO3 = Zn(NO3)2 + H2O, Zn(NO3)2 +2KOH = Zn(OH)2 + 2KNO3, Zn(OH)2 = ZnO + H2O, ZnO + H2 = Zn + H2O
167. a) FeCl3+ 3KOH = Fe(OH)3 + 3KCl, 2Fe(OH)3 = Fe2O3+ 3H2O
в) FeS + 2KOH = Fe(OH)2 + K2S, 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
168. Поскольку оксид кальция — основное соединение, то СаО взаимодействует с веществами кислотной природы: CaO + 2HNO3 = Ca(NO3)2 + H2O, CaO + 2HNO2= Ca(NO2)2 + H2O, CaO + SO3 = CaSO4, CaO + Al2O3 = Ca(AlO2)2, CaO + Zn(OH)2 = CaZnO2 + H2O.
169. Поскольку соляная кислота — кислотное соединение, то она взаимодействует с веществами основной природы: 2HCl + Zn(OH)2 = ZnCl2 + 2H2O, 2HCl + CaO = CaCl2 + H2O, HCl + AgNO3= AgCl + HNO3.
170. Поскольку щелочи — основные соединения, то они взаимодействует с веществами кислотной природы: KOH + HCl= KCl + H2O, 2NaOH + H2S= Na2S + 2H2O, NaOH + SO2 = NaHSO3, NaOH + SO3 = NaHSO4.
171. NO2 — диоксид азота, HF — фтористый водород, H2SiO3 — метакремниевая кислота, H4SiO4 — ортокремниевая кислота; а) сульфат лития — Li2SO4, б) сульфит магния — MgSO3, в) дигидрофосфат калия -KH2PO4, г) сульфат гидроксомеди(II) — (CuOH)2SO4.
172. SnO — оксид олова(II), SnO2 — оксид олова(IV), HMnO4 — марганцевая кислота, SiH4 — гидрид кремния (силан), а) нитрат бария — Ba(NO2)2, б) нитрит аммония — NH4NO2, в) нитрат гидроксожелеза(III) — FeOH(NO3)2.

173. CaCl2 — хлорид кальция, CaOHCl -гидроксохлорид кальция, Ca(NO3)2 — нитрат кальция, CaOH(NO3) — гидроксонитрат кальция, CaSO4 — сульфат кальция, (CaOH)2SO4 — гидроксосульфат кальция, Ca(HSO4)2 — гидросульфат кальция.
174. Na2SO4 — сульфат натрия, NaHSO4 — гидросульфат натрия, Na2SO3 — сульфит натрия, NaHSO3 — гидросульфит натрия, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
175. HNO2 — азотистая кислота, NH3 — нитрид водорода, P2O3 — оксид фосфора (III), Zn(OH)Cl — гидроксохлорид цинка, BiONO3 — оксонитрат висмута (III); оксид хрома (VI) — CrO3, нитрид кальция — Ca3N2, сульфид аммония — (NH4)2S, гидрокарбонат натрия — NaHCO3.
176.
| Вещество | Название | Структура |
| Na2S | Сульфид натрия | Na-S-Na |
| KClO3 | Хлорат калия | 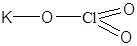 |
| FePO4 | Фосфат железа | 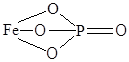 |
| MgOHCl | Гидроксохлорид магния | H-O-Mg-Cl |
| KH2PO4 | Дигидрофосфат калия | 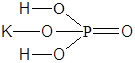 |
| K2HPO4 | Гидрофосфат калия | 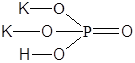 |
| K3PO4 | Фосфат калия | 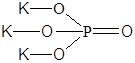 |
177.
| Вещество | Название | Структура |
| N2O5 | Азотный ангидрид | 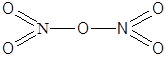 |
| Pb(HSO4)2 | Гидросульфат свинца(II) | 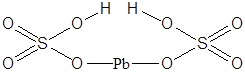 |
| (FeOH)2SO4 | Сульфат гидроксожелеза (II) | 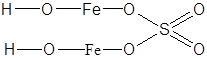 |
| NaNO3 | Натриевая селитра | 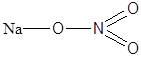 |
| SbOCl2 | Хлорид оксосурьмы(III) | 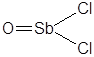 |
178.
| Вещество | Название | Структура |
| Cr2O3 | Оксид хрома(III) | 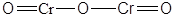 |
| CrO3 | Оксид хрома(VI) | 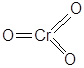 |
| (BeOH)2 | Гидроксид бериллия | H-O-Be-O-H |
| HMnO4 | Марганцевая кислота | 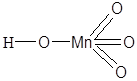 |
| MgSO4 | Сульфат магния | 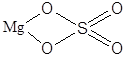 |
| CuCl2 | Хлорид меди (II) | Cl-Cu-Cl |
| Ca(HCO3)2 | Гидрокарбонат кальция | 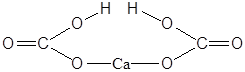 |
179. а) Оксид железа (III), б) Сульфит кальция, в) Гидрофосфат натрия.
180.KAl(SO4)2 — калия алюминия сульфат (двойная соль), FeSO4*7H2O — гептаакважелеза (II) сульфат (кристаллогидрат). А) Сульфит стронция — SrSO3, б) сульфат дигидроксоалюминия (Al(OH)2)2SO4, в) гидрокарбонат магния -Mg(HCO3)2, г) ортомышьяковая кислота — H3AsO3.
Источник








