Алкены
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
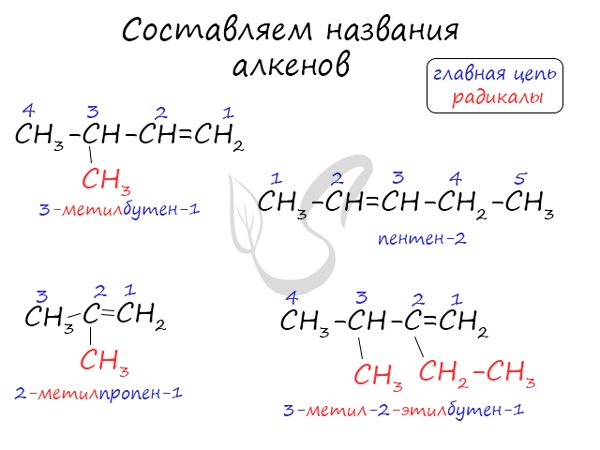
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
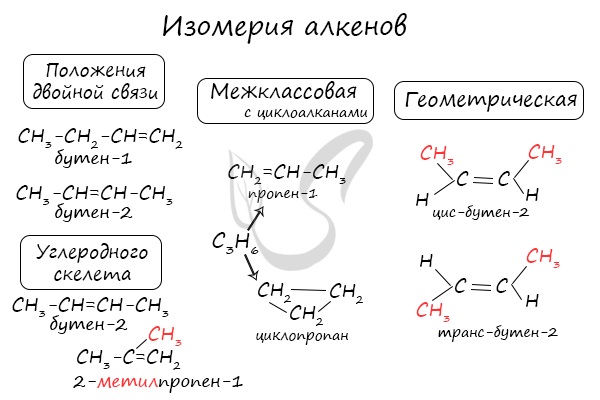
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
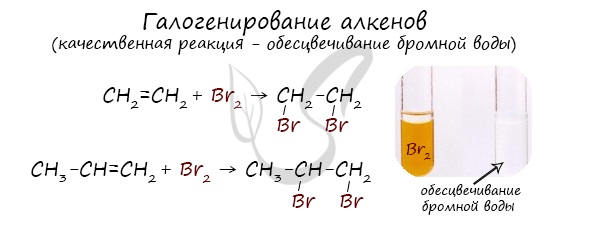
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному.
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси.
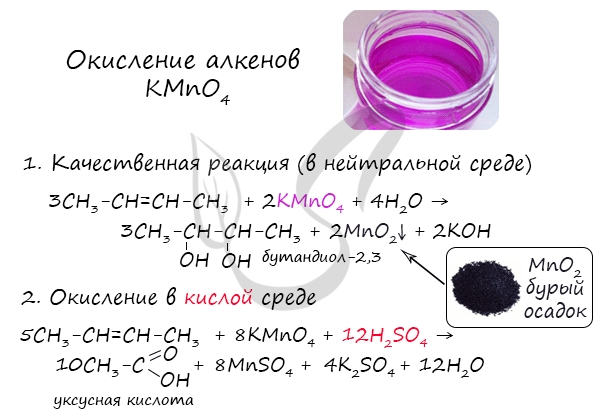
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
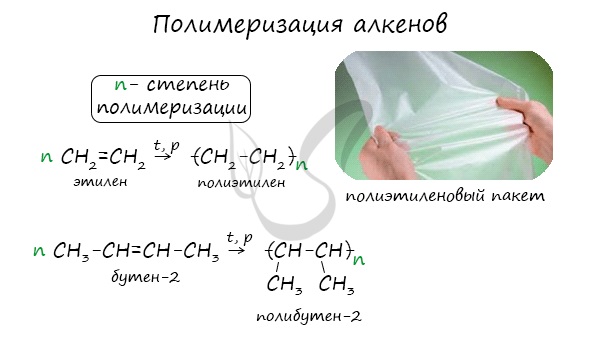
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Способы получения непредельных углеводородов
| Алкены | Алкины | Алкадиены |
| 1. Реакции дегидрирования алканов. Реакции идут при высокой температуре (600 – 1000 0 С), катализаторы (Cr2O3) | ||
| С3Н8®С3Н6+ Н2 пропан пропен | С3Н8®С3Н4+ 2Н2 пропан пропин | С4Н10®С4Н6+ 2Н2 бутан бутадиен-1,3 |
| 2. Дегидрогалогенирование галогенпроизводных (– НHal). Реакции идут в спиртовом растворе щелочи — гидроксида калия КОН. (*) | ||
| СН2– СН2– СН3+ КОНспи рт ®® СН2= СН – СН3+KBr+H2O ½ Br | СН2– СH– СН3 + 2КОНспи рт ® СН ºС – СН3 + 2KCl+ 2H2O ½ ½ Сl Cl | СН2– СН2– СН2– СН2+ 2КОНспи рт ® ½ ½ Сl Cl ® СН2= СН – СН = СН2+ 2KCl+ 2H2O |
| 3. Дегидратация спиртов (*) | 3. Способы получения ацетилена | 3. Из этанола (по методу С.В. Лебедева) |
| Н2SO4конц.,t> 140 0 C СН2– СН2– СН3¾¾¾®® СН2= СН – СН3+H2O ½ OH | 3.1. Из карбида кальция СаС2+ 2Н2О®С2Н2+ Са(ОН)2 3.2. Из метана 1500 0 С 2СН4¾¾®С2Н2+ 3Н2 | Al2O3, t 0 2C2H5OH¾¾®СН2= СН – СН = СН2+ + H2O + H2 |
(*) При дегидрогалогенировании и дегидратации несимметричной молекулы отщепление водорода идет преимущественно от наименее гидрогенизированного атома углерода –правило А.М. Зайцева:
СПИРТЫ И ФЕНОЛЫ
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. Вещества, у которых гидроксил находится непосредственно у бензольного кольца, называются фенолами.
В зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трёхатомные.
В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты:
| вторичные | R I CH–OH, I R’ |
| и третичные R’– | R I C–OH. I R’’ |
Физические свойства
Низшие спирты (до С12) – жидкости, температуры кипения которых значительно выше, чем у соответствующих алканов из-за образования водородных связей за счёт полярной связи О–Н
| …….. : | O–H ….. : I R | O–H …… I R |
Метанол и этанол смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость спиртов в воде уменьшается.
Физические свойства спиртов и фенолов
| Название | Формула | d4 20 | tплC | tкипC |
| Спирты | ||||
| метиловый | СН3OH метанол | 0, 792 | -97 | |
| этиловый | С2Н5OH этанол | 0,79 | -114 | |
| пропиловый | СН3СН2СН2OH | 0,804 | -120 | |
| изопропиловый | СН3–СН(ОH)–СH3 | 0,786 | -88 | |
| бутиловый | CH3CH2CH2CH2OH | 0,81 | -90 | |
| вторбутиловый | CH3CH2CH(CH3)OH | 0,808 | -115 | |
| третбутиловый | (СН3)3С–OH | 0,79 | +25 | |
| циклогексанол | С6Н11OH | 0,962 | -24 | |
| бензиловый | C6H5CH2OH | 1,046 | -15 | |
| этиленгликоль | HOCH2CH2OH | 1,113 | -15,5 | |
| глицерин | НО–СН2–CH(ОН)–СН2OH | 1,261 | -18,2 | |
| Фенолы | ||||
| фенол | С6Н5OH | 1,05(43°) | ||
| пирокатехин | о — С6Н4(OH)2 | – | ||
| резорцин | м — С6Н4(OH)2 | – | ||
| гидрохинон | n — С6Н4(OH)2 | – |
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов – CnH2n+1OH.
Изомерия
1. Изомерия углеродного радикала (начиная с C4H9OH).
2. Изомерия положения гидроксильной группы, (начиная с С3Н7ОН).
3. Межклассовая изомерия с простыми эфирами (СН3–СН2–ОН и СН3–О–СН3).
Получение
В промышленности.
1. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250C и давлении 5-10 МПа: СО + 2Н2 = СН3ОН
Ранее метанол получали сухой перегонкой древесины без доступа воздуха.
2. Этанол получают:
b) брожением крахмала (или целлюлозы): крахмал С6Н12О6(глюкоза) –– ферменты 2С2Н5ОН + 2СО2
(источник крахмала – зерно, картофель)
В лаборатории.
| СH3–СH=CH2 + H2O –– H+ СH3– | CH– СH3 I OH |
1. Гидратация алкенов (согласно правилу Марковникова):
2. Гидролиз галогенопроизводных углеводородов:
Чтобы сдвинуть равновесие вправо, добавляют щёлочь, которая связывает образующийся HBr.
3. Восстановление карбонильных соединений:
Альдегиды образуют первичные спирты, а кетоны – вторичные.
| СH3–СH2— | O II -C I H | –– 2[H] СH3–CH2— | -CH2OH |
| СH3— | -C- II O | -CH3–– 2[H] CH3— | -CH- I OH | -СH3 |
Химические свойства
Свойства спиртов ROH определяются наличием полярных связей O - –H + и C + –O - , и неподеленных электронных пар на атоме кислорода.
При реакции спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы) или O–H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.
Источник
Получение непредельных углеводородов.



Алкинов1) из алканов при высокой температуре (1200 -1500о)метан,этан
2CH4 CH≡СН + 3H2 2C2H6 CH≡СН + 2H2
2) из дигалагенопроизводных CH2Cl-CH2Cl =(NaOH/t*) CH≡CH + 2НCl 3) из карбида кальция СаС2(карбит кальция) + Н2О C2H2 + Ca(OH)2гашенная известь4)Разложением ацетиленидов кислотами СаС2 + 2HCl C2H2 + CaCl2
Алкенов.1) из алкановCH3-CH2-CH3=(t*,кат)CH3-CH=CH2 + H2(I) 2)из галагенопрозводныхалканов При этом соблюдается правило Зайце ва(.отщепление атома водорода в реакциях происходит преимущественно от наименее гидрогенизиро ванного атома углерода[
CH3-CH2Br + KOH =(t) CH2=CH2 + KBr + H2O3)
издигалагенопрозводныхалкановCH2Br-CH2Br + ZnCH2=CH2 + ZnBr2 4)изспиртовCH3-CH2-OH(этанол)=(t*,Н2SО4) CH2=CH2 + H2OАлкодиенов 1) изалканов(бутан) CH3-CH2-CH2-CH3 =(t*,кат)_ СH2=CH-CH=CH2 + 2H2(I) (бутандиен) 2)изэтиловогоспирта2C2H5OH =(t*)_ СH2=CH-CH=CH2 + H2 (I)+ 2H2O
Качественные реакции на двойную, тройную связь.
На двойную связь а)обесцвечивание бромной водыCH2=CH2 + Вr2 →СH2Br-CH2Br (1,2-дибромэтан) б) Обесцвечивание перманганата калия в водной и кислой среде при пропускании через неё алкена.(окисление алкенов) CH2=CH2(этилен) =( KMnO4,НОНводный раствор,
На тройную связь а)р-иис хлоридом меди CuCl+H-C ≡C-H+СuСl= Сu-C ≡C-Cu+HСl (ацетилинит меди) коричневое окрашивание. Б)галагинирование (реакция обесцвечивание бромной воды).СН≡СН + Br2 СHBr=CHBr(1,2-дибромэтен) + Br2 СHBr2-CHBr2
Источник