- Неметаллы
- Нахождение неметаллов в природе
- Физические свойства неметаллов
- Положение неметаллов в Периодической системе Д.И. Менделеева
- Получение неметаллов
- Химические свойства неметаллов
- Примеры решения задач
- Таблица 14. Способы получения неметаллов
- Металлы и неметаллы
- Металлы и неметаллы
- Сравнение химических свойств ii способов получения металлов и неметаллов
- Соединения металлов и неметаллов
- Характеристики кислородных соединений неметаллов
- Биологическая роль металлов и неметаллов в жизнедеятельности живых организмов
- Реакции, происходящие каждый день
Неметаллы
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Нахождение неметаллов в природе
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень незначительных количествах), в воздухе (азот и кислород) , в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Физические свойства неметаллов
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Положение неметаллов в Периодической системе Д.И. Менделеева
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Получение неметаллов
Многообразие неметаллов породило многообразие способов их получения, так водород получают, как лабораторными способами, например, взаимодействием металлов с кислотами (1), так и промышленными способами, например, конверсией метана (2).
CH4 + H2O = CO + 3H2 ↑ (температура 900 
Получение галогенов осуществляют в основном, путем окисления галогеноводородных кислот:
Для получения кислорода используют реакции термического разложения сложных веществ:
Серу получают неполным окислением сероводорода (1) или по реакции Вакенродера (2):
Для получения азота используют реакцию разложения нитрита аммония:
Основной способ получения фосфора – из фосфата кальция:
Химические свойства неметаллов
Основные химические свойства неметаллов (общие для всех) – это:
— взаимодействие с металлами
— взаимодействие с другими неметаллами
Каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
Примеры решения задач
| Задание | Осуществите ряд превращений S→H2S→SO2→SO3→H2SO4 |
| Решение | S + H2 = H2S |
| Задание | Какой объем оксида углерода (IV) (н. у.) получится при разложении известняка массой 500 г, содержащего 20% примесей? |
| Решение | Запишем уравнение реакции: |
Найдем массу чистого (без примесей) карбоната кальция:
m(CaCO3) = 500 × (1-0,2) = 400 г
Найдем количество вещества CaCO3 :
Источник
Таблица 14. Способы получения неметаллов



Неметалл
Способы получения
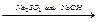 2Н2↑ +О2↑
2Н2↑ +О2↑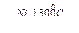 4Н2 + СО2 3. Конверсия углерода: а)С + Н2О
4Н2 + СО2 3. Конверсия углерода: а)С + Н2О 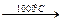 СО+Н2 водяной газ СО + Н2О + (Н2)
СО+Н2 водяной газ СО + Н2О + (Н2) 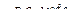 СО2 + Н2 4. Нагревание метана: СН4
СО2 + Н2 4. Нагревание метана: СН4 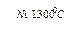 С + 2Н2 5. Глубокое охлаждение коксового газа (-190°С)
С + 2Н2 5. Глубокое охлаждение коксового газа (-190°С) 2 КС1 + 3 О2↑ 2 КМnО4
2 КС1 + 3 О2↑ 2 КМnО4 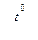 К2Мп04 + МnO2 + О2 2 NaNО3
К2Мп04 + МnO2 + О2 2 NaNО3 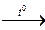 2 NaN02 + О2↑ 2. Электролиз воды.
2 NaN02 + О2↑ 2. Электролиз воды.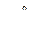 CO2 + S б) 2 H2S + SO2 = 3 S + 2 H2O
CO2 + S б) 2 H2S + SO2 = 3 S + 2 H2OНеметалл
Способы получения
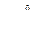 N2 + H2O
N2 + H2O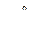 Si + 2 MgO 3 SiO2 + 4 Al
Si + 2 MgO 3 SiO2 + 4 Al 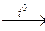 3 Si + 2 Al2O3
3 Si + 2 Al2O3  Si + 2 CO 2. Чистый кремний получают восстановлением тетрахлорида кремния парами цинка: SiCl4 + 2 Zn
Si + 2 CO 2. Чистый кремний получают восстановлением тетрахлорида кремния парами цинка: SiCl4 + 2 Zn 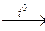 Si + 2 ZnCl2
Si + 2 ZnCl2 Физические свойства неметаллов.
Химическая связь – ковалентная неполярная
1. При обычной температуре неметаллы могут быть в разном агрегатном состоянии – твердые: S – сера, P — фосфор, I – йод, C — алмаз и графит; жидкие: Br2 — бром; газообразные: O2 — кислород , H2 — водород, N2 — азот , Cl2 — хлор, F2 — фтор.
2. Многие не проводят электрический ток (кроме графита и кремния).
3. Не проводят тепло.
4. В твердом состоянии – хрупкие.
5. Не имеют металлического блеска (кроме йода — I2 , графита — C и кремния Si).
6. Цвет охватывает все цвета спектра (красный — красный фосфор, желтый – сера, зеленый — хлор, фиолетовый – пары йода).
7. Температура плавления изменяется в огромном интервале: tпл(N2) равна — 210 0 C, а tпл алмаза равна 3730 0 С.
8. Неметаллы образуют аллотропые модификации (углерод, сера, фосфор, кислород, мышьяк, кремний).
Многие неметаллы образуют молекулы, состоящие из двух атомов (H2 , O2, N2, F2, Cl2, Br2, I2) при этом образуется очень непрочная молекулярная неполярная кристаллическая решетка. Но, с другой стороны, вещества с ковалентной неполярной связью образуют и самую прочную кристаллическую решётку — атомную (алмаз, кремний).
Источник
Металлы и неметаллы
Содержание:
Металлы — простые вещества, в которых атомы связаны металлической связью. Поэтому определяющие физические свойства чистых металлов (следствие наличия металлической связи).
Неметаллы – это все элементы (и простые вещества), не являющиеся металлами. В нашей периодической таблице символы неметаллов красные, а металлов – синие.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Металлы и неметаллы
Весь естественный мир состоит из химических элементов И даже далекие галактики состоят из тех же химических элементов что и наша Земля.
Наименьшая частица .любого химического элемента, обладающая всеми его свойствами. — это атом .
Химические элементы делятся на металлы и неметлллы
Все металлы (кроме ртути) твердые при нормальных условиях. Однако твердость их различна.
Некоторые неметллы в свободном виде при комнатной температуре являются газами, другие — твердые, и один — жидкий.
каждый из элементов периодической системы взаимосвязан с понятиями атом , простое или сложное вещество :
Металлы и неметаллы отличаются в первую очередь строением. Изобразим строение атома натрия и хлора
Сравните строение их внешних уровней. Легко заметить, что у металлов небольшое число электронов поэтому они легко отдают наружные электроны и проявляют восстановительные свойства. Склонность металла отдавать электроны зависит от его строения прежде всего, от размера атомов: чем больше атомные радиусы, тем легче металл отдает электроны.
Металлы — простые вещество . степень окисления атомов е них равна 0. Вступая в реакции, металлы почти всегда изменяют степень окисления своих атомов. Электроотрицательность этих атомов невелика. поэтому атомы металлов приобретают положительную степень окисления. Следовательно, все металлы в той или иной степени проявляют восстановительные свойства,
А неметаллы , наоборот, имеют большое число наружных электронов и легко присоединяют недостающие жмироны и проявляют окислительные свойства . Окислительная активность неметаллов зависит, с одной стороны, от размеров атомов (чем меньше атомы, тем активнее вещество), а с другой — от прочности ковалентных связей в простом веществе (чем прочнее связи, тем менее активно вещество).
В периодической системе свойства металлов и неметаллов изменяются в периодах и группах (рис. 36).
Наблюдаются раличия и в радиусах атомов этих элементов (рис. 37),
Аналогично существует различие в образовании химической связи у металлов и неметаллов:
Существуют различия и в кристаллических решетках простых веществ. У металлов только металлическая кристаллическая решетка, а неметаллам характерны атомные и молекулярные кристаллические решетки:
Безусловно, различия в строении атомов, видах химических связей и кристаллическом строении приводят к различиям в физических свойствах металлов и неметаллов (табл. 14).
Используя полученные знания in курса химии, на практике сравните физические свойства меди и серы.
Химические элементы делятся на металлы и неметаллы. Металлы — твердые вещества <кроме ртути). Неметаллы находятся в различных агрегатных состояниях.
Строение металлов и неметаллов — главная отличительная характеристика. Металлы имеют металлическую кристаллическую решетку. А неметаллам присущи молекулярные и атомные кристаллические решетки. Металлы проявляют восстановительные. а неметаллы окислительные свойства.
Сравнение химических свойств ii способов получения металлов и неметаллов
Атомы металлов, не обладая склонностью принимать электроны, могут только их отдавать пли обобщать. Все металлы в тон или иной степени проявляют восстановительные свойства.
Казалось бы, что самым активным из металлов должен быть фракций. Однако самый из долгоживущих изотопов фракция имеет период полураспада 22.3 мин. Его равновесное содержание в земной коре только 340 г. Кроме него имеется еще один вид с периодом полураспада 3.0 млн. Его равновесное содержание в земной коре составляет лишь 0.5 г.
Вследствие этого из применяемых металлов все-таки самым активным считается цезий.
Его легкость отдачи своего наружного электрона нашла применение в фотоэлементах.
Сравнительная активность металлов определяется схим рядом активности (приводится в сокращении):
Расположение лития на первом месте в этом ряду объясняется легкостью образования гидратной оболочки в водных растворах кислот и солей.
Из расположения металлов в этом ряду видно, что самыми активными металлами являются металлы с одним внешним электроном, а самыми устойчивыми — плашка и золото. Химические свойства металлов (рис. 37).
1. С неметаллами (не со всеми ):
Наиболее активные металлы легко реагируют с галогенами и кислородом. а с азотом реагируют только литий, кальций и магний.
Реагируя с кислородом, большинство металлов образует оксиды, а наиболее активные —пероксиды 
2. С оксидами менее активных мешаное :
3. С растворами кислот
В этом случае возможность реакции легко определяется по ряду напряжении (реакция протекает, если металл в ряду напряжений стоит до водорода).
4. С растворами солей :

Для определения возможности протекания реакции здесь также используется ряд напряжений.
5. Краме того, наиболее активные металлы (щелочные и щелочно-земельные ) реагируют с водой :
Большинство металлов в промышленности получают восстанавливая их оксиды:
В лаборатории этого часто используют водород. Наиболее активные металлы как в промышленности, так и в лаборатории получают с помощью электролиза.
В лаборатории менее активные металлы могут быть восстановлены из растворов их солен более активными металлами.
Неметаллы. В отличие от металлов, неметаллы обладают склонностью присоединять электроны, т, е. могут проявлять окислительные свойства. Самый активный неметалл — фтор. Он бурно взаимодействует почти со всеми веществами и с большинством из них — с горением и со взрывом. Контакт фтора с водородом приводит: к воспламенению и взрыву даже при очень низких температурах 
Неметаллы могут окислять:
2. Другие неметаллы :
3. Многие сложные вещества :
Фтор — самый сильный окислитель. Ненамного уступают ему кислород и хлор (обратите внимание на их положение в системе элементов).
В значительно меньшей степени окислительные свойства проявляют бор. графит, алмаз, кремний и другие простые вещества, образованные элементами, примыкающими к границе между металлами и неметаллами. Атомы этих элементов менее склонны присоединять электроны. Именно эти вещества (особенно графит и водород) способны проявлять восстановительные свойства:
Неметаллы получают из природных соединении, например, путем электролиза пли сложных окислительно-восстановительных процессов.
Металлы проявляют в химических реакциях свойства восстановителем. а неметаллы — свойства окислителей.
Сравнительная активность металлов определяется электрохимическим рядом активности. Метаны и неметаллы взаимодействуют с простыми и сложными веществами. Все металлы — восстановители, при взаимодействии с другими веществами отдают свои элекроны и окисляются. Самые сальные восстановители — щелочные металлы, А неметаллы при взаимодействии с другими веществами присоединяют электроны и восстанавливаются. Самый сильный окислитель — фтор.
Соединения металлов и неметаллов
После того как мы сравнили строение п свойства простых веществ металлов и неметаллов, можно приступить к более полном классификации и сравнению свойств важнейших соединений металлов и неметаллов.
Общие формулы водородных соединений по группам периодической системы химических элементов приведены в таблице 15.
С металлами водород образует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения, поэтому их температуры плавления сравнительно высоки, Такие соединения называются гидридами .
С неметаллами водород образует летучие соединения молекулярного строения (например, фтороводород HF, сероводород 





С кислородом неметаллы образуют кислотные оксиды, В одних оксидах они проявляют максима льнуло степень окисления, равную номеру группы (например. 




Характеристики кислородных соединений неметаллов
1. Свойства высших оксидов в периодах слева направо постепенно изменяются от основных к кислотным
2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
Существует несколько оксидов, которые в обычных условиях не реагируют ни с кислотами, им со щелочами. Такие оксиды называются несолеобразующими . Это например, 
Кислородные соединения металлов представлены в таблице 16
Как видите. важнейшие классы химических веществ различаются по разным классификационным признакам. Но по какому бы признаку мы ни выделяли класс веществ. все вещества этого класса обладают общими химическими свойствами. Соединения металлов и неметаллов могут взаимодействовать между собой, так как их свойства противоположны.
Между всеми соединениями металлов и неметаллов существует генетическая связь, с которой вы уже знакомы (рис. 38).
С металлами водород образует нелетучие твердые соединения — гидриды . С неметаллами водород образует летучие соединения молекулярного строения. При обычных условиях это газы или летучие жидкости.
С кислородом неметаллы образуют кислотные оксиды, а металлы — основные оксиды. Соединения металлов и неметаллов могут взаимодействовать между собой, так как их свойства противоположны. Между всеми соединениями металлов и неметаллов существует генетическая связь.
Биологическая роль металлов и неметаллов в жизнедеятельности живых организмов
Хорошо известно, что организмы в своем составе содержат различные химические элементы. В то же время организм человека нуждается в регулярном поступлении элементов извне, т. е. в химически сбалансированной пище. так как недостаток или избыток любого из элементов отрицательно сказывается на здоровье человека.
По современным представлениям из 118 известных элементов незаменимыми являются 22. Углерод, водород, азот и кислород не входят в этот список — они слишком широко природе.
Для удобства остальные элементы подразделяют на две большие группы: макроэлементы. присутствующие в больших количествах и микроэлементы . присутствующие в следовых количествах.
Макроэлементами принято считать те химические элементы, содержание которых в организме более 0,005% массы тела . Содержание макроэлементов в организме достаточно постоянно, но даже сравнительно большие отклонения от нормы совместимы с жизнедеятельностью организма.
К этой группе относятся водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций, Оиэло 96% от массы тела человека приходится на водород (H), кислород (О), углерод (С), азот (N). Они поступают в организм преимущественно в связанном виде с пищей, водой, воздухом и участвуют в большинстве химических реакции, протекающих в организме. Кроме того, эти элементы входят в состав белков, жиров и углеводов (рис. 39). К. этой же группе химических элементов относятся кальций (Са). фосфор (Р). калий (К), натрий (Na),
хлор (Сl). магний (Mg) и сера (S). На их долю в сумме приходится около 4% от массы организма.
Их роль сводится к:
— участию в пластических процессах и построении тканей (например, Р и Са — основные структурные компоненты костей);
— поддержанию кислотно-щелочного равновесия и водно-солевого обмена;
— поддержанию солевого состава крови и участию в структуре формирующих ее элементов:
— участию в структуре и функции большинства ферментативных систем и процессов, протекающих в организме.
Микроэлементами называются частицы, содержащиеся в организме в очень малых количествах . Иx содержание не превышает 0,005% массы тела, а концентрация в тканях— не более 0.000001%.
В связи с этим их часто называют «следовыми» химическими элементами.
В организме каждого взрослого человека присутствует небольшое количество микроэлементов. Несмотря на их малое содержание, микроэлементы чрезвычайно важны.
В таблице 18 приведен список важнейших из них. Кроме того, исследования на животных показали, что в следовых количествах незаменимыми являются кобальт (Со) никель (Ni) мышьяк (As) и кадмий
Макроэлементы сконцентрированы. как правило, в соединительных тканях (мышцы, кости, кровь), входя в состав органических соединений. Они определяют пластический материал основных несущих тканей, а также обеспечивают поддержку основных свойств внутренней среды организма в целом (гомеостаз): значение pH. осмотическое давление, кислотно-щелочное равновесие, устойчивость коллоидных систем в организме.
Микроэлементы неравномерно распределены между тканями н часто обладают сродством к определенному типу тканей и органон. Так, цинк аккумулируется в поджелудочной железе, молибден — в почках, барии — в сетчатке плаза, стронций — в костях, йод — в щитовидной железе (рис. 40. табл. 18).
Знаешь ли ты?
Снижение содержания цинка в плазме крови — обязательное следствие инфаркта миокарда.
Уменьшение содержания лития в крови — показатель гипертонического заболевания.
То, что, например, мышьяк, общеизвестный ял. незаменим для жизни, может вас удивить. Но нет ничего необычного в том, что одни и те же вещества могут приносить и пользу, и вред — все зависит от дозы. Даже поваренная соль может стать ядовитой, если попадет в организм в стишком больших количествах. Пороговое содержание различных элементов для организма человека представлен о в таблице 19.
Наша пища должна быть сбалансирована по необходимым химическим элементам. Правильное питание — залог здоровья каждого человека,
Знаешь ли ты?
Суточное потребление йода жителями Японии в несколько раз выше (за счет продуктов моря), чем в Центральной Азми.
В Казахстане снижено потребление йода, но превышено потребление калия, натрия.
Жители Индии потребляют с гнилей в 3 раза больше магния, марганца. железа, в 2 раза больше мели и калия, чем жители Англии.
В то же время англичане потребляют с пищей в 2 раза больше хрома и кальция.
В Англии потребление с пищей алюминия — в 20 раз, лития — в 10 раз, молибдена — в 3 раз,з ниже, чем в США. а хрома — в б раз. калышя — в 3 раза выше, чем в Германии
В состав клеток живых организмов, в т. ч. и человека, входят органические и неорганические вещества.
Химические элементы и их соединения, необходимые для нормальной жизнедеятельности организма в сравнительно больших количествах. называются .но-кролеиеимлхш , а элементы, требующиеся организмам в крайне малых количествах, — микроэлементами Среди микроэлементов также есть как неметаллы, так и металлы. Как избыток, так и недостаток элементов оказывает отрицательное влияние на организм, а некоторые элементы могут оказывать даже токсичное влияние.
Реакции, происходящие каждый день
- Фотосинтез
- Анаэробное клеточное дыхание
- Аэробное дыхание
- Горение
- Ржавление
- Смешивание продуктов питания
- Пищеварение
- Кислотно-основное взаимодействие
- Использование мыла
- Использование батареек
Невидимые чернила:
Китайский император использовал для своих тайных надписей невидимые чернила из рисового отвара, который после высыхания не оставлял никаких видимых следов. Однако если такое письмо слегка смочить слабым спиртовым раствором йода, то появляются синие буквы. Рис содержит крахмал, а крахмал выдает себя полностью при наличии йода.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Источник









































