Таблица 14. Способы получения неметаллов



Неметалл
Способы получения
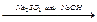 2Н2↑ +О2↑
2Н2↑ +О2↑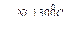 4Н2 + СО2 3. Конверсия углерода: а)С + Н2О
4Н2 + СО2 3. Конверсия углерода: а)С + Н2О 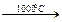 СО+Н2 водяной газ СО + Н2О + (Н2)
СО+Н2 водяной газ СО + Н2О + (Н2) 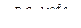 СО2 + Н2 4. Нагревание метана: СН4
СО2 + Н2 4. Нагревание метана: СН4 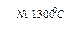 С + 2Н2 5. Глубокое охлаждение коксового газа (-190°С)
С + 2Н2 5. Глубокое охлаждение коксового газа (-190°С) 2 КС1 + 3 О2↑ 2 КМnО4
2 КС1 + 3 О2↑ 2 КМnО4 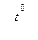 К2Мп04 + МnO2 + О2 2 NaNО3
К2Мп04 + МnO2 + О2 2 NaNО3 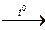 2 NaN02 + О2↑ 2. Электролиз воды.
2 NaN02 + О2↑ 2. Электролиз воды.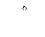 CO2 + S б) 2 H2S + SO2 = 3 S + 2 H2O
CO2 + S б) 2 H2S + SO2 = 3 S + 2 H2OНеметалл
Способы получения
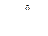 N2 + H2O
N2 + H2O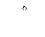 Si + 2 MgO 3 SiO2 + 4 Al
Si + 2 MgO 3 SiO2 + 4 Al 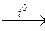 3 Si + 2 Al2O3
3 Si + 2 Al2O3  Si + 2 CO 2. Чистый кремний получают восстановлением тетрахлорида кремния парами цинка: SiCl4 + 2 Zn
Si + 2 CO 2. Чистый кремний получают восстановлением тетрахлорида кремния парами цинка: SiCl4 + 2 Zn 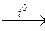 Si + 2 ZnCl2
Si + 2 ZnCl2 Физические свойства неметаллов.
Химическая связь – ковалентная неполярная
1. При обычной температуре неметаллы могут быть в разном агрегатном состоянии – твердые: S – сера, P — фосфор, I – йод, C — алмаз и графит; жидкие: Br2 — бром; газообразные: O2 — кислород , H2 — водород, N2 — азот , Cl2 — хлор, F2 — фтор.
2. Многие не проводят электрический ток (кроме графита и кремния).
3. Не проводят тепло.
4. В твердом состоянии – хрупкие.
5. Не имеют металлического блеска (кроме йода — I2 , графита — C и кремния Si).
6. Цвет охватывает все цвета спектра (красный — красный фосфор, желтый – сера, зеленый — хлор, фиолетовый – пары йода).
7. Температура плавления изменяется в огромном интервале: tпл(N2) равна — 210 0 C, а tпл алмаза равна 3730 0 С.
8. Неметаллы образуют аллотропые модификации (углерод, сера, фосфор, кислород, мышьяк, кремний).
Многие неметаллы образуют молекулы, состоящие из двух атомов (H2 , O2, N2, F2, Cl2, Br2, I2) при этом образуется очень непрочная молекулярная неполярная кристаллическая решетка. Но, с другой стороны, вещества с ковалентной неполярной связью образуют и самую прочную кристаллическую решётку — атомную (алмаз, кремний).
Источник
Неметаллы. Общая характеристика неметаллов. Получение и применение неметаллов. Химические свойства неметаллов.
Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства. Если в Периодической системе провести диагональ от бора к астату, то справа вверх по диагонали будут находиться элементы-неметаллы, а слева снизу – металлы, к ним же относятся элементы всех побочных подгрупп, лантаноиды и актиноиды. Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма, обладают двойственным характером и относятся к металлоидам. Элементы-неметаллы: s-элемент – водород; р-элементы 13 группы – бор; 14 группы – углерод и кремний; 15 группы – азот, фосфор и мышьяк, 16 группы – кислород, сера, селен и теллур и все элементы 17 группы – фтор, хлор, бром, йод и астат. Элементы 18 группы – инертные газы, занимают особое положение, они имеют полностью завершенный внешний электронный слой и занимают промежуточное положение между металлами и неметаллами. Их иногда относят к неметаллам, но формально, по физическим признакам. Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие. Атомы самого электроотрицательного элемента – фтора – не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
Химические свойства 1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами
4Al + 3C = Al4C3 2. Неметаллы играют роль окислителя при взаимодействии с водородом
H2 + F2 = 2HF 3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО 2P + 5S = P2S5 4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
CH4 + 2O2 = CO2 + 2H2O 5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3 6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5 7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями S + 6HNO3 = H2SO4 + 6NO2 + 2H2O 8. Наиболее сильные восстановительные свойства имеют углерод и водород ZnO + C = Zn + CO; CuO + H2 = Cu + H2O 9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования) Cl2 + H2O =HCl + HClO
Физические свойства неметаллов Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях: газы (благородные газы: He, Ne, Ar, Kr, Xe, Rn;водород H2, кислород O2, азот N2, фтор F2, хлор Cl2.), жидкость (бром Br2) , твердые вещества ( йод I2, углерод C, кремний Si, сера S, фосфор P и др. ) . Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
АЛЛОТРОПИЯ – существование химических элементов в двух или более молекулярных либо кристаллических формах. Например, аллотропами являются обычный кислород O2 и озон O3; в этом случае аллотропия обусловлена образованием молекул с разным числом атомов. Чаще всего аллотропия связана с образованием кристаллов различных модификаций. Углерод существует в двух четко различающихся кристаллических аллотропных формах: в виде алмаза и графита. Раньше полагали, что т.н. аморфные формы углерода, древесный уголь и сажа, – тоже его аллотропные модификации, но оказалось, что они имеют такое же кристаллическое строение, что и графит. Сера встречается в двух кристаллических модификациях: ромбической (a-S) и моноклинной (b-S); известны по крайней мере три ее некристаллические формы: l-S, m-S и фиолетовая. Для фосфора хорошо изучены белая и красная модификации, описан также черный фосфор; при температуре ниже –77°С существует еще одна разновидность белого фосфора. Обнаружены аллотропные модификации As, Sn, Sb, Se, а при высоких температурах – железа и многих других элементов.
Получение неметаллов Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов.
1. Получение галогенов. Самые активные галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия:
2Г — — 2 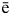
2. Получение водорода. Основной промышленный способ получения водорода – конверсия метана (каталитический процесс): CH4 + H2O = CO + 3H2.
3. Получение кремния. Кремний получают восстановлением коксом из кремнезема: SiO2 + 2C = Si + 2CO.
4. Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита: Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
5. Кислород и азот получают фракционной перегонкой жидкого воздуха.
6. Сера и углерод встречаются в природе в самородном виде.
7. Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.
8. Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
9. Бор получают восстановлением оксида бора магнием.
Применение неметаллов
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров. Используется в качестве восстановителя при производстве многих металлов, например, молибдена и вольфрама, из их соединений. Хлор применяют для производства соляной кислоты, винилхлорида, каучука и многих органических веществ и пластмасс, в текстильной и бумажной промышленности используют в качестве отбеливающего средства, в быту – для обеззараживания питьевой воды. Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др. Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов. Сера используется для производства серной кислоты, изготовления спичек, пороха, для борьбы с вредителями сельского хозяйства и лечения некоторых болезней, в производстве красителей, взрывчатых веществ, люминофоров. Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты. Алмаз используется при обработке твердых изделий, в буровых работах и ювелирном деле, графит – для изготовления электродов, тиглей для выплавки металлов, в производстве карандашей, резины и др.
Источник







