- Способы получения натрия нитрита
- Основные способы получения нитрита натрия
- Разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрата натрия из NaCl и оксидов азота, а так же метод катионного обмена. Изучение плотности и вязкости растворов нитрита натрия.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- Нитрит натрия
- Содержание
- Основные свойства
- Получение
- Области применения
- В химическом синтезе
- Производство пищевых продуктов
- Строительство и производство
- Фотография
- Медицина и биология
- Особенности обращения, биологическое действие
- Рынок
Способы получения натрия нитрита
Основные способы получения нитрита натрия
Кодиров Муробек Мухиддин угли,
студент Ташкентского химико-технологического института.
Основные способы получения нитрита натрия. Представляет интерес разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрата натрия из NaCl и оксидов азота, а так же метод катионного обмена
These important chemical products include nitrite, nitrate, sodium and calcium, the demand for which is growing due to the development of the national economy, consuming nitrite — nitrate, sodium and calcium.
Химическая промышленность является базовой отраслью, которая находится в тесной взаимосвязи со всеми отраслями экономики, играет ключевую роль в агрохимическом комплексе. Производства отрасли должны быть основаны на высоких технологиях, а выпускаемая продукция по номенклатуре должна соответствовать мировым стандартам. Поэтому развитие химической промышленности является приоритетной задачей современного развития экономики Республики Узбекистан [1].
Одним из главных направлений экономического развития Узбекистана является освоение природных ресурсов, их комплексное использование и создание конкурентоспособных, импорто-заменяющих продуктов на базе местных сырьевых ресурсов.
К таким важным химическим продуктам относятся нитриты, нитраты натрия и кальция, потребность в которых неуклонно растёт в связи с развитием отраслей народного хозяйства, потребляющих нитрит — нитратные соли натрия и кальция.
Основные потребители нитрит – нитратных солей натрия и кальция- станко-машиностроительная, металлургическая, бумажная, резиновая, текстильная, фармацевтическая, пищевая промышленность, строительная индустрия, медицина и сельское хозяйство.
Из-за отсутствия собственного производства нитрит — нитратных солей натрия и кальция Узбекистан вынужден покупать их из-за рубежа (особенно нитритные соли). Годовая потребность Республики в нитрите натрия (только в пищевой промышленности) составляет свыше 5 тыс.т, при стоимость его на мировом рынке от 517,40 до 663,93 долларов США за тонну, а нитрита кальция — более 30 тыс.т. в год.
Представляет интерес разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрита натрия из NaCl и оксидов азота, а так же метод катионного обмена.
Процесс получения нитрата натрия методом катионного обмена состоит в основном из трёх стадий:
2. Катионный обмен и регенерация (обмен ионов Са 2+ на ионы Na + ).
3. Выпаривание раствора NaNO2, кристаллизация соли, центрифугирование, сушка и упаковка.
Реакции, протекающие в первых двух стадиях процесса, могут быть схематически выражены следующими уравнениями:


При этом происходит непрерывное чередование процессов производства нитрата кальция и регенерация катионита кальция растворами хлористого натрия.
Промежуточными стадиями процесса являются: промывка водой катионита, выпарка и кристаллизация конвертированных растворов.
Описываемый метод нашёл промышленное применение в Норвегии.
Растворы нитрита кальция пропускают через ряд катионообменников, в которые загружен цеолит (природный минерал типа полевого шпата). Для регенерации цеолита используют морскую воду. Образующийся раствор нитрата натрия концентрируют выпариванием и далее кристаллизуют соль с последующей перекристаллизацией (для получения более чистого продукта). Готовый продукт можно использовать и в качестве удобрения.
В последующие годы были разработаны другие способы производства нитрита натрия 3.
В способе [4] сульфат натрия растворяют в 60%-ной азотной кислоте. После охлаждения раствора до 20 0 С из него выпадают кристаллы нитрата натрия, которые легко отфильтровывают. После промывки и сушки кристаллов получают нитрит натрия. Образующийся маточный раствор, содержащий в основном серную кислоту, направляется на производство сложных удобрений.
Предлагается получение нитрита натрия разложением хлорида натрия азотной кислотой до содержания азотной кислоты 62-64% и охлаждением до температуры ниже 30 0 С с последующим отделением нитрита натрия, а образовавшиеся маточные растворы концентрируют до содержания азотной кислоты выше 80% с последующим выделением нитрита натрия.
Технологических процессов получения нитрита и нитрата натрия необходимо изучение плотности и вязкости их растворов.
В связи с этим из продуктов конверсии сульфата натрия нитритом и нитратом кальция были подготовлены водные растворы нитрита и нитрата натрия с концентрацией 20, 30 и 40%. Концентрации указанных растворов брались в переделах близкими к производственным условиям.
Определение плотности раствора при 20, 40 60 0 С проводили по общеприятной методике с помощью ареометра.
На рис. 1 и табл. 1 представлены экспериментальные данные по определению плотности водных растворов нитрита и нитрата натрия в зависимости от концентрации и температуры.
Результаты экспериментов показали, что с увеличением концентрации растворов нитрита и нитрата натрия значение плотности повышается. С увеличением температуры, наоборот, наблюдается уменьшение плотности растворов. При температуре 20 0 С плотность растворов нитрата натрия с концентрацией 20, 30 и 40% составляет соответственно 1144,5, 1186,3 и 1256,1 кг/м 3 , т.е. увеличение плотности относительно 20% — ной концентрации составляет 4% и 10% соответственно для 30 и 40% -ной концентрации растворов. При температуре 40 0 С значения плотности для исследуемых концентрации растворов нитрата натрия составили соответственно 1124,2; 1167,9 и 1237,7 кг/м 3 . Увеличение плотности относительно 20% ной концентрации составляет соответственно 3,7 и 92%.
Для температуры 60 0 С плотность растворов имела значения 1116,1; 1149,6 и 1229,5 кг/м 3 . Увеличение плотности относительно 20%-ной концентрации нитрата натрия составило соответственно 3,0 и 9,3%.
Таким образом для 30 и 40% -ных растворов относительно 20%-ного увеличения плотности в интервале 20-60 0 С происходят примерно с одинаковой интенсивностью и для 30% — ного раствора составляет 2,4 – 5,0%, а для 40%-ного раствора — 8,0 – 9,3%
Значение плотности растворов нитрата натрия в зависимости от температуры и концентрации.
Концентрация растворов нитрата натрия %
Плотность растворов (кг/м 3 ) при температуре, 0 С
Источник
Основные способы получения нитрита натрия
Разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрата натрия из NaCl и оксидов азота, а так же метод катионного обмена. Изучение плотности и вязкости растворов нитрита натрия.
| Рубрика | Производство и технологии |
| Вид | статья |
| Язык | украинский |
| Дата добавления | 10.03.2018 |
| Размер файла | 231,9 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Основные способы получения нитрита натрия
Кодиров Муробек Мухиддин угли,
студент Ташкентского химико-технологического института.
Основные способы получения нитрита натрия. Представляет интерес разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрата натрия из NaCl и оксидов азота, а так же метод катионного обмена
These important chemical products include nitrite, nitrate, sodium and calcium, the demand for which is growing due to the development of the national economy, consuming nitrite — nitrate, sodium and calcium.
Химическая промышленность является базовой отраслью, которая находится в тесной взаимосвязи со всеми отраслями экономики, играет ключевую роль в агрохимическом комплексе. Производства отрасли должны быть основаны на высоких технологиях, а выпускаемая продукция по номенклатуре должна соответствовать мировым стандартам. Поэтому развитие химической промышленности является приоритетной задачей современного развития экономики Республики Узбекистан [1].
Одним из главных направлений экономического развития Узбекистана является освоение природных ресурсов, их комплексное использование и создание конкурентоспособных, импорто-заменяющих продуктов на базе местных сырьевых ресурсов.
К таким важным химическим продуктам относятся нитриты, нитраты натрия и кальция, потребность в которых неуклонно растёт в связи с развитием отраслей народного хозяйства, потребляющих нитрит — нитратные соли натрия и кальция.
Основные потребители нитрит — нитратных солей натрия и кальция — станко-машиностроительная, металлургическая, бумажная, резиновая, текстильная, фармацевтическая, пищевая промышленность, строительная индустрия, медицина и сельское хозяйство.
Из-за отсутствия собственного производства нитрит — нитратных солей натрия и кальция Узбекистан вынужден покупать их из-за рубежа (особенно нитритные соли). Годовая потребность Республики в нитрите натрия (только в пищевой промышленности) составляет свыше 5 тыс.т, при стоимость его на мировом рынке от 517,40 до 663,93 долларов США за тонну, а нитрита кальция — более 30 тыс.т. в год.
Представляет интерес разработка новых способов производства нитрата натрия, не требующих затраты щелочей. К таким способам относится получение нитрита натрия из NaCl и оксидов азота, а так же метод катионного обмена.
Процесс получения нитрата натрия методом катионного обмена состоит в основном из трёх стадий:
1. Получение раствора Cа(NO2)2.
2. Катионный обмен и регенерация (обмен ионов Са2+ на ионы Na+).
3. Выпаривание раствора NaNO2, кристаллизация соли, центрифугирование, сушка и упаковка.
Реакции, протекающие в первых двух стадиях процесса, могут быть схематически выражены следующими уравнениями:
Ca(NO3)2 + (катионит) Na2 2NaNO2 + (катионит) Cа
(катионит) Cа + 2NaCl (катионит) Na2 +CaCl2
При этом происходит непрерывное чередование процессов производства нитрата кальция и регенерация катионита кальция растворами хлористого натрия.
Промежуточными стадиями процесса являются: промывка водой катионита, выпарка и кристаллизация конвертированных растворов.
Описываемый метод нашёл промышленное применение в Норвегии.
Растворы нитрита кальция пропускают через ряд катионообменников, в которые загружен цеолит (природный минерал типа полевого шпата). Для регенерации цеолита используют морскую воду. Образующийся раствор нитрата натрия концентрируют выпариванием и далее кристаллизуют соль с последующей перекристаллизацией (для получения более чистого продукта). Готовый продукт можно использовать и в качестве удобрения.
В последующие годы были разработаны другие способы производства нитрита натрия 3.
В способе [4] сульфат натрия растворяют в 60%-ной азотной кислоте. После охлаждения раствора до 200С из него выпадают кристаллы нитрата натрия, которые легко отфильтровывают. После промывки и сушки кристаллов получают нитрит натрия. Образующийся маточный раствор, содержащий в основном серную кислоту, направляется на производство сложных удобрений.
Предлагается получение нитрита натрия разложением хлорида натрия азотной кислотой до содержания азотной кислоты 62-64% и охлаждением до температуры ниже 300С с последующим отделением нитрита натрия, а образовавшиеся маточные растворы концентрируют до содержания азотной кислоты выше 80% с последующим выделением нитрита натрия.
Технологических процессов получения нитрита и нитрата натрия необходимо изучение плотности и вязкости их растворов.
В связи с этим из продуктов конверсии сульфата натрия нитритом и нитратом кальция были подготовлены водные растворы нитрита и нитрата натрия с концентрацией 20, 30 и 40%. Концентрации указанных растворов брались в переделах близкими к производственным условиям.
Определение плотности раствора при 20, 40 600С проводили по общеприятной методике с помощью ареометра.
На рис. 1 и табл. 1 представлены экспериментальные данные по определению плотности водных растворов нитрита и нитрата натрия в зависимости от концентрации и температуры.
Результаты экспериментов показали, что с увеличением концентрации растворов нитрита и нитрата натрия значение плотности повышается. С увеличением температуры, наоборот, наблюдается уменьшение плотности растворов. При температуре 200С плотность растворов нитрата натрия с концентрацией 20, 30 и 40% составляет соответственно 1144,5, 1186,3 и 1256,1 кг/м3, т.е. увеличение плотности относительно 20% — ной концентрации составляет 4% и 10% соответственно для 30 и 40% -ной концентрации растворов. При температуре 400С значения плотности для исследуемых концентрации растворов нитрата натрия составили соответственно 1124,2; 1167,9 и 1237,7 кг/м3. Увеличение плотности относительно 20% ной концентрации составляет соответственно 3,7 и 92%.
Для температуры 600С плотность растворов имела значения 1116,1; 1149,6 и 1229,5 кг/м3. Увеличение плотности относительно 20%-ной концентрации нитрата натрия составило соответственно 3,0 и 9,3%.
Таким образом для 30 и 40% -ных растворов относительно 20%-ного увеличения плотности в интервале 20-600С происходят примерно с одинаковой интенсивностью и для 30% — ного раствора составляет 2,4 — 5,0%, а для 40%-ного раствора — 8,0 — 9,3%
Таблица 1. Значение плотности растворов нитрата натрия в зависимости от температуры и концентрации.
Концентрация растворов нитрата натрия %
Плотность растворов (кг/м3) при температуре, 0С
Источник
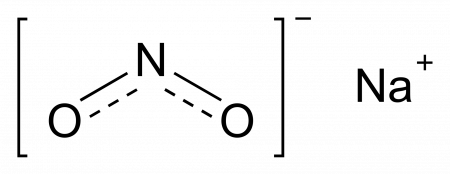
Нитрит натрия


Нитрит натрия (натрий азотистокислый) NaNO2 — соль натрия и азотистой кислоты.
Содержание
- 1 Основные свойства
- 1.1 Получение
- 1.2 Области применения
- 1.2.1 В химическом синтезе
- 1.2.2 Производство пищевых продуктов
- 1.2.3 Строительство и производство
- 1.2.4 Фотография
- 1.2.5 Медицина и биология
- 2 Особенности обращения, биологическое действие
- 3 Рынок
Основные свойства
Очищенный нитрит натрия представляет собой белый или слегка желтоватый кристаллический порошок. Хорошо растворим в воде и гигроскопичен. На воздухе медленно доокисляется до нитрата натрия NaNO3. Является сильным восстановителем. Токсичен в больших дозах.
Получение
Нитрит натрия NaNO2 является солью азотистой кислоты и получается обычно из оксидов азота по реакции:
Другим распространённым методом получения нитрита натрия является нагревание порошка свинца Pb с нитратом натрия NaNO3, с последующим растворением в воде полученной твёрдой субстанции. В результате растворения в осадок выпадет нерастворимый в воде оксид свинца II PbO, а нитрит натрия останется в растворе:
NaNO3 + Pb → NaNO2 + PbO 
Области применения
В химическом синтезе
- Нитрит натрия применяется для образования диазоаминных соединений. Эти соединения применяются в синтезе как источник аминогрупп при реакциях с «ядром» соединения, за счёт относительно более лёгкого отделения азотных групп N2.
- В лабораторных условиях нитрит натрия используется для деактивации азида натрия реакцией со свежеполученной азотистой кислотой
2NaNO2 + H2SO4 → Na2SO4 + 2HNO2 2NaN3 + 2HNO2 → 3N2 + 2NO + 2 NaOH
- Нитрит натрия в химических реакциях проявляет окислительно-восстановительную двойственность, восстанавливаясь до оксида азота II или окисляясь до нитрата.
Например, он при дальнейшем нагревании разлагается, образуя оксид натрия, оксид азота II и кислород. Вероятно, этот процесс помог не задохнуться экипажу первой действующей субмарины Корнелия Дреббеля, поскольку оксид натрия поглощает CO2.
Производство пищевых продуктов
- Используется как улучшитель окраски и консервант в пищевой промышленности в изделиях из мяса и рыбы. Пищевая добавка E250.
- Как пищевая добавка применяется в пищевой промышленности в двух целях: как антиокислитель и как антибактериальный агент, препятствующий росту Clostridium botulinum — возбудителя ботулизма, — тяжёлой пищевой интоксикации, вызываемой ботулиническим токсином и характеризуемой поражением нервной системы (действие не доказано).
- Вступая во взаимодействие с миоглобином (белком мяса), придаёт мясным продуктам характерный розоватый цвет.
- В Евросоюзе продажа для пищевых применений разрешена только в смеси с пищевой солью, с содержанием нитрита около 0,6 %, чтобы уменьшить риск превышения суточных норм. C 2013 года сходные правила действуют в России.
- Пищевая добавка E250. Аналогичными свойствами обладает и нитрит калия — пищевая добавка E249.
- Соответствует ГОСТу 4197-74 или ТУ 6-09-590-75 (марка ОСЧ 4-7-3).
Строительство и производство
- Нитрит натрия в виде порошка по ГОСТ 19906-74 или водного раствора используется в качестве противоморозной добавки к бетонам в производстве строительных изделий и конструкций, в качестве ингибитора атмосферной коррозии, в органическом синтезе и для других целей в химической, металлургической, медицинской, целлюлозно-бумажной и других отраслях промышленности.
- В строительстве нитрит натрия рекомендован ГОСТ 24211 «Добавки для бетонов. Общие технические требования» к использованию в качестве противоморозной добавки при возведении монолитных бетонных и железобетонных конструкций, монолитных частей сборно-монолитных конструкций, замоноличивания стыков сборных конструкций при установившейся устойчивой среднесуточной температуре окружающего воздуха или грунта ниже 5 °C и минимальной суточной температуре ниже 0 °C, а также при изготовлении сборных бетонных и железобетонных конструкций в зимнее время в условиях строительной площадки.
- Он также используется при производстве диазо-красителей, нитросоединений и других органических соединений.
- Используется в крашении трафаретным и прямым (прямой печати) методом текстиля из натуральных и отбеленных натуральных волокон.
- Используется при обработке поверхности металла при фосфатировании и для снятия слоя олова.
- Используется в производстве каучуков.
- Используется для изготовления алкилнитритов (попперсов).
- Используется для приготовления раствора газогенерирующей добавки в производстве взрывчатых веществ.
Фотография
- Используется в процессе традиционной фотографии как реагент и антиокислитель (ингибитор коррозии в автоматических лабораториях).
Медицина и биология
- Нитрит натрия также используется в медицине и ветеринарии как сосудорасширяющее, бронхолитическое (расширяет бронхи), снимает спазмы кишечника, используется как слабительное, а также как антидот при отравлении цианидами.
- Проводятся исследования по применению его при серповидной анемии, сердечных приступах и ишемии сердца, аневризмах головного мозга и лёгочной гипертензии у детей.
E250 при приёме в значительном объёме (порядка нескольких граммов) может вызвать серьёзное отравление (образует метгемоглобин), вплоть до летального исхода.
Особенности обращения, биологическое действие
Поступление нитритов с пищей оценивается в 31-185 или 40-100 мг в день.
В питьевой воде, согласно требованиям ВОЗ 1970 и 2004 гг, допускается содержание нитритов не более 44-50 мг на литр.
Приемлемые уровни потребления нитритов для людей 3,7 — 7 мг / кг.
Рынок
До введения эмбарго на соль из санкционных стран 13 сентября 2016 года (вступило в силу 1 ноября 2016), нитрит натрия для пищевого производства импортировался в Россию в основном из стран Евросоюза: Дании и Германии, собственное производство в России отсутствовало. В декабре 2016 года в Ломоносовском районе Ленинградской области в России начало работу производство нитритной соли для нужд мясоперерабатывающей промышленности.
Источник