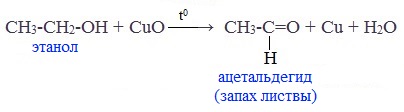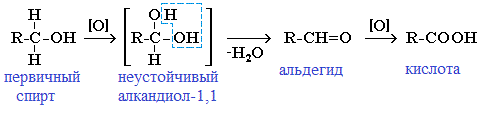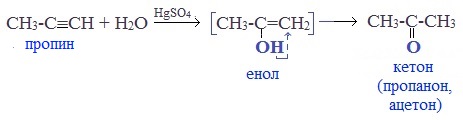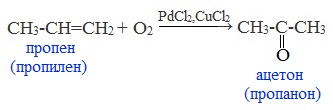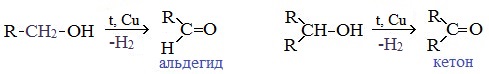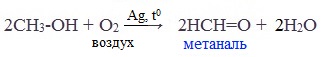- Муравьиный альдегид
- Содержание
- Токсические свойства
- Канцерогенность
- Получение
- Применение
- Муравьиный альдегид. Получение муравьиного альдегида
- Химические свойства
- Производственное получение
- Применение
- Токсические свойства
- Воздействие муравьиного альдегида на организм человека
- Отравление парами формальдегида
- Использование формальдегида в косметических средствах
- Канцерогенность муравьиного альдегида
- Способы получения муравьиного альдегида
- Получение формальдегида
Муравьиный альдегид
Муравьиный альдегид
| Формальдегид | |
|---|---|
 | |
| Общие | |
| Другие названия | Муравьиный альдегид Метаналь |
| Молекулярная формула | CH2O |
| Молярная масса | 30,03 г/моль |
| Вид | газ с острым запахом |
| Свойства | |
| Плотность | 0,9151 г/см³ (при −80 °C) |
| Растворимость в воде | до 37% |
| Температура плавления | −92 °C |
| Температура кипения | −19,2 °C (в др. источниках, −19,3 °C) |
| Опасность | |
| Описание | Обладает токсичными, канцерогенными свойствами Оказывает сильное влияние на ЦНС Опасен для окружающей среды |
| Категория взрывоопасности | II B |
| Группа взрывоопасности | Т2 |
| Концентрационные пределы воспламенения | 7-73% об. |
| Температура самовоспламенения | 435 °C |
| Термодинамические свойства | |
| Ст. энтальпия образования ΔH | −115,9 кДж/моль (г) |
| Ст. энергия Гиббса образования ΔG | −110 кДж/моль (г) |
| Ст. энтропия образования S | 218,66 Дж/моль·K (г) |
| Ст. мольная теплоёмкость Cp | 35,35 Дж/моль·K (г) |
| Энтальпия кипения ΔHкип | 23,3 кДж/моль |
| Если не указано другое, параметры даны для 25 °C, 100 кПа | |
Формальдегид (от лат. formica — муравей), рекомендуемое международное название метаналь, устаревшее — муравьиный альдегид (CH2=O) — газообразное бесцветное вещество с острым запахом, первый член гомологического ряда алифатических альдегидов.
Содержание
Токсические свойства
Обладает токсичностью, негативно воздействует на генетический материал, репродуктивные органы, дыхательные пути, глаза, кожный покров. Оказывает сильное действие на центральную нервную систему.
Смертельная доза 35 % водного раствора формальдегида (формалина) составляет 10 — 50 г.
Канцерогенность
Формальдегид внесен в список канцерогенных веществ [1] [2] [3] .
Получение
Основной способ получения формальдегида — окисление метанола:
Окисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Недавно разработан более перспективный способ, основанный на использовании железо-молибденовых катализаторов. При этом реакция проводится при 300 °C. В обоих процессах степень превращения составляет 99 %.
Процесс дегидрирования метанола, осуществленный на цинк-медных катализаторах при 600 °C, пока не получил широкого развития, однако он является очень перспективным, поскольку позволяет получать формальдегид, не содержащий воды.
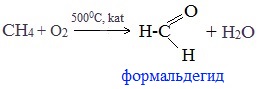
Существует также промышленный способ получения формальдегида окислением метана:
Процесс проводят при температуре 450 °C и давлении 1—2 МПа, в качестве катализатора применяется фосфат алюминия AlPO4
Применение
Водный раствор формальдегида — формалин — свёртывает белки, поэтому он применяется для дубления желатина при производстве кинофотоплёнки, для консервации биологических материалов (создание анатомических и других биомоделей), а также как антисептик.
Формальдегид широко применяется при изготовлении пластмасс (таких, как фенопласт и аминопласты), искусственных волокон, из него получают пентаэритрит (сырьё для производства взрывчатых веществ и пластификаторов), триметилопропан. Основная часть формальдегида идет на изготовление древесностружечных материалов, где он используется для получения карбамидной смолы.
Также формальдегид широко используется в качестве консерванта в различных вакцинах, вводимых человеку, последствия чего до сих пор не изучены.
Источник
Муравьиный альдегид. Получение муравьиного альдегида
Муравьиный альдегид, или формальдегид, – это бесцветный газ, обладающий резким, неприятным, специфическим запахом. Он хорошо растворяется в воде, а также в спиртах. Формальдегид очень токсичен и способен вызвать в организме человека патологические изменения. Кроме того, его считают канцерогеном.
Формальдегид – первый член целого гомологического ряда, в который входит алифатический муравьиный альдегид. Муравьиная кислота также проявляет свойства этой группы.
Химические свойства
Формальдегид способен вступать во все реакции, которые свойственны гомологическому ряду алифатических альдегидов. В том числе и с нуклеофилами. Также он связывается с восстановительными реагентами. Это происходит главным образом по причине того, что у формальдегида низкая электронная плотность на атомах углерода. Благодаря этой особенности строения он очень легко вступает в химические реакции даже с самыми слабыми нуклеофилами. Этим объясняет тот факт, что в водных растворах муравьиный альдегид обнаруживается в гидратированном состоянии.
Производственное получение
У этого вещества довольно простая формула. Муравьиный альдегид на химическом языке выглядит так: HCHO. Основной промышленный метод его получения — это окисление метанола. Эта реакция осуществляется с применением серебряного катализатора. Необходимая температура — 650 градусов. Окисление метанола происходит при атмосферном давлении.
Этот технологический процесс уже достаточно длительное время используется повсеместно. Он хорошо освоен. Примерно 80% формальдегида получают благодаря окислительной реакции метанола. Однако это не единственный способ. Недавно был разработан еще более перспективный метод. Он основывается на применении железо-молибденовых катализаторов. В этом случае снижается уровень необходимой температуры до 300 градусов, а это практически вдвое меньше.
Также известен еще один промышленный способ – окисление метана. У реакции этой довольно простая формула: муравьиный альдегид получается при давлении 1-2 МПа при температуре 450 градусов. В качестве катализатора берется фосфат алюминия.
Применение
Метандиол – водный раствор формальдегида, вызывающий денатурацию белков. Это его качество позволяет использовать данное вещество в качестве дубителя при производстве кожаных вещей. Также он нашел широкое применение при изготовлении кинофотопленки. Из-за сильных дубильных свойств формальдегид известен как антисептик. Он повсеместно используется в медицине. На его основе производят такие антисептические препараты, как «Формагель» и «Формидрон». Уже достаточно долгое время муравьиный альдегид применяют в биологии для хранения биоматериалов, например, органов или трупов животных.
В настоящее время получение муравьиного альдегида выгодно деревообрабатывающей и, конечно, мебельной промышленности. Его используют для производства меламинокарбамидоформальдегидных смол. Они применяются при изготовлении ДСП, фанеры и прочих строительных материалов.
При хранении муравьиного альдегида следует учитывать, что при температуре ниже 10 градусов раствор мутнеет и появляется белый осадок. Также формальдегид взаимодействует с кислородом. В результате образуются по причине вырожденного разветвления дополнительные инициаторы цепи.
Токсические свойства
Итак, формальдегид получают методом окисления метанола и метана. Несомненно, он обладает достаточно высокой степенью токсичности. Муравьиный альдегид в первую очередь воздействует на генетический материал. От этого вещества страдают и репродуктивные органы. Но, конечно, чаще отмечается поражение дыхательных путей, кожных покровов и слизистой глаз.
Опасен формальдегид еще и тем, что он оказывает негативное действие на ЦНС.
Муравьиный альдегид не просто токсичен — 60-90 мл вещества (в зависимости от массы тела), попавшие внутрь, вызовут смерть. Симптомы отравления следующие:
- общий упадок сил;
- бледность кожных покровов;
- бессознательное состояние;
- угнетение ЦНС;
- затрудненное дыхание;
- сильная головная боль;
- судороги, особенно в ночное время.
Воздействие муравьиного альдегида на организм человека
Применение муравьиного альдегида в производстве нередко вызывает разные степени отравления у работников предприятия. При сильном ингаляционном поражении, то есть при вдыхании вещества, наблюдаются конъюнктивит и острая форма бронхита, которая иногда приводит к отеку легкого. Симптоматика при длительном воздействии формальдегида будет только нарастать. Спустя непродолжительное время появятся признаки поражения и угнетения ЦНС. Это будет выражаться в постоянном головокружении, возникнет чувство страха, походка станет шаткой, а в ночное время у человека могут быть даже судороги.
Если отравление произошло через рот, то первым симптомом будет ожог слизистой оболочки пищеварительного тракта. Он будет проявляться в виде боли, жжения в горле и по ходу пищевода. Человек ощущает сильные рвотные позывы, масса, отторгаемая желудком, будет содержать кровь. В тяжелых случаях развивается отек гортани и наблюдается рефлекторная остановка дыхания.
При хроническом отравлении малыми концентрациями у человека отмечаются сильная потеря веса, психическое возбуждение, расстройство зрения, бессонница и постоянные головные боли.
Отравление парами формальдегида
Муравьиный альдегид чаще всего обнаруживается в воздухе. У работников предприятий, занятых в работе, связанной с изготовлением искусственных смол, при наличии постоянного и длительного контакта с парами формальдегида возможно отравление. Нередко уже в первые рабочие дни у человека появляются заметные дерматиты на лице, руках. Присутствие формальдегида в организме видно по ухудшению состояния ногтей — они размягчаются и становятся ломкими.
Экземы и дерматиты могут носить аллергический характер. После того как человек перенес отравление, у него формируется к муравьиному альдегиду сильная чувствительность. Имеются сведения о том, что формальдегид неблагоприятно влияет на функционирование репродуктивной системы женского организма.
Использование формальдегида в косметических средствах
Содержание формальдегида допускается в качестве консерванта в косметических средствах, но его концентрация не должна превышать 0,1%. Муравьиный альдегид может присутствовать в зубной пасте, кремах для тела, лица и рук.
Также в фармакологии, в некоторых средствах, препятствующих обильному потоотделению, может находится формальдегид. Его допустимая концентрация — 0,5%. Это вещество — хороший антисептик, даже в столь малых количествах он способен уничтожать микроорганизмы. Строго запрещается наносить на лицо любую мазь, если в ее составе находится 5% формальдегида. Это чревато появлением дерматитов и аллергических реакций. Также муравьиный альдегид не используют для консервации косметических средств, если они будут продаваться в качестве аэрозолей и спреев.
Вся продукция на своей этикетке должна содержать информацию относительно содержания этого опасного вещества, даже если его количество 0,05%. В действительности до сегодняшнего дня не выяснено, как влияет раствор формальдегида на кожу, но известно, что у животных она краснеет и шелушится.
Канцерогенность муравьиного альдегида
Известно, что формальдегид взаимодействует с селеном при участии высококонцентрированной серной кислоты. В результате образуется сульфоэфир-4-тетрадецилидиоксан. Это вещество со сложным названием после обработки гидратом окиси бария становится прекрасным моющим средством. Казалось бы, в чем опасность? Но формальдегид внесен в список веществ, обладающих канцерогенными качествами. Хотя степень его опасности пока не установлена, нельзя не принимать во внимание тот факт, что муравьиный альдегид смертельно опасен для животных. По официальным данным многих научных центров мира, связь между применением формальдегида при производстве красок, смол, текстиля, пластика и возникновением онкологических новообразований у человека доказана. Особенно высок риск развития рака носоглотки.
Источник
Способы получения муравьиного альдегида
1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
При окислении первичных спиртов образуются альдегиды:
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
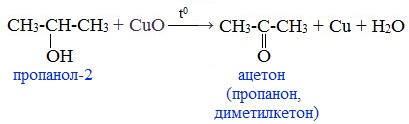
При окислении вторичных спиртов образуются кетоны:
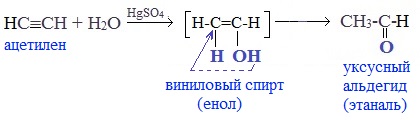
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
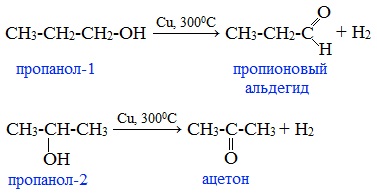
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
Этот способ получения объясняет суть названия «альдегид» (от лат. alconol dehydrogenatum – спирт, от которого «отняли» водород).
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1835 г. немецкий химик Ю. Либих выделил индивидуальное вещество, молекула которого содержала на два атома водорода меньше, чем этанол. Ученый установил состав этого соединения – С2Н4О и назвал его альдегидом (от лат. al conol dehyd rogenatum — т.е. дегидрированный спирт, «спирт, лишенный водорода»).
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
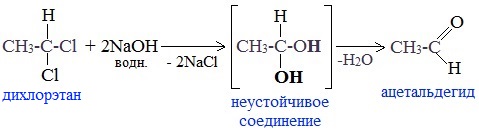
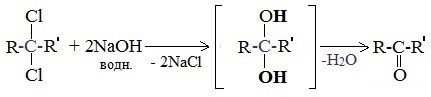
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Это лабораторный способ получения карбонильных соединений.
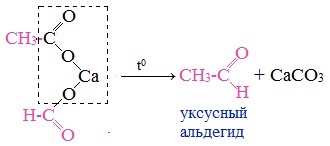
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
Это лабораторный способ получения карбонильных соединений.
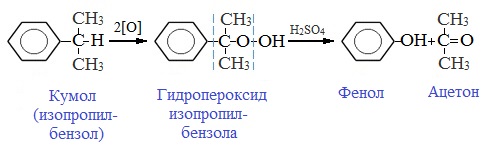
7. Кумольный способ получения ацетона (наряду с фенолом)
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Получение формальдегида
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Источник