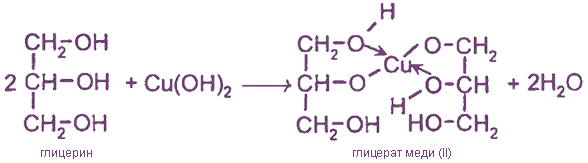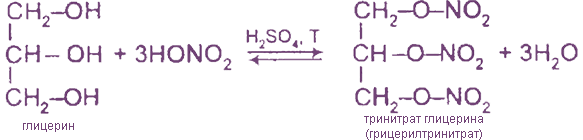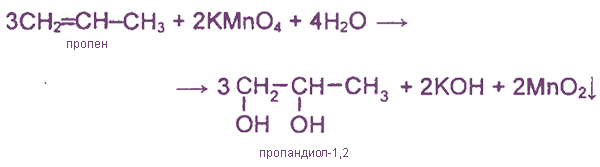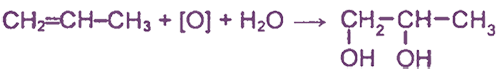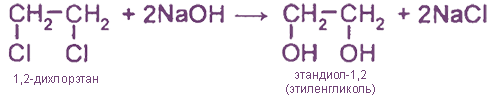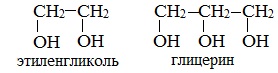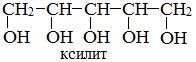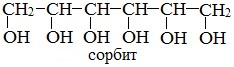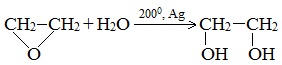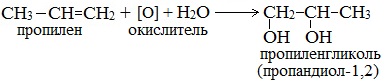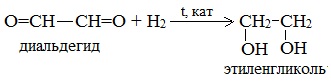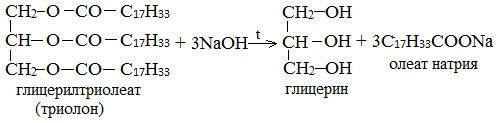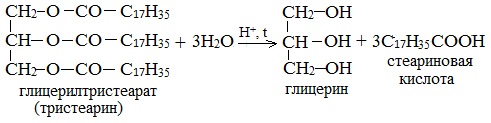Физические свойства многоатомных спиртов
Физические свойства: этиленгликоль и глицерин при обычных условиях представляют собой бесцветные вязкие жидкости, легко смешивающиеся с водой; температура кипения этиленгликоля около 200°С, а глицерина — чуть ниже З00°С. Этиленгликоль ядовит, глицерин сладкий на вкус.
Химические свойства многоатомных спиртов
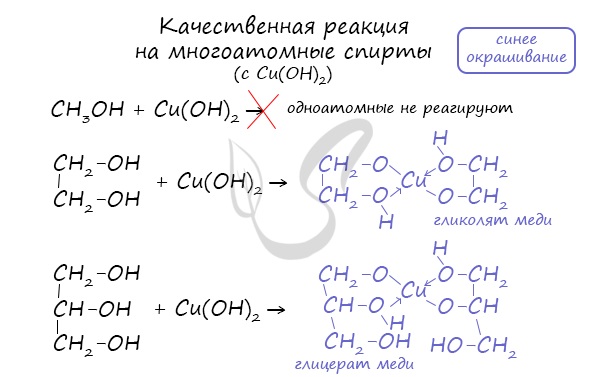
1. Качественная реакция на многоатомные спирты
Голубой осадок Сu(ОН)2 растворяется в многоатомных спиртах с образованием синефиолетового раствора глицерата меди (II).
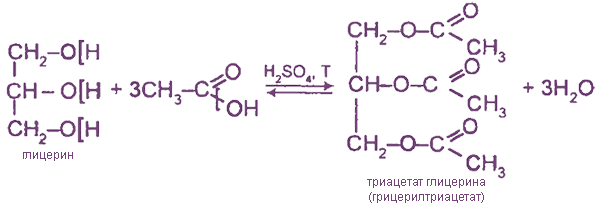
2. Реакции этерификации с органическими и неорганическими кислотами
Тринитрат глицерина (тривиальное название — нитроглицерин) — известное взрывчатое вещество и не менее известное лекарственное (сосудорасширяющее) средство.
Cпособы получения многоатомных спиртов
Гликоли
1. Окисление алкенов перманганатом калия в нейтральной среде (гидроксилирование)
2. Щелочной гидролиз дигалогеналканов
Глицерин
1. Кислотный гидролиз животных жиров или растительных масел
Источник
Способы получения многоатомных спиртов реакции
Многоатомные спирты (полиспирты, полиолы) – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
Многоатомные спирты — соединения, у которых две или несколько гидроксильных групп расположены у соседних атомов углерода.
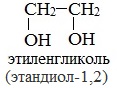
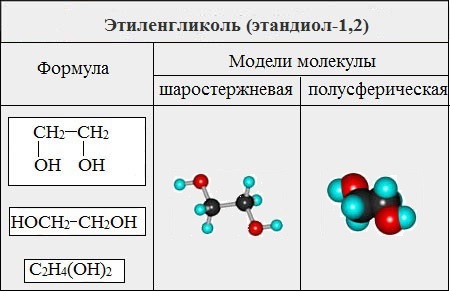
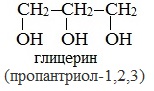
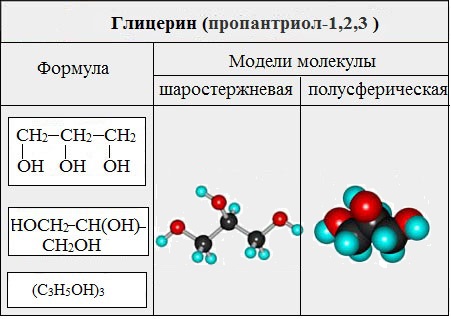
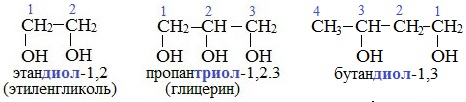
Важнейшими представителями многоатомных спиртов являются двухатомный спирт этандиол-1,2 (этиленгликоль), и трехатомный спирт пропантриол-1,2,3 (глицерин):
Существуют многоатомные спирты, содержащие и большее количество групп -ОН в молекуле, например, пятиатомный спирт ксилит, который используют в качестве заменителя сахара:
или шестиатомный спирт гексанол (сорбит):
Двухатомные спирты, содержащие две гидроксильные группы -ОН, называются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы, — глицеринами, или триолами.
I. Гликоли (диолы)
Этиленгликоль С2Н4(ОН)2 — представитель предельных двухатомных спиртов — гликолей.
Название гликоли получили вследствие сладкого вкуса многих представителей ряда (греч. «гликос» — сладкий).
II. Глицерины (триолы)
Глицерин (С 3 Н 5 ОН) 3 — простейший представитель трехатомных предельных спиртов — глицеринов .
Номенклатура
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами —диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Физические свойства
Этиленгликоль — сиропообразная, вязкая бесцветная жидкость, tпл = 11,5 0 C, tкип = 197,6 0 C. Этиленгликоль гигроскопичен, смешивается с водой и этиловым спиртом в любых отношениях. Он сильно понижает температуру замерзания воды, поскольку раствор этиленгликоля в воде имеет низкую температуру замерзания (60%-ый раствор замерзает при -49 0 С).
Поэтому этиленгликоль широко используется в системах охлаждения двигателей в качестве антифриза (от анг. to freeze — «замерзать») – вещества с низкой температурой замерзания, заменяющего воду в радиаторах автомобильных и авиационных моторов в зимнее время. Антифризы также замедляют ее испарение летом.
Этиленгликоль используется также для производства синтетического волокна полиэфирного волокна – лавсана.
Этиленгликоль очень токсичен! Это сильный яд! Этиленгликоль вызывает длительное угрожающее жизни угнетение центральной нервной системы и поражение почек. Продуктами его превращения в организме являются щавелевая кислота и другие не менее ядовитые соединения. Он имеет спиртовой запах, в связи, с чем может быть принят за этиловый спирт и стать причиной тяжелых отравлений.
Видеоопыт «Изучение физических свойств глицерина»
Глицерин – бесцветная, вязкая, сиропообразная жидкость, сладкая на вкус. Не ядовит. Глицерин не имеет запаха, его tпл = 18 0 С, tкип = 290 0 С. Глицерин гигроскопичен, хорошо смешивается с водой и этанолом. На этом свойстве основано применение глицерина в косметической промышленности, где глицерин используется для увлажнения кожи.
Абсолютно чистый безводный глицерин затвердевает при +18 0 С, но получить его в твердом виде чрезвычайно сложно.
Глицерин широко распространен в живой природе. Он играет важную роль в процессах обмена в организмах животных, входит в состав большинства липидов – жиров и других веществ, содержащихся в животных и растительных тканях и выполняющих в живых организмах важнейшие функции. Благодаря этим свойствам глицерин является важным компонентов многих пищевых продуктов, кремов, косметических средств.
Этиленгликоль и глицерин, благодаря наличию гидроксильных групп, могут образовывать водородные связи с молекулами воды, этим объясняется их не ограниченная растворимость в воде.
Источник
Способы получения многоатомных спиртов реакции
Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения.
I. Получение двухатомных спиртов
В промышленности
1.Каталитическая гидратация оксида этилена (получение этиленгликоля)
2.Щелочной гидролиз дигалогеналканов
При обработке дигалогенопроизводных углеводородов водным раствором щелочи также можно получить гликоли:
В лаборатории
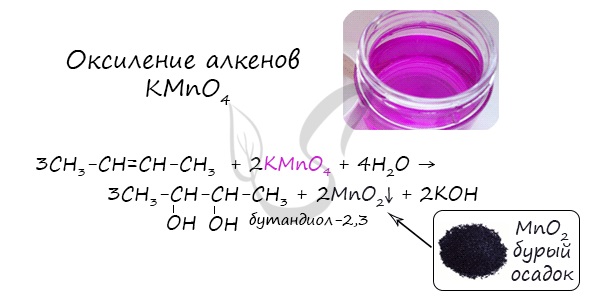
1.Окисление алкенов (реакция Вагнера)
Двухатомные спирты можно получить при «мягком» окислении алкенов водным или слабощелочным раствором перманганата калия:
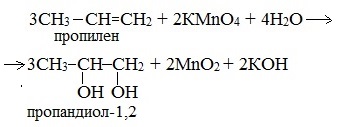
2.Восстановление поликарбонильных соединений
II. Получение трехатомных спиртов
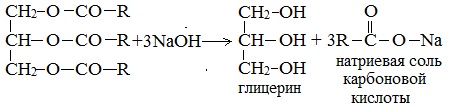
1.Щелочной гидролиз природных жиров (омыление жиров (триглицеридов))
Гидролиз протекает в присутствии кислот или щелочей в качестве катализаторов, а также под действием ферментов:
2. Кислотный гидролиз животных жиров или растительных масел
Гидролиз жиров – основной способ получения глицерина.
3. Синтез из пропилена
Глицерин также можно получить синтетическим путем – из газов крекинга нефти (пропилена), т.е. из не пищевого сырья:
Источник
Спирты
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
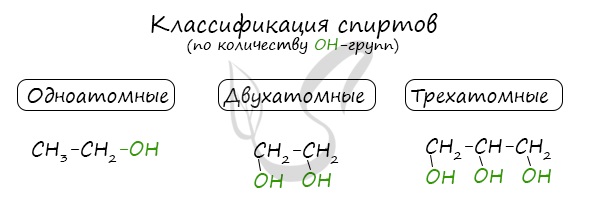
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
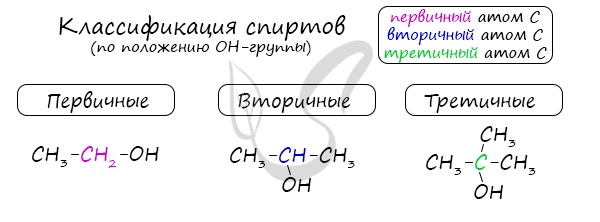
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
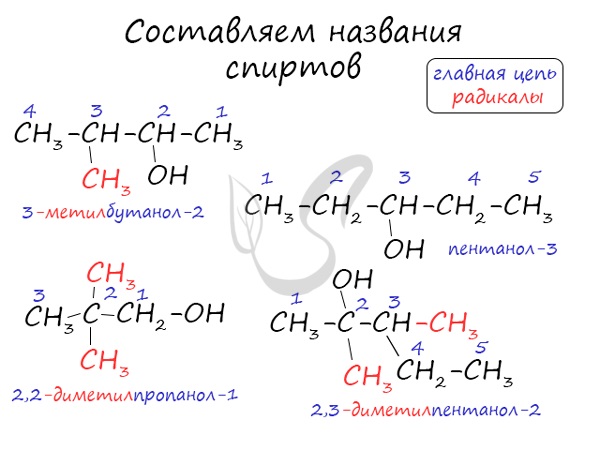
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
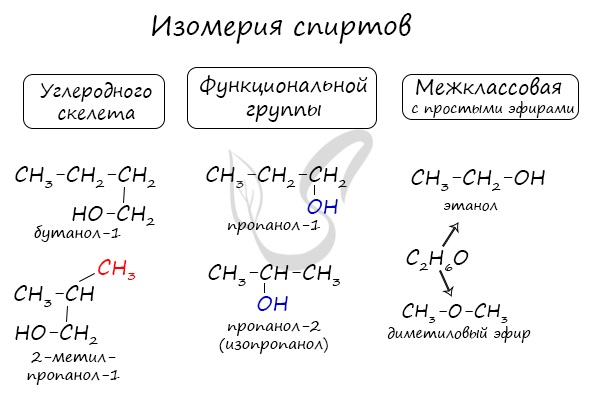
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты.
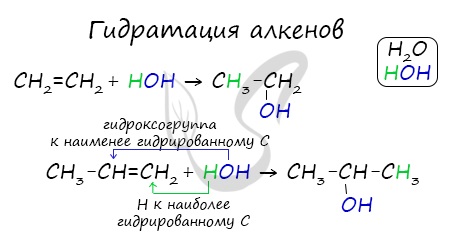
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
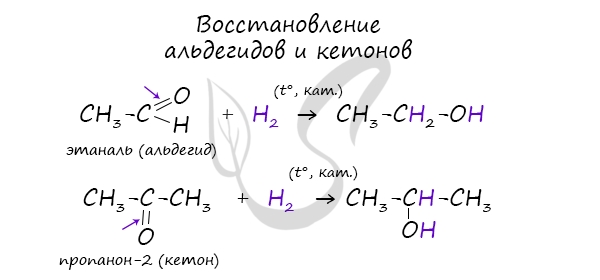
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
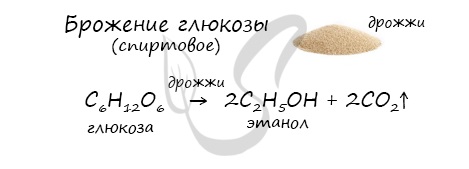
Получение этанола брожением глюкозы
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
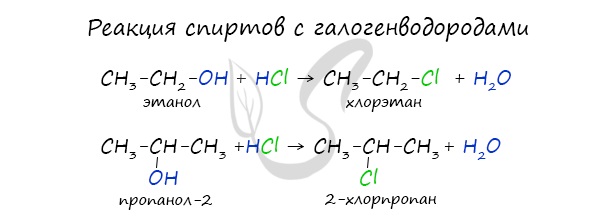
Реакция с галогеноводородами
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
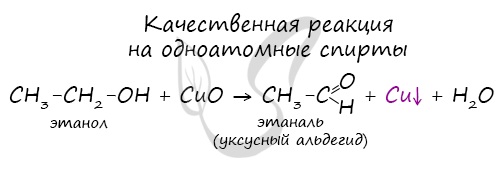
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
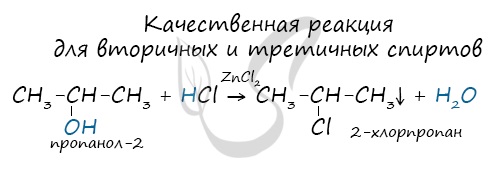
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
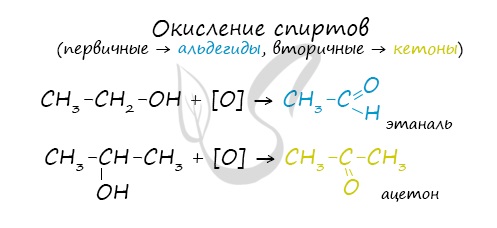
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
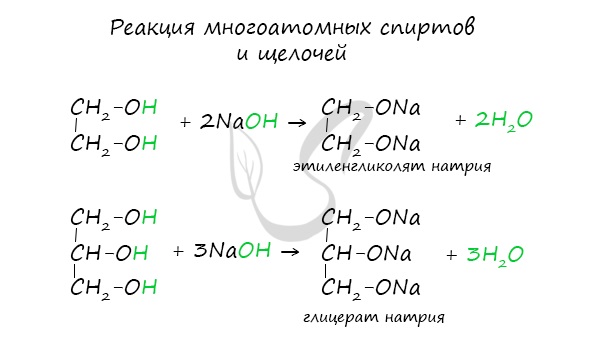
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник