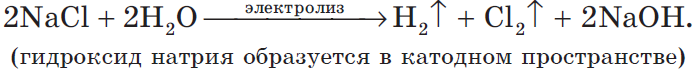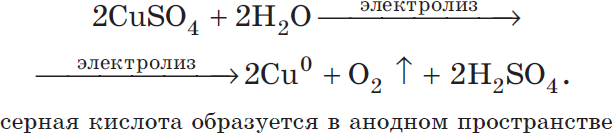- Электролиз расплавов и растворов
- Теория к заданию 22 из ЕГЭ по химии
- Электролиз расплавов и растворов (солей, щелочей)
- Электролиз расплавленных солей
- Электролиз водных растворов электролитов
- СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛОВ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННЫХ СОЛЕЙ Российский патент 2006 года по МПК C25C3/06
- Описание патента на изобретение RU2274680C2
- Похожие патенты RU2274680C2
- Иллюстрации к изобретению RU 2 274 680 C2
- Реферат патента 2006 года СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛОВ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННЫХ СОЛЕЙ
- Формула изобретения RU 2 274 680 C2
Электролиз расплавов и растворов
Теория к заданию 22 из ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Электролиз расплавленных солей
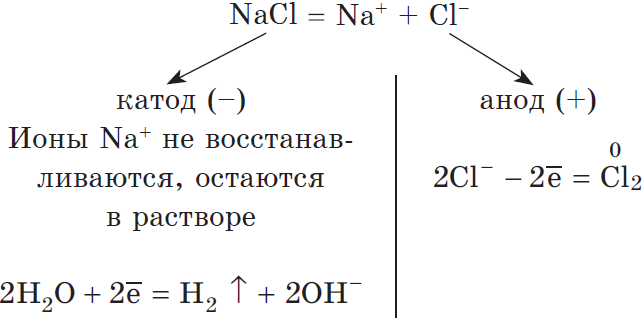
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
Под действием электрического тока катионы $Na^<+>$ движутся к катоду и принимают от него электроны:
Анионы $Cl^<->$ движутся к аноду и отдают электроны:
Суммарное уравнение процессов:
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
| $Li K Ca Na Mg Al$ $Li^ <+>K^ <+>Ca^ <2+>Na^ <+>Mg^ <2+>Al^<3+>$ | $Mn Zn Fe Ni Sn Pb$ $Mn^ <2+>Zn^ <2+>Fe^ <2+>Ni^ <2+>Sn^ <2+>Pb^<2+>$ | $H_2$ $2H^<+>$ | $Cu Hg Ag Pt Au$ $Cu^ <2+>Hg_2^ <2+>Ag^ <+>Pt^ <2+>Au^<3+>$ |
| Восстанавливается вода: $2H_2O+2ē=H_2↑+2OH^<−>;$ $M^ | Восстанавливаются катионы металла и вода: $M^ $2H_2O+2ē=H_2↑+2OH^<−>$ | Восстанавливаются катионы металла: $M^ | |
| $nē→$ Усиление окислительных свойств катионов (способности принимать электроны) | |||
2. Процесс на аноде зависит от материала анода и от природы аниона.
| Кислотный остаток $Ас^ | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода $M^<−>−nē=M^ анод раствор | Окисление аниона (кроме $F^<–>$) $Ac^ |
| Кислородсодержащий | В кислотной и нейтральной средах: $2H_2O−4ē=O_2↑+4H^<+>$ В щелочной среде: $4OH^<−>−4ē=O_2↑+4H^<+>$ | |
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Учитывая присутствие ионов $Na^<+>$ в растворе, составляем молекулярное уравнение:
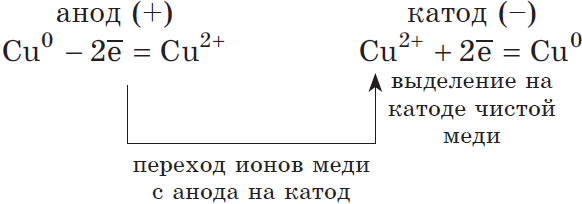
2) Анод растворимый (например, медный):
Если анод растворимый, то металл анода будет окисляться:
Катионы $Cu^<2+>$ в ряду напряжений стоят после ($Н^<+>$), по этому они и будут восстанавливаться на катоде.
Концентрация $NaCl$ в растворе не меняется.
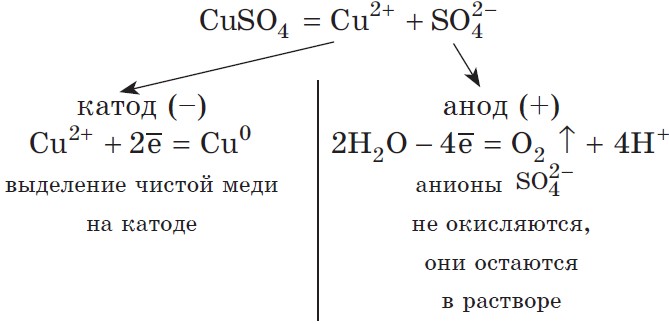
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^<2->$ в растворе:
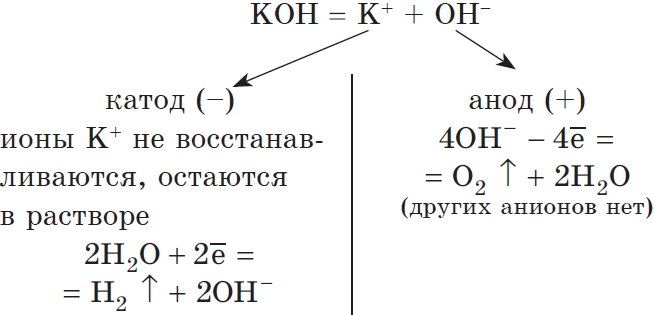
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение:
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Источник
СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛОВ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННЫХ СОЛЕЙ Российский патент 2006 года по МПК C25C3/06
Описание патента на изобретение RU2274680C2
Изобретение относится к области цветной металлургии, а именно к способам получения металлов или сплавов (прежде всего алюминия) электролизом суспензий оксидов металлов в расплавленных электролитах. Получаемыми металлами помимо алюминия могут быть магний, литий, натрий, свинец.
Известен способ (US Patent 5498320, Rendall, МПК С 25 С 3/06, March 12, 1996), согласно которому алюминий выделяют электролизом суспензии глинозема в расплавленном сульфате калия при 750°С. Суспензия получается путем плавления сульфата калия и двойной соли KAlSO4 при 800°С, в результате чего в течение двадцати минут выделяются отходящие газы SO3 и остается суспензия мелкодисперсного глинозема в расплавленном сульфате калия. Последняя перекачивается в электролизер, где при пропускании постоянного тока и напряжении на электролизере 4 вольта на аноде выделяется кислород, а на пористом катоде — алюминий.
Основными недостатками предложенного способа являются: постоянное выделение большого количества серного ангидрида, который, являясь сильным окислителем, будет приводить к коррозии конструкционных элементов и превращаться в ядовитый сернистый ангидрид. Необходимость в дополнительной операции приготовления суспензии и перекачки ее в электролизер приводит к увеличению расходов электроэнергии и затрат на аппаратную часть. Применительно к производству алюминия, использование данного способа потребует перевода всей отрасли на другой вид электролита. Наличие в расплаве ионов калия делает почти невозможным использование углеродных конструкционных элементов электролизера, находящихся в контакте с суспензией.
Известен также способ — прототип (US Patent 5006209, МПК С 25 С 3/06, April, 9, 1991), согласно которому алюминий производится путем пропускания электрического тока между катодом и анодом в суспензии мелких частиц оксида алюминия (глинозема) в низкотемпературных (существенно ниже 950°С) фторидных расплавах. Процесс протекает в электролизере, имеющем множество вертикальных нерасходуемых анодов и множество размерно-стабильных вертикальных катодов. Размещенный на дне электролизера газовый генератор поддерживает частицы глинозема во взвешенном состоянии. Концентрация глинозема в суспензии находится в пределах от 2 до 30 вес.%.
Способ имеет следующие недостатки: использование низкотемпературных расплавов с небольшой растворимостью глинозема не позволяет использовать анодную плотность тока выше 0,4 А/см 2 , а в основном — 0,2 А/см 2 , что ограничивает производительность электролизера, в противном случае нерасходуемые аноды будут подвергаться значительной коррозии. Заявленный диапазон концентрации глинозема в суспензии (особенно его нижний предел) и наличие газового генератора на дне электролизера предусматривает высокую вынужденную конвекцию в зазорах между анодами и катодами, что не позволяет достигать высоких значений выхода по току и, тем более, не дает возможности уменьшить межполюсное расстояние, а значит, снизить удельный расход электроэнергии.
Задачей изобретения является создание способа, позволяющего обеспечить эффективное разделение продуктов электролиза при небольших межэлектродных расстояниях (0,5-2 см) и высокую энергетическую эффективность процесса. Предлагаемый способ решит проблемы получения алюминия, связанные с низкой растворимостью и скоростью растворения глинозема в низкотемпературных расплавах.
Технический результат заключается в исключении конвекции в зазоре между электродами и солевой пассивации поверхности электродов, а также в создании эффективного разделения катодного и анодного пространства и повышении плотности тока.
Поставленная цель достигается тем, что в способе получения металлов электролизом суспензии оксидов металлов в расплавленных солях путем пропускания электрического тока между катодом и анодом, в соответствии с предлагаемым способом содержание оксидов металлов в расплавленных солях выбрано в пределах, обеспечивающих эффективное разделение приэлектродных пространств и исключающих конвекцию в зазоре между электродами, и составляет 10-60 мас.%, при этом температуру электролиза поддерживают выше температуры ликвидуса солей, кристаллизующихся на электродах, что исключает солевую пассивацию поверхности электродов и позволяет использовать высокие плотности тока.
Предлагаемый способ получения металлов электролизом дополняют частные отличительные признаки, направленные на решение поставленной задачи.
Дисперсионная среда суспензии оксидов металлов представлена фторидным, фторидно-хлоридным расплавом или хлоридным расплавленным электролитом.
Выделяемый на катоде алюминий, а на аноде — кислород отводят по внешней и внутренней поверхности электродов.
Функция суспензии заключается в эффективном разделении приэлектродных пространств, что способствует получению высоких значений выхода по току, а при использовании малорасходуемых анодов уменьшению скорости их коррозии, так как при этом уменьшается поток растворенного металла от катода и продуктов коррозии от анода. Эффективное разделение суспензией при высоких концентрациях твердой фазы возможно благодаря ее высокой вязкости. Суспензия представляет собой неньютоновскую жидкость, которая остается неподвижной до тех пор, пока не будет приложено определенное напряжение.
В результате эффективного разделения суспензией приэлектродных пространств межполюсное расстояние (МПР) поддерживается в пределах от 2 до 20 мм при условии сохранения высоких значений выхода по току.
Частицы оксида металла в суспензии являются источником производимого металла. Так как нерастворенные частицы оксида находятся в контакте с расплавленным электролитом, то он всегда насыщен оксидом. Это позволяет вести электролиз при анодных плотностях тока, близких к предельным, после превышения которых начинается катастрофическая коррозия инертных анодов или разряд других видов ионов. При содержании оксидов металлов в расплавленных солях менее 10 вес.% не будет обеспечиваться эффективное разделение приэлектродных пространств. При увеличении содержания оксидов металлов в расплавленных солях больше 60 вес.% значительно повысится сопротивление суспензии и будет затруднен отвод анодного газа и жидкого металла.
Для устранения накопления и отвода продуктов электролиза с поверхности электродов при небольших значениях МПР рабочие поверхности анодов и катодов могут иметь углубления, отверстия, каналы и тому подобные средства.
Таким образом, создаются условия, когда в межполюсном пространстве отсутствует конвекция и только тонкий слой электролита, прилегающий к поверхности электродов, способен перемещаться, увеличивая, посредством этого, скорость соответствующей реакции. Поскольку суспензия в МПР почти неподвижна, то поток растворенного металла и продуктов коррозии инертных анодов контролируется медленной стадией диффузионного массопереноса, что способствует достижению высоких значений выхода по току и низких скоростей коррозии анодов.
Сопоставительный анализ признаков заявляемого решения и признаков аналога и прототипа свидетельствует о соответствии решения критериям «новизна» и «существенные отличия».
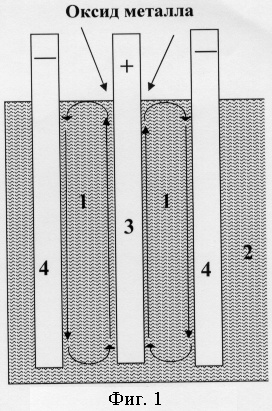
Предлагаемый способ поясняется рисунками, где:
на фиг.1 показана схема циркуляции суспензии;
на фиг.2 — поперечное сечение лабораторной ячейки электролиза суспензии глинозема в низкотемпературном расплаве.
Замкнутый циркуляционный контур суспензии (фиг.1) расположен в МПР (1). При этом вдоль поверхностей электродов циркулирует только тонкий слой суспензии, в котором доля электролита больше, чем в объеме суспензии (2). Почти неподвижная суспензия в середине МПР служит в качестве пористой диафрагмы, разделяющей прианодное и прикатодное пространства. Газообразный кислород, выделяющийся на аноде (3), перемешивает и увлекает часть расплава вверх. После этого нисходящий поток скользит вдоль поверхности катода (4), помогая металлу стекать по поверхности электрода и/или проникать в его каналы. Для питания оксид металла подается на поверхность суспензии вблизи анода там, где выходящие на поверхность пузырьки газа способствуют интенсивному перемешиванию частиц оксида металла с расплавом. В вертикальной лабораторной ячейке (фиг.2) смачиваемый алюминием катодный стержень (4) выполнен квадратным сечением с одним продольным каналом и несколькими открытыми поперечными каналами. Внутренняя поверхность каналов также смачивалась алюминием. Верх катода был изолирован алундовой трубкой (5). Катод установлен на дно алундового тигля с суспензией (2) и погружен в алюминий, отделенный от суспензии над ним посредством алундовой горизонтальной перегородки (6). Кислородвыделяющий анод был подвешен на привинченном к нему токоподводе (7) на расстоянии приблизительно 2 см от катода.
Электролизная ванна для получения металлов электролизом суспензии может быть многополярным или биполярным электролизером с вертикальными или наклонными электродами. Электролит должен содержать соль производимого металла и растворенный оксид такого металла. Для производства сплавов допустимо использовать смесь оксидов металлов, входящих в состав сплава.
В предлагаемом способе используется неугольный нерасходуемый анод и катод со смачиваемой алюминием или металлом поверхностью. Рабочие поверхности катода сделаны из огнеупорного тугоплавкого металла или покрыты слоем смачиваемого алюминием или металлом огнеупорного материала, такого как частицы борида тугоплавкого металла, входящих в состав наносимой на углеродную подложку суспензии, к примеру, так, как это описано в US Patent 5651874.
Аноды могут быть покрыты или сделаны из любого подходящего нерасходуемого или практически нерасходуемого электропроводного материала, стойкого к воздействию электролита, выделяющегося на аноде кислорода, а также других газов и испарений, присутствующих в электролизере.
Суспензия должна состоять из электролита и оксида производимого металла. Предпочтение следует отдать электролитам с максимально возможной растворимостью по соответствующему оксиду. Содержание порошка оксида в суспензии может варьироваться в пределах от 10 до 60 вес.%, так чтобы сформировался достаточно вязкий расплав для эффективного разделения приэлектродных пространств. Оксид металла для суспензии должен выбираться с учетом свойств (удельная поверхность, распределение частиц по размерам и т.д.), которые препятствуют быстрому осаждению дисперсной фазы и расслоению суспензии.
В качестве растворителя применяются фториды и хлориды щелочных и щелочноземельных металлов с большим напряжением разложения. В качестве фторидов в допустимых пропорциях могут быть использованы BaF2, NaF, AlF3, MgF2, LiF, KF и CaF2.
Использование низкотемпературной суспензии дает помимо указанных выше преимуществ возможность значительного снижения температуры электролиза. Последнее способствует снижению теплового воздействия на все элементы конструкции электролизера, что может позволить использовать ранее не применявшиеся конструкционные материалы. Однако в случае низкотемпературной суспензии из-за низкой растворимости оксида алюминия и других металлов в расплавах, имеющих низкую температуру ликвидуса, анодная плотность тока должна быть снижена до 0,1-0,4 А/см 2 .
Низкотемпературный электролит может включать смесь из 42-63 вес.% AlF3, до 48 вес.% NaF, до 48 вес.% LiF и иметь температуру ликвидуса в диапазоне 680-880°С, но предпочтительно 700-860°С.
Другим примером низкотемпературного электролита, основанного на фторидах, является следующий состав: около 35 вес.% LiF, около 45 вес.% MgF2 и около 20 вес.% CaF2. Электролит данного состава имеет температуру солидуса около 680°С.
Также можно использовать следующий состав низкотемпературного фторидного электролита: BaF2-NaF-KF-AlF3 (12-20-9-59 мас.%). Этот электролит имеет температуру ликвидуса 720°С и концентрацию насыщения глиноземом 2,3 вес.%.
Другие возможные электролиты включают хлориды металлов I-II групп, например лития, натрия, калия, магния, кальция, хлористый алюминий отдельно или в смеси с фторидами щелочных, щелочноземельных металлов и металлов I-II групп, к примеру с фтористым литием, натрием, калием, магнием, кальцием и алюминием. Вообще, хлориды химически менее агрессивны, чем фториды, но в них также существенно ниже растворимость оксидов. Примером основанного на хлоридах электролита может служить следующий состав: от 0,5 до 15 вес.% хлорида алюминия, от 3 до 40 вес.% хлоридов щелочноземельных металлов на выбор из хлоридов бария, кальция, магния и стронция, от 10 до 90 вес.% хлорида лития и от 10 до 80 вес.% хлорида натрия с соотношением NaCl/LiCl около 2,33, Такой электролит плавится при температуре около 650°С.
Электролиты, содержащие соли лития, более предпочтительны, так как при их использовании повышается стойкость углеродных конструкционных материалов. Литий проникает в углерод быстрее натрия и препятствует его дальнейшему проникновению, тем самым снижая разрушаемость, вызванную образованием интеркалятов натрия. Кроме того, литий может использоваться как присадка к некоторым керамическим оксидам, применяемым в качестве анодных материалов, или для предотвращения растворения лития из таких анодов. В любом случае соли лития имеют преимущество в том, что значительно увеличивают электропроводность электролита.
Смеси хлоридов и фторидов могут быть полезны для улучшения физических свойств, таких как плотность, вязкость и химическая активность. Подходящие смешанные хлоридно-фторидные расплавы включают один или больше фторидов таких элементов, как натрий, калий, литий, кальций и алюминий, и один или больше хлоридов названных элементов. Обычно количество фторидов в таких составах достигает 70-90 вес.%, соответственно количество хлоридов — 10-30 вес.%.
Пример 1. Возможность проведения электролиза суспензии глинозема в расплавленном фторидном электролите была установлена в лабораторном эксперименте с использованием низкотемпературного электролита следующего состава: 61,1 вес.% AlF3 и 38,9 вес.% NaF. Электролит этого состава имеет температуру ликвидуса 695°С. При 750°С он имеет растворимость глинозема 1 вес.%, плотность 2,0 г/см 2 и электропроводность 1,3 Ом -1 ·см -1 .
Электролит был приготовлен перемешиванием просушенных порошков AlF3 и NaF в ступке, а затем помещен в алундовый стакан и нагрет до температуры 750°С. Для приготовления суспензии взвешенное количество предварительно просушенного при 100°С глинозема периодически добавлялось в электролит порциями по 8 грамм. О качественном состоянии суспензии судили по поведению алундового стержня, который периодически опускали в стакан для перемешивания глинозема и электролита. Глинозем перестали добавлять, когда этот стержень стал вертикально стоять погруженным в расплав. Отсутствие видимого осаждения глинозема и разделения двух фаз было дополнительным критерием для суждения о свойствах суспензии, которые не препятствовали бы успешному проведению последующего электролиза.
В результате описанной процедуры была получена суспензия с концентрацией 42,2 вес.% глинозема в электролите 61,1 вес.% AlF3 и 38,9 вес.% NaF. После охлаждения этой суспензии по занимаемому объему была рассчитана ее приблизительная плотность, которая составила около 3,3 г/см 3 .
Приготовленная по описанной выше процедуре суспензия была охлаждена, разбита на куски и измельчена. Затем измельченную суспензию поместили вместе с вертикально установленными керметным анодом и предварительно смоченным алюминием стальным катодом в ячейку и нагрели ее до температуры 750°С. Снятием анодных поляризационных кривых было определено, что потенциал анода не достигает потенциала, при котором происходит катастрофическая коррозия анода даже при плотностях тока выше 0,2 А/см 2 . Двухчасовой электролиз при анодной плотности тока 0,1 А/см 2 показал, что напряжение ячейки остается стабильным, демонстрируя возможность проведения электролиза суспензии.
Пример 2. В другом эксперименте ячейка включала алундовый стакан (⊘80×120 мм), который служил емкостью для расплава. Чтобы организовать пространство для сбора алюминия нижнюю часть стакана отделили от верхней перегородкой. В качестве перегородки выступал перевернутый алундовый стакан (⊘70×25 мм) с прорезью для установки катода. Внешний диаметр этого стакана был почти равен внутреннему диаметру стакана-емкости.
Смачиваемый алюминием дренированный катод (графитовый стержень 14×14×100 мм с покрытием на основе диборида титана) имел внутренние каналы (⊘2 мм), поверхность которых также смачивалась алюминием. Верх катода был изолирован алундовой трубкой. Общая площадь поверхности катода (выше «ложного дна») составляла 28 см 2 . Катод был обернут алюминиевой фольгой до его установки в ячейку.
В качестве анода служила пластина из кермета (10,5×49×140 мм). Общая площадь поверхности погруженной части была около 55 см 2 . Межполюсное расстояние составляло около 2,5 см.
Первым на дно ячейки был помещен алюминий (30 г), сверху которого разместили перегородку. Электроды, а затем и электролит (85 вес.% NaF+AlF3 с KO=1 и 15 вес.% LiF) также были помещены в ячейку. Вся ячейка была нагрета до температуры 750°С. Далее был проведен электролиз при катодной плотности тока около 0,2 А/см 2 .
Первая стадия электролиза (период смачивания катода алюминием) длилась 4,5 часа. Как было установлено ранее проведенными экспериментами, этого времени достаточно для заполнения каналов в катоде алюминием и образования тонкой пленки алюминия на поверхности катода. В течение этого периода глинозем периодически (каждые 30 минут) добавлялся в ячейку для поддержания его концентрации в электролите близкой к уровню насыщения.
На следующей стадии расчетное количество глинозема было добавлено для формирования суспензии с концентрацией глинозема 35 вес.%. Продолжительность этой стадии была около 2,5 часов. При этом процесс электролиза не прерывался.
Далее в течение приблизительно 48 часов был проведен электролиз полученной суспензии при температуре 750-760°С. Процесс электролиза был довольно стабильным, и в результате было получено 53,8 грамма алюминия. Весь полученный алюминий оказался на дне ячейки под перегородкой, что свидетельствует об эффективной его транспортировке по предусмотренным для этого каналам в катоде. Расчеты показали, что выход по току равен 90,1%, а удельный расход электроэнергии — 12,2 Вт·ч/г.
Похожие патенты RU2274680C2
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭЛЕКТРОЛИЗЕР ДЛЯ ПОЛУЧЕНИЯ МЕТАЛЛОВ ИЗ ОКСИДОВ МЕТАЛЛОВ В РАСПЛАВЛЕННЫХ ЭЛЕКТРОЛИТАХ | 2019 |
| RU2710490C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ ЭЛЕКТРОЛИЗОМ РАСПЛАВА | 2008 |
| RU2415973C2 |
| Способ получения алюминия электролизом суспензии глинозема в расплаве алюминия | 2020 |
| RU2745830C1 |
| СПОСОБ ПРОИЗВОДСТВА АЛЮМИНИЯ ВЫСОКОЙ ЧИСТОТЫ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННЫХ СОЛЕЙ | 2018 |
| RU2702672C1 |
| ЭЛЕКТРОЛИТ ДЛЯ ПОЛУЧЕНИЯ АЛЮМИНИЯ ЭЛЕКТРОЛИЗОМ РАСПЛАВОВ | 2013 |
| RU2567429C1 |
| Способ нанесения защитного покрытия на катоды электролизера для получения алюминия | 2019 |
| RU2716726C1 |
| СПОСОБ ЭЛЕКТРОЛИЗА РАСПЛАВЛЕННЫХ СОЛЕЙ С КИСЛОРОДСОДЕРЖАЩИМИ ДОБАВКАМИ С ИСПОЛЬЗОВАНИЕМ ИНЕРТНОГО АНОДА | 2011 |
| RU2457286C1 |
| СПОСОБ ЭКСПЛУАТАЦИИ ЭЛЕКТРОЛИЗЕРА ДЛЯ ПРОИЗВОДСТВА АЛЮМИНИЯ | 2007 |
| RU2359071C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ | 2013 |
| RU2529264C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЮМИНИЯ ИЗ НЕФЕЛИНОВЫХ СИЕНИТОВ И СЫННЫРИТОВ | 1993 |
| RU2074906C1 |
Иллюстрации к изобретению RU 2 274 680 C2
Реферат патента 2006 года СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛОВ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННЫХ СОЛЕЙ
Изобретение относится к способам получения металлов или сплавов, прежде всего алюминия, электролизом суспензий металлов в расплавленных электролитах, при этом помимо алюминия можно получать магний, литий, натрий, свинец. Способ получения металлов электролизом суспензии оксидов металлов в расплавленных солях включает пропускание электрического тока между катодом и анодом, при этом содержание оксидов металлов в расплавленных солях выбрано в пределах, обеспечивающих эффективное разделение приэлектродных пространств и исключающих конвекцию в зазоре между электродами, и составляет 10-60 мас.%, температуру электролиза поддерживают выше температуры ликвидуса солей, кристаллизующихся на электродах, исключающую солевую пассивацию поверхности электродов и позволяющую использовать высокие плотности тока, дисперсионная среда суспензии оксидов металлов представлена фторидным, фторидно-хлоридным расплавом или хлоридным расплавленным электролитом и выделяемый на катоде металл, в частности алюминий, а на аноде — газ, в частности кислород, отводят по внешней и внутренней поверхности электродов. Изобретение обеспечивает исключение конвекции в зазоре между электродами и повышение эффективности процесса. 2 з.п. ф-лы, 2 ил.
Формула изобретения RU 2 274 680 C2
1. Способ получения металлов электролизом суспензии оксидов металлов в расплавленных солях путем пропускания электрического тока между катодом и анодом, отличающийся тем, что содержание оксидов металлов в расплавленных солях выбрано в пределах, обеспечивающих эффективное разделение приэлектродных пространств и исключающих конвекцию в зазоре между электродами, и составляет 10-60 мас.%, при этом температуру электролиза поддерживают выше температуры ликвидуса солей, кристаллизующихся на электродах, и исключающую солевую пассивацию поверхности электродов и позволяющую высокие плотности тока. 2. Способ получения металлов электролизом по п.1, отличающийся тем, что дисперсионная среда суспензии оксидов металлов представлена фторидным, фторидно-хлоридным расплавом или хлоридным расплавленным электролитом. 3. Способ получения металлов электролизом по п.1, отличающийся тем, что выделяемый на катоде металл, в частности алюминий, а на аноде — газ, в частности кислород, отводят по внешней и внутренней поверхностям электродов.
Источник