- Глава V. Калий
- Калий: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Получение калия: способы, реакция, формулы, виды калия и его химические свойства
- Общая характеристика
- Применение
- Получение металла
- Получение исходных веществ
- Получение производных
- Нитрат калия
- Сульфат калия
- Карбонат калия
- Перманганат калия
- Гидроксид калия
Глава V. Калий
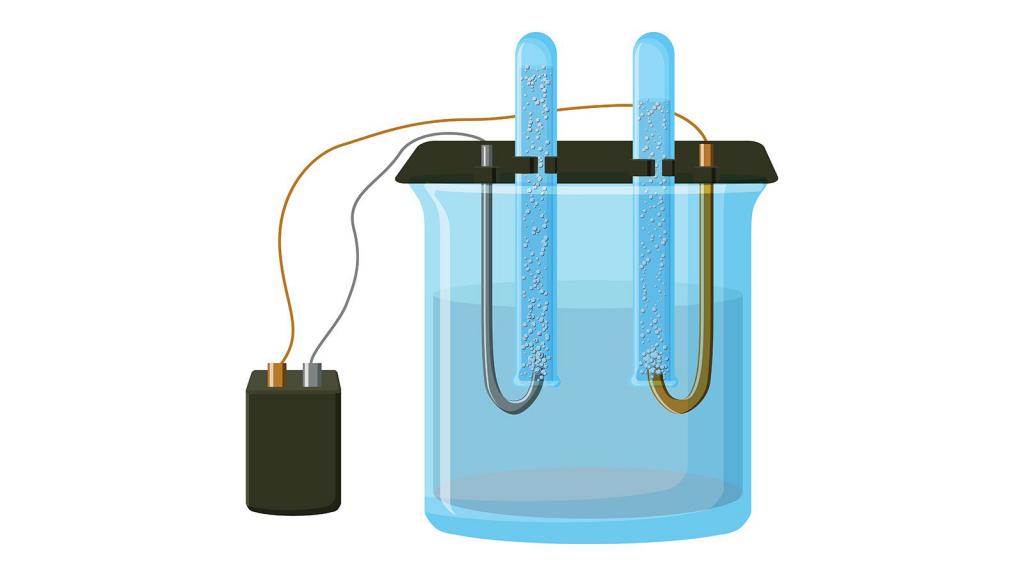
Получение металла. Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. Эти элементы — ровесники. Г. Дэви подвергал влажный кусок гидроксида калия электролизу, и металлический калий заявил о своих индивидуальных свойствах цветом пламени. Маленькие шарики расплавленного металла, появлявшиеся на катоде, при соприкосновении с воздухом загорались, но не желтым, как у натрия, а фиолетовым пламенем. Дэви назвал новый элемент «потассием». Буквально слово «пот-аш» значит «горшок-зола» — зола, получаемая в горшках. Этот термин употреблялся гораздо раньше открытия калия. Золу растений вываривали в горшках для получения щелочи (раствора карбоната калия), и слово «поташ» фигурирует в сочинениях химиков еще в XVI в. Поташ ценили не только как моющее средство, но и как сырье для выделки селитры, а следовательно, и пороха. В России уже при царе Алексее Михайловиче существовали большие заводы Б. И. Морозова, производившие поташ из древесной золы. Название «калий», ставшее общеупотребительным во многих странах, произведено от арабского «ал-кали» — щелочь.
Принципиально для получения калия вполне можно применить электролиз расплавленного хлорида или гидроксида, т. е. получить этот металл по тому же способу, что и натрий. Однако- металлический калий хорошо растворяется в расплавленной массе (расплаве) и к тому же чрезвычайно легко окисляется. Все это создает практические трудности, поэтому калий приходится получать иным методом. На расплавленный гидроксид калия действуют расплавленным металлическим натрием при 450 °С. Реакция протекает при смешивании потоков гидроксида калия и металлического натрия в специальных аппаратах, причем гидроксид стекает сверху вниз, а жидкая масса натрия подается снизу. Нет ничего удивительного в том, что стоимость металлического калия значительно выше стоимости натрия.
Металлический калий можно получить, применяя в качестве восстановителя и не такой дорогой, как натрий, металл — алюминий. Для этих же целей годится и кремний, который не является металлом, но при высоких температурах энергично соединяется с кислородом и обнаруживает свойство сильного восстановителя. Использование таких восстановителей ведет к успеху только при условии присутствия в смеси еще оксида кальция, весь процесс протекает при температуре около 900 °С в бескислородной среде (вакуум-термический способ). Уравнения реакций довольно сложны, например, процесс с участием алюминия выражается таким общим уравнением:
Наряду с калием, образуется хлорид кальция и алюминат кальция. В этом соединении алюминий ведет себя как кислотообразующий элемент (проявляет свойственную ему амфотерность): его оксид с оксидом кальция дает солеобразное соединение. Возможно, что реакция проходит через несколько стадий. Сначала алюминий восстанавливает оксид кальция, затем кальций отнимает хлор от хлорида калия и, наконец, оксид алюминия с избытком оксида кальция образует алюминат кальция.
Состояние в природе. Так же как и натрий, калий не встречается в природе в свободном состоянии, но, так же как и натрий, он широко представлен различными солями, содержащими ион К + . По распространенности соли калия уступают натриевым, но тем не менее встречаются и мощные отложения минералов сильвина КСl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, селитры KNO3 и различных силикатов каинита KCl·MgSO4·6H2O. Особенно много калийных солей в районе Соликамска.
Соликамск — город на западном склоне Урала у реки Камы — издавна был известен как центр соляной промышленности. Основанный в 1430 г., этот город назывался сначала «Соль Камская» и в XVI и XVII вв. был крупным торговым центром. Позже его значение уменьшилось, но в XX в. после Великой Октябрьской революции Соликамск вернул себе прежнюю роль, но уже на иных основаниях.
В 1925 г. в районе Соликамска были открыты богатые залежи калийных солей, в которых остро нуждались сельское хозяйство и промышленность молодой Советской республики. Калийный комбинат, построенный в 1927 г., уже в 1933 г. выдал продукцию. В Соликамске соляная залежь сверху прикрыта слоями известняков, гипсовых пород, глины. Ниже располагаются пласты каменной соли, переслоенные залежами калиевых солей. Калий можно извлечь из морской воды (после удаления магния) с помощью сложного соединения — дипикриламината кальция. Ионы калия образуют в этом случае нерастворимый осадок.
Источник
Калий: способы получения и химические свойства
Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
Способ получения
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Качественная реакция
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет .
Химические свойства
1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия :
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K 0 + 2 H2 O = 2 K + OH + H2 0
2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород :
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода:
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Калий может взаимодействовать с гидроксидами:
Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Источник
Получение калия: способы, реакция, формулы, виды калия и его химические свойства
Калий (К) – это пятый по распространенности в природе металл. Он расположен в 1 группе периодической системы химических элементов (ПСХЭ), поэтому относится к щелочным металлам и при смешивании с водой образует растворимые гидроксиды. В виде простого вещества элемент имеет серебристо-белый цвет, иногда с фиолетовым оттенком. По характеристикам он мягкий и низкоплавкий. Получение калия возможно из его гидрида, гидроксида, хлорида, хромата или дихромата.
Общая характеристика
При превращении калия в пар сине-зеленого цвета он разлагается на атомы К, к которым примешивается небольшое количество молекул К2. Растворить металл можно в жидком аммиаке с получением стандартного темно-синего раствора либо в расплаве едкого кали.
Калий имеет высокую реакционную способность, обладает сильными восстановительными свойствами (его внешняя электронная оболочка находится на большом удалении от ядра, а в таблице электроотрицательности он занимает вторую позицию после цезия), реагирует не только с разбавленными кислотами, неметаллами, нитритом водорода и дигидросульфидом, но и с кислородом воздуха и водой. В последнем случае выделяющийся водород быстро воспламеняется.
Со ртутью элемент превращается в сплав – амальгаму. С натрием, таллием, оловом, свинцом и висмутом у калия образуются интерметаллиды, обладающие высокой твердостью и химической стойкостью. Химическое соединение нескольких металлов плавится при более высокой температуре, чем каждый из образующих его компонентов, но имеет меньшую пластичность по сравнению с ними.
Однако есть вещества, с которыми элемент практически не вступает в реакцию, например, к таким относится азот. Это одна из отличительных особенностей калия от других щелочных металлов, в первую очередь, лития и натрия. Кроме того, он не сплавляется с литием, магнием, цинком, кадмием, алюминием и галлием.
Калий хорошо сохраняется под слоем бензина и керосина. Определить его можно по окрашиванию пламени горелки в фиолетовый цвет.
Применение
Калий играет важную биологическую роль в организме человека и развитии растений. Кроме того, он широко используется в повседневной жизни. Так, в комплексе с азотом и фосфором он является незаменимым удобрением для культурных растений, позволяющим повысить их урожайность, вегетативную массу и устойчивость к вредителям.
Сплав металла с натрием применяется для передачи тепловой энергии в замкнутых системах, а если к этому соединению добавить цезий, получится состав с рекордно низкой температурой плавления (минус 78 градусов Цельсия).
Для того чтобы использовать все эти полезные и важные соединения, нужно знать реакции получения калия из его соединений.
Получение металла
Неорганическое соединение белого цвета, гидрид калия, образуется из расплавленного металла, но оно нестабильно и при температуре в 400 градусов Цельсия в вакууме распадается на составляющие по следующей реакции:
Гидроксид калия образуется из соответствующего хлорида. Он широко применяется в производстве жидких мыл и для получения калия и его соединений. Для этого нужно провести электролиз, то есть пропустить через раствор ток. В результате на аноде образуется кислород, а на катоде калий:
Из хлорида можно получать не только гидроксид, но и металл в чистом виде. Для этого также потребуется реакция электролиза раствора:
В отличие от предыдущего способа получения калия, в этом можно использовать исходное вещество не только в жидком состоянии, но и в виде расплава, но в этом случае происходят две параллельные реакции:
Катод, на котором будет образовываться калий, должен быть ртутным.
Получение исходных веществ
Иногда применяются хромат или дихромат калия. Напрямую металл из них не получить, но можно преобразовать их в гидроксиды или хлориды, которые впоследствии подвергнуть электролизу по приведенным выше реакциям. Получение гидроксида калия из хромата происходит так:
- 2K2CrO4 + 2Н2О + 3Н2S = 2Cr(ОН)3 + 3S + 4КОН.
Чтобы процесс прошел успешно, сера и гидроксид хрома выпали в осадок, нужно брать горячую воду. Подобную реакцию можно также провести с помощью дихромата. Она протекает аналогичным образом, различие наблюдается только в значениях стехиометрических коэффициентов:
При нагревании дихромата до 500 градусов Цельсия гидроксид можно получить другим способом:
Есть и другие способы получения гидроксида. Например, с помощью реакции между поташом и насыщенным раствором гашеной извести.
Для получения хлорида калия из хромата реакции проводятся таким образом:
Соляная кислота берется в разбавленном виде. Получение калия хлора сопровождается выделением дихромата и воды.
Превратить дихромат в хлорид немного более сложно, для этого понадобится этиловый спирт и кипячение:
Получение калия хлора также возможно из поташа при взаимодействии с разбавленной соляной кислотой и из сульфата при реакциях с галогенидом бария.
Гидроксид и хлорид легко преобразуются друг в друга с помощью электролиза или при добавлении соответствующего галогенида.
Получение производных
Получение солей калия играет не менее важную роль, чем образование чистого металла. Несмотря на высокую стоимость, они используются в гальванотехнике, так как обеспечивают интенсивную работу электролитов при повышенной плотности тока. Это достигается за счет высокой растворимости.
Нитрат калия
Большое значение имеет получение нитрата калия (KNO3). Эта белая соль, называемая индийской селитрой, практически не токсична для живых организмов. Применяется и в мирных целях в качестве удобрения, и в военных как компонент взрывчатых и горючих веществ. Кроме того, получение нитрата калия нужно для обесцвечивания и улучшения прочностных характеристик хрустальных стекол, что широко используется в вакуумной электропромышленности и оптическом стекловарении. В металлургии полезны ее окислительные свойства в отношении никелевых и иных руд. А в пищевой промышленности соль выступает в качестве консерванта.
Для получения раствора нитрата калия можно воспользоваться следующими веществами:
- надпероксидом металла при добавлении к нему оксида азота (IV) и нагревании до 70 градусов Цельсия;
- гидроксидом и разбавленной азотной кислотой;
- гидроксидом в холодном состоянии и смесью оксидов азота (II) и (IV);
- горячим гидроксидом, оксидом азота (IV) и кислородом;
- горячим разбавленным нитритом калия и кислородом (реакция требует времени);
- нитритом калия и горячей перекисью водорода в разбавленной серной кислоте в качестве катализатора (кислоту можно заменить бромом, но он вступит в реакцию с образованием бромоводорода).
Полученное соединение плавится без разложения, устойчиво на воздухе, растворяется в воде без гидролиза, обладает сильными окислительными свойствами, восстанавливается только атомным водородом.
Сульфат калия
Соль, известная еще с XIV века, получила название сульфата калия (K2SO4) лишь в XVII. Она присутствует в водах соленых озер и месторождениях неметаллических минеральных ресурсов, но возможно получение сульфата калия в процессе синтеза следующих веществ:
- надпероксида калия и серы при 130-140 градусах Цельсия (вместо серы можно использовать ее оксид (IV), тогда будет достаточно температуры в 100 градусов);
- гидроксида калия и разбавленной серной кислоты;
- гидросульфата калия (разложением при 240 градусах);
- гидросульфата калия и концентрированного каустического поташа или хлорида этого же металла;
- хлорида калия и концентрированной серной кислоты при кипячении;
- сульфида калия и кислорода при температуре выше 500 градусов;
- разложением дисульфата калия при температуре выше 440 градусов и использовании оксида серы (IV) и кислорода в качестве катализаторов.
Другое название получаемого вещества – арканит. Оно имеет белый цвет, устойчиво к температурному воздействию, но легко растворяется в воде без кристаллогидратов. Для него характерно участие в обменных реакциях, восстановление водородом и углеродом.
На практике оно активно используется в сельском хозяйстве как бесхлорное удобрение для бедных калием почв. Особенно важен арканит для культур, чувствительных к хлору или потребляющих много серы. Урожай, выращенный с его применением, содержит большее количество сахара и витаминов, чем тот, который не удобрялся. Также удобрение используют для цветов, выращиваемых и на открытом воздухе, и в тепличных условиях.
Другое применение арканита – компонент при производстве стекла, квасцов, металлургических плавней. Он выступает и в качестве пищевой добавки, но само по себе вещество сложно назвать безопасным: оно раздражает глаза, кожу, желудочно-кишечный тракт, дыхательные пути и приводит к отравлению при длительном контакте с различными частями тела и организма.
Карбонат калия
Поташ или углекислый калий (К2СО3) был известен еще в древности и сохранял важное промышленное значение вплоть до ХХ века. Получение карбоната калия происходило путем выщелачивания из растительной золы и последующей очисткой продукта. В основном производство локализовалось в лесистой местности Европы, России и Северной Америки.
Сейчас известно больше реакций, в результате которых получается карбонат. Обычно используются следующие вещества:
- надпероксид калия и графит при небольшом нагревании до 30 градусов (вместо графита может быть использован угарный газ с нагреванием до 50 градусов);
- концентрированный гидроксид калия и углекислый газ;
- разложение гидрокарбоната калия при температуре от 100 до 400 градусов;
- гидрокарбонат и концентрированный гидроксид калия;
- сульфат калия, гидроксид кальция и угарный газ при температуре 200 градусов и под давлением, с последующим синтезом получившегося продукта К(НСОО) с кислородом при 700 градусах.
Получаемое белое вещество плавится без разложения, в воде сильно гидролизуется по аниону, создает сильнощелочную среду, реагирует с кислотами, неметаллами и их оксидами, а также вступает в реакции обмена.
Вещество малотоксичное и используется для производства жидкого мыла, пигментов, стекла, соединений калия. Применяется в крашении, выращивании сельскохозяйственных культур, проявлении фотографий. Кроме того, является популярной добавкой, уменьшающей температуру замерзания бетона, поглотителем сероводорода, обезвоживающим агентом, пищевой добавкой.
Перманганат калия
Красно-фиолетовая, почти черная марганцовка известна всем, так как ее можно увидеть практически в каждом доме. Хотя в последнее время существуют небольшие ограничения на покупку вещества из-за того, что его признали прекурсором. Получение перманганата калия (KMnO4) возможно несколькими способами, например, взаимодействием сульфата марганца (II) с водой и кислородом из дитионата калия. По прошествии некоторого времени при наличии нитрата серебра в качестве катализатора из этой смеси получится перманганат и сульфат калия, а также серная кислота.
Еще больше способов предполагает использование манганата калия, к нему можно добавлять следующие вещества:
- воду (реакция требует затрат времени);
- разбавленную соляную кислоту;
- углекислый газ;
- хлор.
Кроме того, манганат можно подвергать электролизу с образованием перманганата на аноде (на катоде будет водород).
Применение у получившегося вещества широкое. Благодаря окисляющей способности оно обеспечивает антисептическое действие. В медицине оно применяется для полоскания горла при воспалительных заболеваниях его слизистой, промывания ран, обработки ожогов и инфицированных ран, лечения язв, а также как рвотное средство при отравлениях алкалоидами.
Противопоказанием является гиперчувствительность, но передозировка может привести к летальному исходу даже у здорового человека, смертельная доза для среднего человека составляет всего 20-30 г.
При использовании перманганата нужно соблюдать меры предосторожности, так, вещество воспламеняется при смешивании с органическими и легковоспламеняющимися соединениями, активными металлами и неметаллами. При дополнительном нагревании возможен взрыв.
Гидроксид калия
Помимо солей, большое значение имеет гидроксид калия. Это вещество относится к щелочам, то есть веществам, растворы и расплавы которых могут проводить электрический ток.
Тривиальное название этого соединения — каустический поташ. Выглядит оно как белое гигроскопичное вещество. К его свойствам относятся плавление и кипение без разложения, хорошая растворимость в воде с образованием сильнощелочной среды, нейтрализация кислотами, реакционная способность в отношении металлов и неметаллов, их оксидов и гидроксидов. Из воздуха гидроксид калия активно поглощает воду и углекислый газ.
Как получение калия возможно из щелочи, так и гидроксид можно получить из металла. Для этого требуется лишь добавить к нему воду в чистом виде или в сочетании с кислородом. Кроме того, можно получать щелочь из карбоната и насыщенного гидроксида кальция либо электролизом хлорида. Последний способ активно используется в промышленном производстве.
Вещество опасно, может прижечь кожу или слизистые, разрушает все материалы органического происхождения. Работать с ним можно, только надежно защитив кожные покровы перчатками, а глаза очками.
Несмотря на опасность, щелочь имеет широкое применение в фотографии, нефтепереработке, пищевом, бумажном и металлургическом производстве, а также как щелочной элемент питания, нейтрализатор кислот, катализатор, газоочиститель, регулятор водородного показателя, электролит, компонент моющих средств, буровых растворов, красителей, удобрений, калийных органических и неорганических веществ, пестицидов, фармацевтических препаратов для лечения бородавок, мыла, синтетического каучука.
Таким образом, получение калия и соединений на его основе, в первую очередь, солей и гидроксида, имеет большое значение для промышленности и широкое применение в быту. Главное, помнить о технике безопасности при работе с этим щелочным металлом и осторожно применять материалы, в которых он используется. Благодаря этому можно будет избежать тех его свойств, которые являются опасными.
Источник