- Кислородсодержащие соединения галогенов
- Химия, Биология, подготовка к ГИА и ЕГЭ
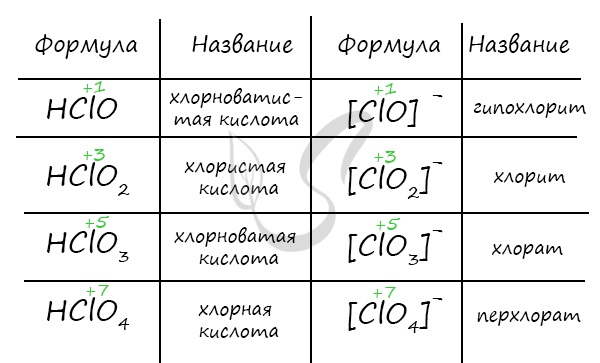
- Кислоты хлора
- 8.1. Кислородные соединения галогенов
- Вы здесь
- Степени окисления галогенов
- Кислородные кислоты хлора
- Хлорноватистая кислота и гипохлориты
- Хлористая кислота и хлориты
- Хлорноватая кислота и ее соли
- Хлорная кислота и перхлораты
- Окислы хлора
- Кислородные кислоты и окислы брома
- Кислородные кислоты и окислы иода
- Окислительная способность кислородных соединений галогенов
Кислородсодержащие соединения галогенов
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее — оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO — бромноватистая кислота (соли гипобромиты), HIO — иодноватистая кислота (соли гипоиодиты).
HIO3 — иодноватая кислота (соли иодаты), HBrO3 — бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Хлористая кислота может быть получена из собственных солей — хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе — хлорная кислота — может быть получена реакцией перхлората калия или натрия с концентрированной серной кислотой.
Химические свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная — к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.
KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кислородсодержащие соединения галогенов
HBrO2 — бромистая кислота, слабая
HClO4 — хлорная кислота, сильная
Бертолетова соль — KClO3
HClO3 — хлорноватая кислота, сильная
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ

Хлор — самый богатый на кислоты элемент!
5 кислот — таким рекордом может похвастаться не каждый!
Хлор — элемент 7-й группы главной подгруппы и к тому же 3-го периода.
Что это означает?
Это означает много степеней окисления! 🙂
- Т.к. элемент находится в 7-й группе, то ему не хватает всего 1 электрона до завершения электронной оболочки — минимальная степень окисления хлора = -1.
- Т.к. хлор находится в 3-ем периоде, то он может распаривать электроны с p-подуровня на d-подуровень — степени окисления +1, +3, +5 и +7.
Кислоты хлора
- HCl — хлороводородная или соляная кислота.
Ей присущи все свойства кислот: взаимодействие с металлами до водорода, взаимодействие с основными оксидами, с основаниями, с солями.
При взаимодействии с окислителями окисляется до Cl2:
2HCl + H2SO4 = SO2 + Cl2↑ + 2H2O
2. HClO — хлорноватистая кислота.
Степень окисления хлора = +1.
Бесцветный раствор. Это очень слабая кислота. Неустойчивая. Небольшая степень диссоциации. Ей соответствует кислотный оксид Cl2O.
Получение:
Сl2 + H2O = HCl + HClO
Cl2O + H2O = 2HClO
НО: это сильная кислота-окислитель: 2HClO + H2S = S + Cl2 + H2O
3. HClO2 — хлористая кислота.
Степень окисления хлора = +3.
Бесцветная. Кислота средней силы. Неустойчивая. Ей соответствует кислотный оксид Cl2O3.
Проявляет окислительные свойства.
4. HClO3 — хлорноватая кислота.
Степень окисления хлора = +5
В свободном виде она не получена, «живет» только в растворах. Сильное вещество как просто кислота, и как кислота-окислитель. Кислотный оксид — Cl2O5.
Сильная кислота — окислитель: HClO3 + S + H2O= H2SO4 + HCl
5. HClO4 — хлорная кислота.
Степень окисления хлора= +7
Одна из самых сильных кислот, одна из самых сильных окислителей.
Взрывоопасна. Бесцветная, летучая, парит на воздухе.
Кислотный оксид — Cl2O7.
Обратите внимание на изменение свойств кислот с изменением степени окисления:
- хлор в минимальной степени окисления дает сильную кислоту, но не окислитель;
- с увеличением степени окисления увеличивается сила кислот и окислительные свойства
Источник
8.1. Кислородные соединения галогенов
Вы здесь
Хлор образует нормальновалентную (положительно одновалентную) окись Сl2O
нормальновалентную кислородсодержащую кислоту НClO
и довольно много трансаргоноидных оксисоединений*.
Окись хлора (дихлормоноксид) Сl2O — желтый газ, образующийся при пропускании хлора над окисью ртути
Газ конденсируется в жидкость примерно при 4°С. Он является ангидридом хлорноватистой кислоты, т. е. при реакции с водой дает хлорноватистую кислоту
Стандартная энтальпия образования Сl2O (г.) равна 24 кДж·моль -1 .
Интересным трансаргоноидным окислом хлора является семиокись хлора (дихлоргептоксид) Сl2O7 — бесцветная жидкость с температурой плавления — 91°С и температурой кипения 82°С; ее можно получить смешиванием Р4О10 с хлорной кислотой НСlO4. Для Сl2O7 можно записать аргоноидную структуру в виде
Эта формула, однако, неудовлетворительна, поскольку предполагает сосредоточение на каждом атоме хлора большого электрического заряда, равного +3. Кроме того, определение структуры данной молекулы методом дифракции электронов позволило установить длину 142 пм для каждой из шести внешних связей Сl—О. Это на 28 пм меньше длины одинарной связи в Сl2O, равной 170 пм, и двух центральных связей в Сl2O7 и заставляет принять для данной молекулы другую трансаргоноидную структуру
В этой структуре каждый атом хлора имеет ковалентность 7, что соответствует номеру группы в периодической системе. При образовании семи ковалентных связей атом хлора может использовать три 3d-орбитали вместе с 3s— и Зр-орбиталями.
Стандартная энтальпия образования Сl2O7 (г.) равна 265 кДж·моль -1 . Этот окисел, представляющий собой жидкость, не очень чувствительное взрывчатое вещество, но тем не менее взрывается при сотрясении или поджигании.
На основании значений энтальпии этих веществ и О (г.) (приложение VI), можно записать уравнение
Отсюда следует, что энергия трансаргоноидной двойной связи Сl=O равна 217 кДж·моль -1 .
Экспериментальные значения других теплот реакций показывают, что величины трансаргоноидной энергии связи Cl=O и в других молекулах почти те же, что и в Сl2O7. Примером может служить окисление ClF до ClO3F:
ClF (г.) + 3O (г.) → ClO3F (г.) +3×239 кДж·моль -1
То, что полученная величина превышает значение для Сl2O7, можно объяснить более ионным характером одинарной связи Сl—F по сравнению со связью Сl—О, а это высвобождает дополнительную часть энергии sp-орбитали.
Степени окисления галогенов
Все галогены, кроме фтора, образуют устойчивые соединения, отвечающие почти всем значениям степени окисления от —1 до +7, как это показано на следующей схеме:
| +7 | HClO4, Cl2O7 | H5IO6 | ||
| +6 | Cl2O6 | |||
| +5 | HClO3 | HBrO3 | HIO3, I2O5 | |
| +4 | ClO2 | BrO2 | IO2 | |
| +3 | HClO2 | |||
| +2 | ||||
| +1 | HOF | HClO, Cl2O | HBrO, Br2O | HIO |
| 0 | F2 | Cl2 | Br2 | I2 |
| -1 | HF, F — | HCl, Cl — | HBr, Br — | HI, I — |
(На схеме не указаны молекулы, обладающие высокой реакционной способностью, которые, подобно ОF и СlO, известны только в разреженной газовой фазе или в виде частиц, захваченных кристаллами или переохлажденной жидкостью.)
Кислородные кислоты хлора
Предшествующее изложение показывает, что нет ничего неожиданного в существовании трансаргоноидных кислородных кислот НСlO2, НСlO3 и НСlO4 наряду с кислотой НСlO (более правильно записываемой как НOCl).
Кислородные кислоты хлора и их анионы имеют следующие названия:
НСlO4 — хлорная СlO4 — — перхлорат-ион
НСlO3—хлорноватая СlO3 — — хлорат-ион
НСlO2 — хлористая СlO 2 — — хлорит-ион
НСlO — хлорноватистая СlO — — гипохлорит-ион
Структура этих четырех анионов показана на рис. 8.1
Их электронные структуры приведены ниже; они находятся в соответствии с принципом электронейтральности, но предполагают использование Зd-орбиталей атомом хлора (исключение составляет хлорноватистая кислота); этим четырем кислотам можно приписать следующие структуры:
Рис. 8.1. Структура ионов четырех кислородных кислот хлора.
Эти кислоты, их соли и окислы хлора рассмотрены в дальнейших разделах в порядке возрастания степени окисления галогена.
Хлорноватистая кислота и гипохлориты
Хлорноватистая кислота НClO и большинство ее солей известны лишь в водных растворах; они разлагаются при концентрировании раствора. Смесь хлорид- и гипохлорит-ионов образуется при пропускании газообразного хлора через раствор гидроокиси натрия:
Сl2 + 2OН — → Сl — + СlO — + Н2O
Раствор гипохлорита натрия NaClO, полученный таким путем или электролизом раствора хлорида натрия, широко применяют в быту как дезинфицирующее и отбеливающее средство. Гипохлорит-ион—активный окислитель; именно благодаря окислительной способности он и оказывает дезинфицирующее и отбеливающее действие.
Хлористая кислота и хлориты
При пропускании двуокиси (диоксида) хлора ClO2 (она будет рассмотрена позже) через раствор гидроокиси натрия или другой щелочи образуются хлорит-и хлорат-ионы
Это реакция самоокисления — самовосстановления (аутоокисления — аутовосстановления): один из атомов хлора, имеющих в двуокиси хлора степень окисления +4, окисляется до степени окисления +5, а второй восстанавливается в то же время до степени окисления +3. Чистый хлорит натрия ЫаСЮг можно получить, пропуская двуокись хлора через раствор перекиси натрия
В этой реакции перекисный кислород служит восстановителем, понижающим степень окисления хлора от +4 до +3.
Хлорит натрия — сильное отбеливающее средство, применяемое в текстильном производстве.
Хлорноватая кислота и ее соли
Хлорноватая кислота НClO3 — нестойкая кислота, которая так же, как и ее соли, является сильным окислителем. Наиболее важная соль хлорноватой кислоты — хлорат калия KClO3, который получают пропусканием избытка хлора через горячий раствор гидроокиси калия или нагреванием раствора, содержащего гипохлорит-ионы и ионы калия
3 ClO — → СlO3 — + 2Сl —
Путем кристаллизации хлорат калия можно отделить от образовавшегося в процессе реакции хлорида калия, так как растворимость хлората при низких температурах значительно меньше растворимости хлорида (3 и 28 г в 100 г воды при 0°С соответственно).
Хлорат калия — кристаллическое белое вещество, применяемое в качестве окислителя при изготовлении спичек и горючих смесей для фейерверков, а также при производстве красок.
Раствор аналогичной соли — хлората натрия NaClO3 — применяют в сельском хозяйстве для борьбы с сорняками. С этой целью можно применять также и хлорат калия, однако натриевые соли дешевле, и по этой причине их шире используют в тех случаях, когда важен только анион. Тем не менее иногда соли натрия не обладают нужными свойствами (они, например, гигроскопичны и поэтому поглощают влагу из воздуха и расплываются); в таких случаях предпочтение отдают солям калия, хотя они и значительно дороже.
Все хлораты в смеси с восстановителями образуют легко взрывающиеся составы; обращаться с ними следует крайне осторожно. Применять хлорат натрия как средство борьбы с сорняками надо с соблюдением мер предосторожности, поскольку горючие материалы, например дерево или одежда, смоченная раствором хлората, после высыхания могут воспламениться от трения. Точно так же весьма опасно измельчать хлорат вместе с серой, древесным углем или другими восстановителями.
Хлорная кислота и перхлораты
Перхлорат калия KClO4 получают нагреванием хлората калия точно до его температуры плавления
Однако в отсутствие катализатора при этой температуре наблюдается лишь незначительное разложение с выделением кислорода. Перхлорат калия образуется также при длительном электролизе раствора хлорида калия, гипохлорита или хлората калия.
Перхлорат калия и другие перхлораты — окислители, но несколько менее энергичные и не столь опасные, как хлораты. Перхлорат калия используют для производства взрывчатых веществ, таких, как порох для базук и других ракет. Этот порох представляет собой смесь перхлората калия, угля и связующих веществ; уравнение основной реакции его горения можно записать в следующем виде:
КСlO4 + 4С → КСl + 4СО
Безводные перхлораты магния Мg(СlO4)2 и бария Ва(СlO4)2 применяют в качестве осушителей. Эти соли очень энергично поглощают воду. Почти все перхлораты хорошо растворимы в воде. Исключением является перхлорат калия, обладающий низкой растворимостью: в 100 г воды при 0°С растворяется только 0,75 г КСlO4. Перхлорат натрия NaСlO4 получают электролитическим методом; его используют для борьбы с сорняками, он менее опасен, чем хлорат натрия. Как правило, смеси перхлоратов с веществами, способными окисляться, менее опасны, чем соответствующие смеси хлоратов.
Хлорная кислота НClO4·Н2O— бесцветная жидкость, образующаяся при перегонке под пониженным давлением раствора перхлората, к которому добавлена серная кислота. Хлорная кислота перегоняется в виде моногидрата и при охлаждении образует кристаллы моногидрата. Эти кристаллы изоморфны кристаллам перхлората аммония NН4СlO4; возможно, что в данном случае образуется вещество, представляющее собой перхлорат гидроксония (Н3O) + (СlO4) — .
Окислы хлора
Помимо окисла хлора Сl2O, о котором говорилось выше, известны и другие окислы: СlO, СlO2, СlO3 (или Сl2O6), Сl2O7 и СlO4 (возможно, Сl2O8).
Характеристические параметры моноокиси (моноксида) хлора СlO получены при анализе полосатых спектров. Длина связи в этом соединении составляет 155 пм, т. е. является промежуточной между длиной одинарной связи 169 пм и длиной двойной связи, равной примерно 142 пм (как в Сl2O7). Энергия связи 269 кДж·моль -1 на 59 кДж·моль -1 больше энергии одинарной связи Сl—О. Эту дополнительную энергию связи приписывают образованию трехэлектронной связи в дополнение к одинарной; электронную структуру записывают в виде
что соответствует резонансу двух структур Сl—O и Cl—О
Двуокись хлора СlO2 является единственным известным соединением хлора, в котором он имеет положительную валентность, равную четырем. Это красновато-желтый газ, легко взрывающийся и легко разлагающийся на хлор и кислород. Реакция разложения протекает очень бурно, и поэтому весьма опасно добавлять серную или любую другую сильную кислоту к хлорату, а также к любой смеси сухих веществ, содержащей хлорат.
Двуокись хлора можно получить осторожным добавлением серной кислоты к хлорату калия КСlO3. Можно предположить, что эта смесь будет реагировать с образованием хлорноватой кислоты HСlO3, а затем благодаря дегидратирующему действию серной кислоты давать ангидрид хлорноватой кислоты Cl2O5
Однако ангидрид хлорноватой кислоты Cl2O5 (дихлорпентоксид) чрезвычайно неустойчив — его существование еще не удалось подтвердить. Если даже он и образуется, то сразу разлагается на двуокись хлора и кислород
Молекула СlO2 имеет угловое строение, причем угол O-Сl-O равен 118°, а длина связей 149 пм. Для этой молекулы принята структура
с попеременным изменением двух видов связей (резонанс). Учитывая, что энергия связи
в СlO равна 269 кДж·моль -1 , а энергия трансаргоноидной связи Сl=O в Cl2O7 равна 216 кДж·моль -1 , можно ожидать, что энтальпия образования СlO2 (г.) из Сl (г.) и 2O (г.) будет равна — 485 кДж·моль -1 ; экспериментальное значение составляет —497 кДж·моль -1 .
Кислородные кислоты и окислы брома
Бром образует только две устойчивые кислородные кислоты — бромноватистую и бромноватую — и их соли:
НВrО — бромноватистая кислота КВrО — гипобромит калия
НВrO3 — бромноватая кислота КВrO3 — бромат калия
Способы их получения и свойства подобны способам получения и свойствам соответствующих соединений хлора. Они обладают несколько меньшей окислительной способностью, чем аналогичные соединения хлора.
Бромит ион ВrO2 — по опубликованным данным существует в растворе. Предпринимавшиеся на протяжении многих лет попытки приготовить бромную кислоту или какой-либо пербромат оказывались безуспешными, и только недавно появилось сообщение о получении бромной кислоты.
Были описаны три крайне неустойчивых окисла брома Вr2O, ВrO2 и Вr3O8. Структура Вr3O8 неизвестна.
Ни одно из кислородных соединений брома не нашло важного практического применения.
Кислородные кислоты и окислы иода
Иод реагирует с ионом гидроксила в холодном щелочном растворе с образованием гипоиодит-иона IO — и иодид-иона
При нагревании раствора реакция идет дальше до образования йодат-иона IO3 —
Таким методом можно получать и соли иодноватистой (НIO) и йодноватой (НIO3) кислот. Йодноватую кислоту НIO3 обычно получают окислением иода концентрированной азотной кислотой
Йодноватая кислота является твердым белым веществом, очень мало растворимым в концентрированной азотной кислоте; вследствие этого ее легко можно выделить в процессе реакции. Главные ее соли — йодат калия КIO3 и йодат натрия NaIO3 — белые кристаллические вещества.
Рис. 8.2. Периодат-ион IO6 5- .
Йодная кислота имеет нормальную формулу Н5IO6 с октаэдрическим расположением атомов кислорода вокруг атома иода, как показано на рис. 8.2. Такое различие в составе этой молекулы и аналогичной молекулы хлорной кислоты НClO4 обусловлено большими размерами атома иода, вокруг которого могут разместиться шесть атомов кислорода вместо четырех. Координационное число иода в йодной кислоте равно, следовательно, 6.
Существует ряд периодатов, отвечающих формуле Н5IO6 для йодной кислоты, и второй ряд, отвечающий формуле НIO4. К первому ряду относятся К2Н3IO6, Аg5IO6 и др. Периодат натрия NaIO4 — соль, относящаяся ко второму ряду; в небольших количествах она содержится в чилийской селитре.
В обеих формах йодной кислоты Н5IO6 и НIO4 (неустойчивая форма, дающая, однако, устойчивые соли) иод находится в одной и той же степени окисления +7. Равновесие между двумя формами этой кислоты определяется реакцией гидратации
Пятиокись (пентоксид) иода I2O5 или йодноватый ангидрид получают в виде белого порошка при медленном нагревании йодноватой или йодной кислоты
По-видимому, ангидрид йодной кислоты I2O7 неустойчив; сообщений о его получении не было.
Низший окисел иода IO2 можно получить обработкой солей йодноватой кислоты (йодатов) концентрированной серной кислотой с последующим добавлением воды. Этот окисел представляет собой желтое твердое вещество, обладающее парамагнитными свойствами.
Окислительная способность кислородных соединений галогенов
Фтор в элементарном состоянии F2 способен окислять все ионы галогенов до свободных галогенов; при этом протекают реакции типа
Фтор — самый электроотрицательный элемент, и поэтому он способен отнимать электроны от анионов всех элементов. Точно так же хлор способен окислять бромид- и иодид-ионы, а бром может окислять иодид-ион
Таким образом, галогены в элементарном состоянии по окислительной активности можно расположить в ряд: F2>Cl2>Br2>I2.
На первый взгляд наблюдается аномалия в реакциях с участием свободных галогенов и их кислородных соединений. Так, хотя хлор способен освобождать иод из иодид-иона, но иод может выделить хлор из хлорат-иона по реакции
Следует отметить, однако, что в этой реакции элементарный иод действует как восстановитель, а не как окислитель. В результате этой реакции степень окисления иода увеличивается от 0 до +5, а степень окисления хлора понижается от +5 до 0. Следовательно, преимущественное направление реакции именно то, которое и можно было предвидеть на основании шкалы электроотрицательности; иод — самый тяжелый галоген и наименее электроотрицательный элемент — стремится получить высокую положительную степень окисления, тогда как хлор стремится иметь низкую степень окисления. (Следует учесть, что в этом случае так же, как почти во всех химических реакциях, можно рассматривать химическое равновесие. Предшествующие утверждения следует истолковать таким образом, что при равновесии в данной системе присутствует больше иодат-ионов и свободного хлора, чем хлорат-ионов и свободного иода.)
Аналогичным образом гипохлорит-ион СlO — может окислить бром до гипобромит-иона, а гипобромит-ион может окислить иод до гипоиодит-иона. Однако такая закономерность не соблюдается в случае более высоких степеней окисления брома: НВrO2, НВrO3 и НВrO4 значительно менее устойчивы, чем аналогичные соединения хлора и иода« Это свойство брома не получило удовлетворительного объяснения. Селен и мышьяк в их высших степенях окисления проявляют в известной мере подобные отклонения в свойствах по отношению к более легким и более тяжелым элементам своей группы.
* Примечание редактора относительно номенклатуры кислородных соединений неметаллических элементов см. стр. 229 — Прим. ред. нормальновалентную кислородсодержащую кислоту НСЮ
Источник