Изопропанол
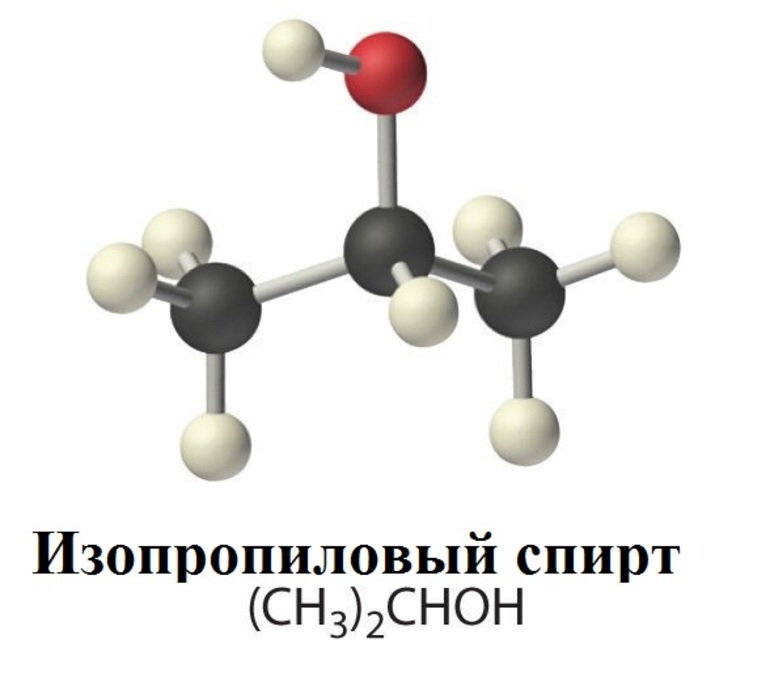
Изопропанол (Изопропиловый спирт, пропанол-2, втор-пропанол, диметилкарбинол, ИПС, C H 3 C H ( O H ) C H 3
Физические свойства
При нормальных условиях изопропанол — прозрачная, бесцветная жидкость с резким характерным запахом и мягким горьким вкусом, типичным для спиртов с короткой углеводородной цепью. Хорошо растворяет многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. Растворяет некоторые виды пластмасс и резины.
Показатель преломления nD = 1,3776 при 20 °C. Динамическая вязкость при стандартных условиях 2,43 мПа·с — немного более вязкий, чем вода. Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К). Удельная теплота сгорания 34,1 МДж/кг.
Смеси паров изопропанола с воздухом образуют взрывчатые смеси. Давление насыщенного пара при 20 °C — 4,4 кПа. Относительная плотность пара по воздуху — 2,1, относительная плотность смеси насыщенный пар/воздух — 1,05 при 20 °C.
Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях.
С водой образует азеотропную смесь 87,9%-го изопропилового спирта с температурой кипения 80,2 °C.
Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице, при замерзании концентрированных растворов наблюдается переохлаждение:
Химические свойства
Изопропанол обладает всеми свойствами вторичных спиртов жирного ряда, образует простые и сложные эфиры, с щелочными металлами образует алкоголяты. Гидроксильная группа способна замещаться на атом галогена. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол.
При дегидрировании, например ферментом алкогольдегидрогеназой в организме млекопитающего, превращается в ацетон. Реагирует с сильными окислителями, образуя ацетон.
Получение
Изопропанол получают методами гидрирования ацетона и гидратации пропилена.
Основным способом получения изопропанола в российской промышленности является сернокислотная гидратация пропилена:
C H 3 C H = C H 2 + H 2 O → H 2 S O 4 ( C H 3 ) 2 C H O H
Сырьем может служить, в том числе кроме пропилена, пропан-пропиленовая фракция с содержанием пропилена 30—90 % (фракция получаемая при пиролизе и крекинге нефти). Сейчас начинают чаще использовать чистый пропилен, так как в этом случае процесс можно вести при невысоких давлениях, при этом существенно снижается образование побочных продуктов реакции — полимеров и ацетона.
На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата (CH3)2CHOSO2OH, серной кислоты и воды. На второй стадии процесса сернокислотный экстракт нагревается с водой, и отгоняется образующийся изопропиловый спирт.
Прямую гидратацию пропилена осуществляют в основном в присутствии катализатора: ортофосфорной кислоты на твёрдом неорганическом носителе при 240—260°С и 2,5—6,5 МПа или на носителе из катионообменной смолы при 130—160°С и 8,0—10,0 МПа.
Изопропиловый спирт получают также окислением алканов воздухом, а также и другими способами.
Современный способ гидрирования ацетона водородом:
C H 3 C O C H 3 + H 2 → k a t C H 3 C H ( O H ) C H 3
Гидрирование ацетона в паровой фазе в присутствии твёрдого медно-никельхромитного катализатора.
Применение
Изопропиловый спирт используется в качестве заменителя этилового спирта в медицине (в последнее время очень активно, так как не уступает по антисептической активности этанолу), в косметике, парфюмерии, бытовой химии, жидкостей для автомобилей (стеклоомывающих в основном, а также антифризов), медицинских целях, в средствах для очистки стёкол, оргтехники и как растворитель органических веществ промышленности.
В развитых странах изопропанол широко используется в товарах личной гигиены и в медицине благодаря своей относительно низкой токсичности.
75%-й водный раствор изопропанола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь клеточные мембраны бактерий, таким образом обеспечивая более высокую эффективность и лучшее обеззараживание.
Изопропиловый спирт также используется в медицине в качестве вспомогательного компонента профилактического средства от наружного отита.
Эффективен при лечении дерматита протиранием пораженных участков кожи, с малым вредным влиянием на кожу.
Изопропиловый спирт также используют как исходное сырье для синтеза:
- ацетона (дегидрированием или неполным окислением)
- пероксида водорода
- метилизобутилкетона
- изопропилацетата
- изопропиламина.
По причине особого государственного регулирования этанола изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
- косметики
- парфюмерии
- бытовой химии
- дезинфицирующих средств
- средства для автомобилей (антифриз, растворитель в зимних стеклоомывателях)
- репеллентов
- промывок печатных плат после пайки с флюсом, продается под названием «Очиститель универсальный».
Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители). Часто используется при сварке оптических волокон для очистки волокна перед скалыванием. Также используется при обслуживании оргтехники, в частности для очистки поверхностей фотобарабанов лазерных принтеров.
Применялся как компонент бинарного химического оружия для получения зарина.
Медицина
70%-й изопропиловый спирт применяется вместо этилового спирта в качестве антисептика для пропитки медицинских салфеток.
Влияние на человека
В больших количествах изопропиловый спирт ядовит (считается, что в 6 раз более этанола), требует осторожного обращения.
Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населенных мест — 0,6 мг/м³ (ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает.
Изопропиловый спирт значительно менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству изопропиловый спирт заменяет этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях.
Как и все летучие спирты, огнеопасен. Изопропанол горюч. При горении даёт яркое пламя, полностью разлагается на простые составляющие — воду и углекислый газ. При горении с достаточным избытком воздуха изопропанол не выделяет вредных веществ, копоти и пр.
Испарение изопропанола из емкости в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций у людей.
Отравления изопропанолом случайны и в основном происходят с детьми младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко.
Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах примерно 50 мл и более. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие.
При приеме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие также выше, но уже в 10 раз. По этой причине смертельные отравления изопропанолом, в сравнении с отравлениями от этилового спирта, случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола, если только не выпил единовременно от 500 мл.
Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов.
Наркотические свойства
Изопропиловый спирт обладает наркотическим действием, наркотический эффект от приёма изопропанола почти в 2 раза превышает аналогичный эффект этанола. Концентрация 12 промилле в организме человека, воздействующая в течение 4 часов, вызывает состояние глубокого наркоза и смерть.
При длительном воздействии больших концентраций паров в воздухе вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта человеку потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива изопропанола. Может оказывать угнетающее действие на центральную нервную систему. Длительное вдыхание воздуха с концентрацией, значительно превышающей ПДК, может вызвать потерю сознания. Тяжёлое отравление изопропиловым спиртом происходит редко. Однако благодаря резкому запаху разливы изопропанола легко обнаружимы. Поэтому, почувствовав запах, следует включить вытяжную вентиляцию и покинуть помещение.
Источник
Изопропиловый спирт — структурная формула, свойства и применение
Краткое описание
В сфере народного хозяйства большой спрос получил изопропиловый спирт (общая формула — CH3CH (OH)CH3 или C3H8OH). Это органическое соединение было получено в результате проведения лабораторных опытов над пропанолом. Оба вещества относятся к категории простейших спиртов алифатического ряда, из-за чего их свойства имеют много совпадений. В Википедии указано, что CH3CH (OH)CH3 имеет сразу несколько названий:
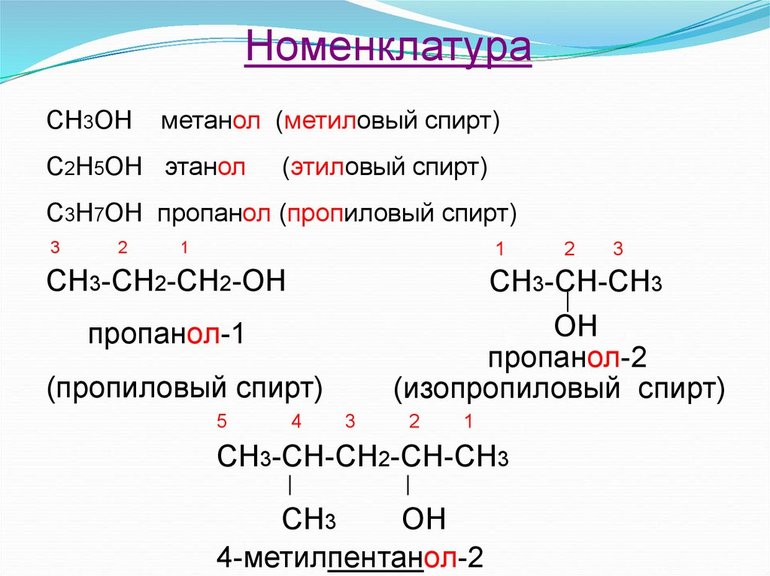
- пропанол-2 (структурная формула — C3H8O) либо втор-пропанол. Этот элемент получил своё название из-за присоединения гидроксильной группы ко второму углероду молекулы пропана (С3Н8);
- изопропилэтаноат;
- изопропен, изопропилен;
- изобутиловый, изопентиловый спирт;
- диизопропил;
- изопропилпентан;
- изопропанол — эта жидкость по принципу строения является изомером обычного пропанола.
- изопропилпропионат;
- диметилкарбинол.
В быту под любым из этих названий можно встретить C3H8OH. Это органическое соединение быстро сгорает и не образует копоти, дыма. В результате этого получается углекислый газ и вода. Изопропен обладает меньшей токсичностью, нежели метанол. За счёт этого C3H8OH получил спрос в косметологии. Эту жидкость добавляют в состав некоторых лекарственных препаратов наружного применения.
CH3CH (OH)CH3 помогает растворить эфирные масла, смолы, а также другие химические соединения. Изопропиловый спирт хорошо смешивается с Н2О. Благодаря химической реакции это вещество может быть преобразовано в ацетон. Если человек употребит изопропилпентан, то он опьянеет. Но токсичное воздействие будет выше, чем у этанола. Реакция организма на химическое вещество зависит от индивидуальных показателей и объёма выпитой жидкости. Изопропанол отличается низким показателем плотности. При температуре +80 °C органическое соединение закипает. Если попробовать нагреть жидкость до +450 °C, то в итоге она самовоспламенится.
Изопропилпентан активно используют в качестве надёжного консерванта органических веществ и для хранения медицинских анализов. Для этих целей можно задействовать формальдегид, но он является более опасным. Изопропанол часто используют для исследования ДНК. Молекула дезоксирибонуклеиновой кислоты не растворяется в этом спирте. В лабораторных условиях изопропен добавляется в заранее подготовленную ДНК, для того чтобы выполнить преципитирование.
Способы получения
В промышленной отрасли CH3CH (OH)CH3 можно получить несколькими методами. Это соединение является востребованным в народном хозяйстве. Изопропиловый спирт содержится не только в бытовой химии, но и в различных косметических средствах. Сегодня производством изопропилпентана занимается химическая промышленность.
Чаще всего для получения C3H8OH проводится гидрирование ацетона. Для этого берут не только С3Н6О, но и водород, а для ускорения химической реакции используют специальные элементы. Среди основных способов получения изопропилпропионата можно выделить:
- Гидратация пропилена, который является горючим газом. Химическая реакция состоит из двух этапов. Первым делом пропилен смешивают с серной кислотой, чтобы получить промежуточные продукты. На втором этапе под воздействием высокой температуры и Н2О производят конечное вещество — C3H8OH.
- Получить изопропен можно в результате окисления парафина воздухом. Этот вариант используется в лабораторных условиях реже всего, так как он недостаточно эффективен.
В промышленной отрасли можно выделить 2 вида CH3CH (OH)CH3 — абсолютированный и технический. В первом случае речь касается хорошо очищенной жидкости, в составе которой содержится минимальное количество различных примесей.
Химические свойства
Изопропилпропионат хорошо растворяется в эфирах и хлороформах, воде, а также в жидкостях, которые содержат в своём составе спирт. C3H8OH не вступает в химическую реакцию с соляными растворами. При правильном применении изопропен помогает быстро растворить этилцеллюлозу, материалы из резины, масла. Изопропиловый спирт можно выделить из водного раствора, добавив немного поваренной соли, что и является ключевым отличием от метанола и этанола.
Изопропанол обладает всеми свойствами вторичных спиртов, образует сложные и простые эфиры. Представителями ряда галогенов может быть вытеснена гидроксильная группа. В сочетании с ароматическими соединениями изопропен конденсируется с последующим образованием производных, например изопропилтолуол, изопропилбензол. В изопропаноле хорошо растворяются алкалоиды, эфирные масла.
При дегидрировании органическое соединение превращается в ацетон. C3H8OH реагирует с сильными окислителями, агрессивен в отношении некоторых разновидностей пластика. Часто изопропанол путают с изопропилхлоридом, который образуется из пропилена и хлороводорода, но это разные химические вещества. В лабораторных условиях используют пентиловый эфир (HCOO (CH2)4CH3), а также диизопропилкарбинол, чтобы получить нужную реакцию.
Физические характеристики
Изопропанол относится к категории вторичных спиртов алифатического ряда. Это химическое вещество может образовывать разные эфиры, которые вступают в реакцию с активными металлами. В процессе конденсации с различными ароматическими соединениями можно получить производные, например изопропилбензол. Эта жидкость смешивается в любых пропорциях с Н2О и органическими растворами, а также может растворяться в ацетоне и бензоле. Физические свойства этого химического соединения повлияли на его применение в промышленности.
В лабораторных условиях было доказано, что изопропанол способен растворить некоторые синтетические и натуральные смолы, масла (поливинил бутират, этилцеллюлоза). Изопропилпропионат не рекомендуется использовать для работы с пластиком и резиной. При контакте с Н2О образуется азеотропная смесь, которая на 88% состоит из пропанола-2. C3H8OH не вступает в химические реакции с растворами солей. Молекулярная (молярная) масса — 60.09 г/моль.
На уроках химии в 10 классе можно узнать, что изопропиловый спирт представляет собой бесцветную жидкость, которая имеет резкий запах. Температура замерзания элемента находится в пределах -89.5 °C. Пары изопропилпропионата быстро смешиваются с кислородом, из-за чего может быть образована специфическая взрывоопасная смесь. Использовать C3H8OH рекомендуется в хорошо проветриваемом помещении, подальше от открытого огня и нагревательных приборов.
Пропанол-2 токсичен при пероральном употреблении и вдыхании паров. Химическое вещество может вызывать раздражение кожи и отравление. В единичных случаях не исключён летальный исход. Пары изопропилпропионата обладают наркотическим воздействием.
Уровень токсичности
Если изопропилпропионат используется в помещении, нужно задействовать средства индивидуальной защиты. Дополнительно должна присутствовать качественная вентиляционная система, которая сможет очистить комнату от большого количества газообразного продукта. Человек может отравиться, если он продолжительное время будет вдыхать концентрированные пары органического соединения или выпьет раствор пропанол-2.
Для наркотического поражения организма свойственны следующие признаки:
- интоксикация всех внутренних органов;
- возникновение острой головной боли, рвоты, тошноты;
- диарея.
Уровень негативного воздействия на организм можно снизить только в том случае, если сразу обратиться за квалифицированной медицинской помощью. Если после употребления C3H8OH человек потерял сознание, нужно вызвать скорую помощь. Причина внезапно ухудшения самочувствия может быть связана с существенным снижением артериального давления.
Сферы использования
Изопропиловый спирт получил большой спрос в разных сферах промышленности. Благодаря физическим и химическим характеристикам C3H8OH используется для производства следующей продукции:
- смолы;
- косметические товары, парфюмерия;
- автомобильный антифриз;
- ацетон;
- различные лекарственные препараты наружного применения;
- лакокрасочные товары;
- средства для увлажнения печатной продукции;
- авиационное топливо;
- товары для очистки электронных деталей.
Использование C3H8OH в пищевой промышленности недопустимо. Это органическое соединение относится к категории малотоксичных средств, но интоксикация не исключена.
Допустимо только местное использование изопропилпропионата в медицинской практике. Изопентиловый спирт отличается дезинфицирующими свойствами, благодаря чему его применяют в следующих целях:
- пропитка медицинских салфеток;
- обработка кожи перед введением инъекций;
- лечение наружного отита — небольшое количество CH3CH (OH)CH3 наносят на ватный тампон и помещают его в ухо.
Пероральное употребление C3H8OH категорически запрещено. Для человека является токсичным даже самый качественный изопропанол, который прошёл несколько этапов очистки. Опасность этого вещества связана с наличием примесей, которые негативно влияют на работу внутренних органов.
Источник