- Виды природных и искусственных газов
- Синтез-газ
- Определение
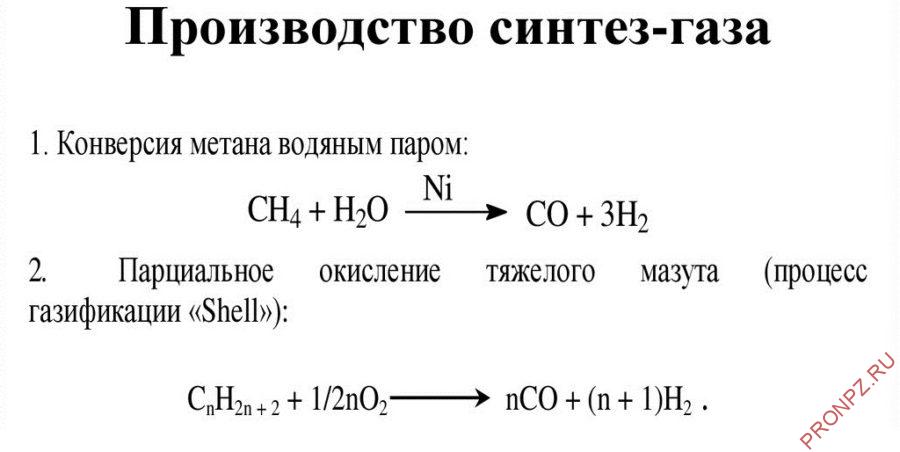
- Получение
- Конверсия метана с паром
- Парциальное окисление метана
- Транспортировка
- Применение
- Получение аммиака
- Получение метанола
- Синтез Фишера-Тропша
- История искусственных горючих газов
- Искусственные газы
- Светильный газ
- Древесный газ
- Нефтяной газ
- Водяной газ (или коксовый газ)
- Воздушный газ
- Блаугаз
- Искусственные газы
- Искусственные газы
Виды природных и искусственных газов
Виды природных и искусственных газов.
Все виды газового топлива по способу получения подразделяются на природные и искусственные: к первой группе относятся газы природных месторождений и попутные газы газонефтяных месторождений, ко второй — коксовый, сланцевый и другие газы, получаемые путем термической переработки твердых топлив, а также газы, получаемые при переработке нефти.
Газовое топливо представляет собой смесь горючих и негорючих газов. Горючими являются метан, пропан, бутан, этан, водород и окись углерода; негорючими — азот, углекислый газ и кислород, а также некоторое количество примесей как горючих, так и негорючих веществ, количество которых лимитируется ГОСТ 5542—78.
Природные газы чисто газовых месторождений состоят в основном из метана (СН4), относятся к категории сухих (тощих) газов и характеризуются относительным постоянством состава, в то время как состав газов газонефтяных месторождений непостоянен и зависит от природы нефти, величины газового фактора и условий разделения нефтегазовых смесей.
Попутные газы из газовых шапок нефтяной залежи, как правило, содержат меньше тяжелых углеводородных газов, чем газы, получаемые из месторождений нефти, в которой они были растворены.
Все виды газового топлива подразделяют на природные и искусственные.
К природным относят газы природных месторождений и попутные газы газонефтяных месторождений — метан, пропан, бутан. Газовое топливо представляет собой смесь горючих (метан, этан, пропан, бутан, этилен, водород, оксид углерода и др.) и негорючих (азот, углекислый газ, кислород) газов. В некоторых видах топлива содержится горючая, но вредная примесь — сероводород. Природный газ, добываемый из недр земли, не имеет вкуса, цвета и запаха. Для придания запаха с целью распознавания его в воздухе в случае утечки используется одоризация — внесение в газ пахнущего вещества (этил меркаптан). Одоризация позволяет обнаружить газ при концентрации его в воздухе 1 %, что составляет 1/5 нижнего предела взрываемости. Важнейшей теплотехнической характеристикой природного газа является теплота сгорания — количество теплоты, выделяющееся при сгорании 1 м3 сухого газа и зависящее от того, в каком агрегатном состоянии находится в продуктах горения вода, выделяющаяся из топлива и образующаяся при сгорании водорода и углеводородов, — в парообразном или жидком. Если в продуктах горения все водяные пары конденсируются и образуют жидкую фазу, то теплота сгорания называется высшей. Если же конденсации водяного пара не происходит, то теплоту сгорания называют низшей.
К искусственным относят коксовый, сланцевый, доменный и другие газы, получаемые путем переработки твердых топлив, нефти, а также выделяющиеся при технологических процессах на химических, металлургических и других предприятиях.
В котельных установках в качестве газообразного могут быть использованы следующие газы:
1) природный газ;
2) доменный газ – отход металлургического производства;
3) коксовый газ – для отопления котлов используется очень редко (идет на металлургических заводах чаще всего на мартены).
Все газы, кроме природного, занимают незначительную долю в газообразном топливе электростанций.
Источник
Синтез-газ
Определение
Понятие «синтез-газ» применяют к разным смесям монооксида углерода (СО) и водорода (Н2), которые используются для получения некоторых нефтехимических продуктов. Его в основном получают из природного газа (метана). Действительно, важнейшие вещества — аммиак, метанол и парафиновые углеводороды — получают именно из синтез-газа.
Получение
Существуют два основных метода получения синтез-газа – конверсия метана с водяным паром и парциальное (частичное) окисление. Оба метода довольно просты.
Конверсия метана с паром
Конверсия с паром состоит в пропускании метана или нафты и водяного пара над никелевым катализатором. Реакция протекает за счет разрушительной силы высоких температур и давлений, и ее следует проводить в реакторах, аналогичных печам крекинга. При этом происходят побочные процессы, при водящие к образованию СО2 и углерода. Углерод откладывается на катализаторе и дезактивирует его.
Парциальное окисление метана
Другой метод — это парциальное (частичное) окисление метана. Процесс проводят при высоких температурах без катализатора. Метод парциального окисления обычно используют для превращения более тяжелых видов сырья — от нафты до остаточного топлива — в тех случаях, когда в распоряжении нет природного газа и легких углеводородов (этана, пропана и бутана). В обоих процессах выход суммы СО и Н2 составляет 90 – 95%.
В качестве побочного продукта получают СО2, который можно удалить либо экстракцией растворителем, либо можно ввести в реакцию с водяным паром дополнительное количество метана, что даст СО и Н2. Эта реакция протекает при высоких температурах и давлениях и в присутствии никелевого катализатора.
Транспортировка
Обычно установка по производству синтез-газа бывает интегрирована в структуру завода, на котором он перерабатывается.
Единственным приемлемым способом транспортировки синтез-газа является его транспортировка по трубопроводам.
Применение
Получение аммиака
Наиболее важной областью применения синтез-газа является производство аммиака – NH3.
Смесь азота и водорода пропускают над железным катализатором (который содержит оксид алюминия в качестве промотора). Реакция проходит в очень жестких условиях — при температуре 420 С и давлении 280 атм.
Большая часть установок по производству аммиака снабжена оборудованием для отделения СО от сырья, так как СО может отравлять катализатор. Чаще всего с этой целью СО обрабатывают водяным паром для получения СО и Н2. Диоксид углерода удаляют экстракцией этаноламином, а Н2 направляют на рециркуляцию.
Получение метанола
Метанол часто называют древесным спиртом. Это связано с тем, что первым промышленным способом получения метанола была сухая перегонка свежеспиленной древесины лиственных деревьев. Помимо других соединений в летучей фракции присутствует метанол. Отсюда и произошло название «древесный спирт».
С 1923 г. метанол производится в промышленности из синтез-газа; в настоящее время большую часть метанола получают именно таким методом. По нескольким причинам эти установки обычно строят вблизи установок для производства аммиака или даже объединяют с ними.
Технология и оборудование аналогичны, и в производстве метанола можно использовать СО2, образующийся при синтезе аммиака. В этом случае СО2 вводят в реакцию с метаном и водяным паром над никелевым катализатором, приводящую к образованию дополнительного количества СО и Н2, которые затем взаимодействуют, давая метанол.
Процесс проводят при давлении 67 – 100 атм. И температуре 200 – 260оС на катализаторах на основе оксидов меди и цинка.
Синтез Фишера-Тропша
Каталитическое гидрирование оксида углерода (синтез Фишера-Тропша) для получения углеводородов, в частности парафинов, в основном нормального строения и олефинов, является гетерогенной реакцией. Проводится она преимущественно над кобальтовыми или над железными катализаторами с использованием возможно более чистых смесей оксида углерода и водорода. Оптимальные рабочие температуры синтеза различны для различных катализаторов.
Никелевые и кобальтовые катализаторы дают оптимальные результаты при 170-205, железные — при 200-325°С. Синтез на никелевых катализаторах ведется практически только при нормальном давлении, так как при повышенном давлении резко усиливается образование карбонилов.
На железном и кобальтовом катализаторах можно работать без образования карбонилов при давлениях до 20 атм.
Считается, что при синтезе по Фишеру-Тропшу на железных катализаторах оксид углерода гидрируется с образование метиленовой группа, которая затем полимеризуется. Оксид углерода конвертируется в углекислоту. При этом кислород оксида углерода связывается, образуя воду. Этим реакциям благоприятствуют более высокая температура синтеза на железных катализаторах и активность железа по отношению к реакции конверсии.
С технической точки зрения решающее значение при синтезе Фишера-Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования оксида углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза. В противном случае значительно возрастает нежелательное образование метана. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации.
Источник
История искусственных горючих газов
18 Марта 2021 г.
История газовой промышленности начиналась не с использования природного газа, а с синтеза искусственного. Искусственный газ применяли как для освещения, так и для обогрева.
Искусственные газы
Искусственные горючие газы — смесь газообразных продуктов переработки (газификации) топлива в специальных аппаратах. В их состав входят метан, оксид углерода, водорода и другие газообразные углеводороды, а также негорючие диоксид углерода и азота.
В зависимости от способа их назначения, получения и исходного топлива различают: светильный, топливный; генераторный, доменный, коксовый; водяной, каменноугольный, нефтяной, древесный и т.д.
Искусственные газы получают при коксовании угля (коксовый газ), нефтепереработке, выплавке металлов (доменный газ), газификации твердых топлив (генераторный газ).
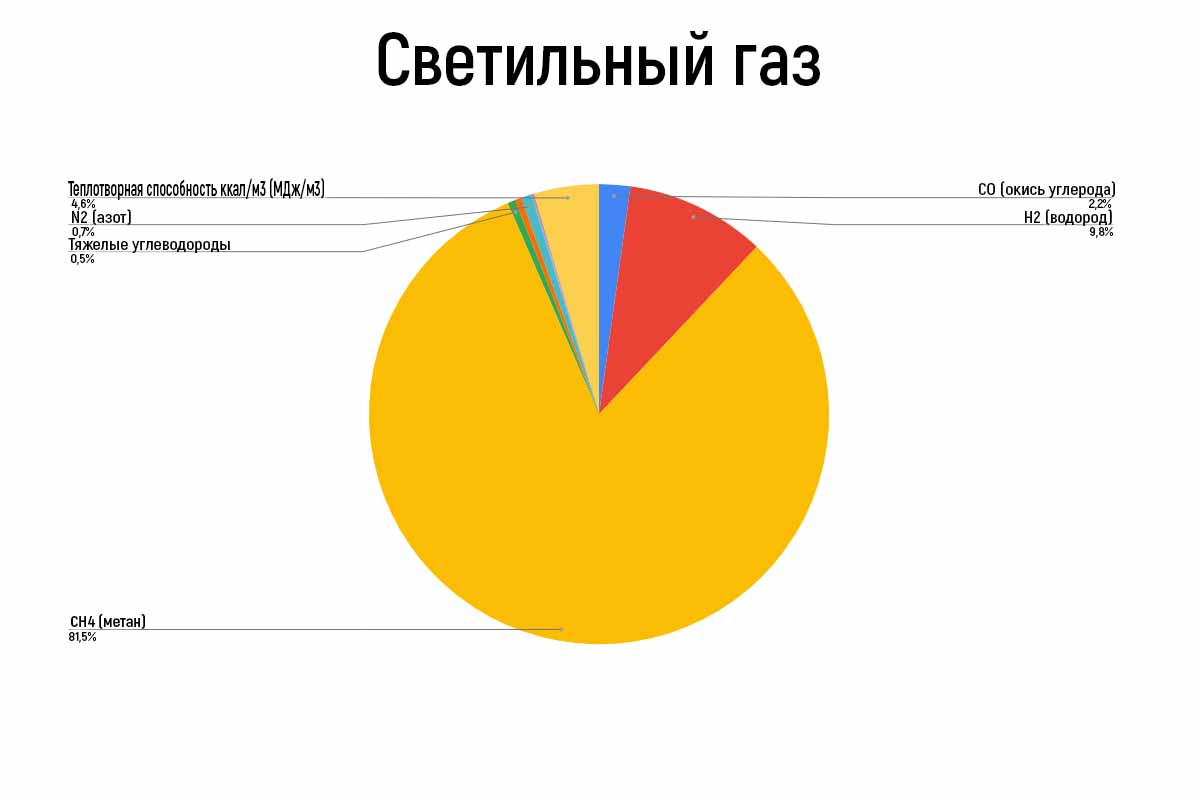 |
| Состав светильного газа |
Светильный газ
В 1798 году был открыт каменноугольный светильный газ. Авторами открытия стали Филипп Леблон (Париж) и Вильям Мердок (Англия). Поразительно в этом открытие и то, что оно было совершенно одновременно и независимо друг от друга.
Такое необычное название “светильный газ” было получено благодаря своему первому применению — освещению. Со временем светильный газ начали использовать и в других областях.
Такой газ добывали из углей определенного сорта, из 1 пуда которых получалось 160-180 фут 3 или 0,28-0,30м 3 /кг и кокс 65-70%. Помимо этого этого в процессе карбонизации образуется смола (5%) и аммиачная вода (8%).
Выгодность получения газа таким образом зависит не только от свойств газа, но и от получаемых попутно продуктов. Но все же в 19 веке под светильным газом понимали каменноугольный газ.
Древесный газ
Древесный газ получается путем сухой перегонки дерева. Разницы в породе дерева не существует: везде получится один и тот же объем газа (100 кг дров = 40 м 3 газа, 30 кг угля, 45 кг древесного уксуса, 5 кг смолы).
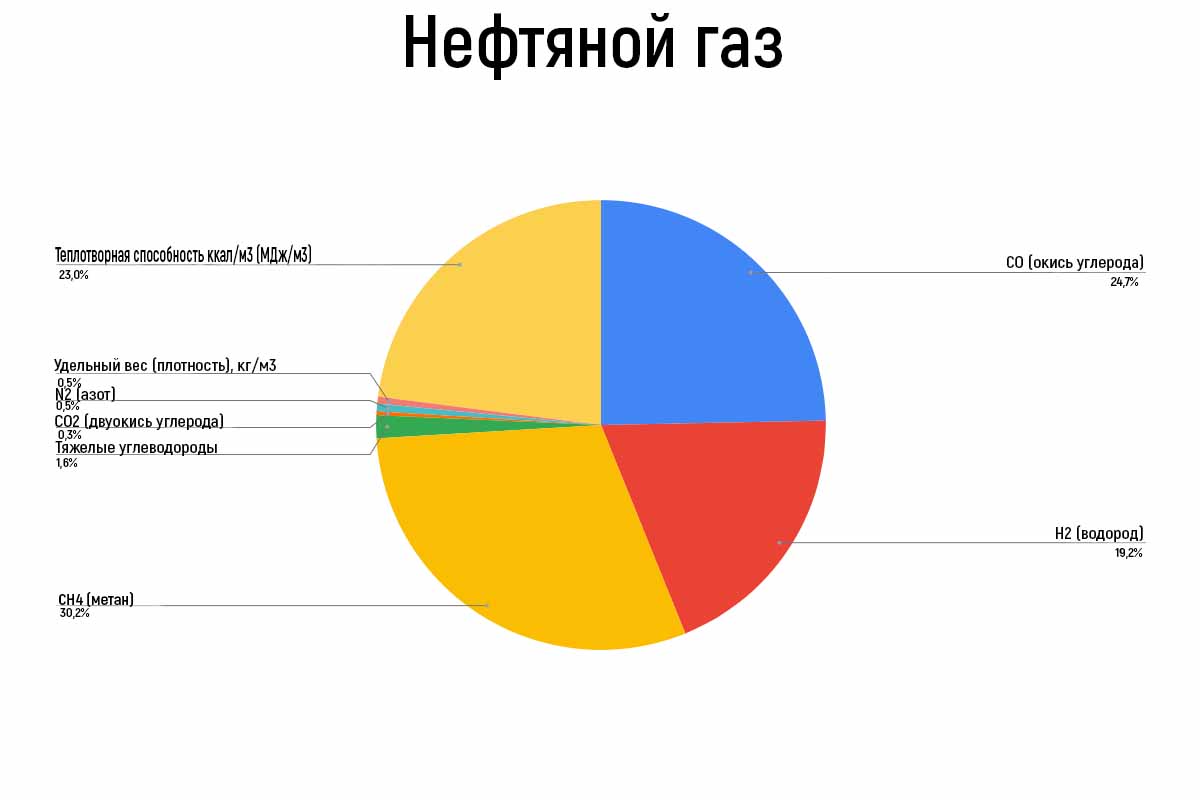 |
| Состав нефтяного газа |
Древесный газ будет иметь примерно на 20% больше световой силы, чем из угля.
Нефтяной газ
Нефтяной газ добывают в процессе разложения нефти под действием высокой температуры. Количество получаемого газа из нефти гораздо больше, чем из угля.
Сам газ содержит меньше вредных примесей, а световые, теплотворные и силовые параметры гораздо лучше. Сырьем для такого газа служит мазут (нефтяной остаток), нефть и солярный дистиллятор. Из 100 кг нефти примерно получается около 60 м 3 нефтяного газа, 25-30 кг газовой смолы, 4-5 кг кокса. Этот газ бесцветен и имеет резкий запах.
Газ нефтяной применялся достаточно широко:
- для освещения крупных объектов: заводов, лабораторий;
- в сжатом состоянии для освещения маяков, вагонов и даже для автогенной сварки;
- иногда для усиления света от светильного газа его смешивали с нефтяным.
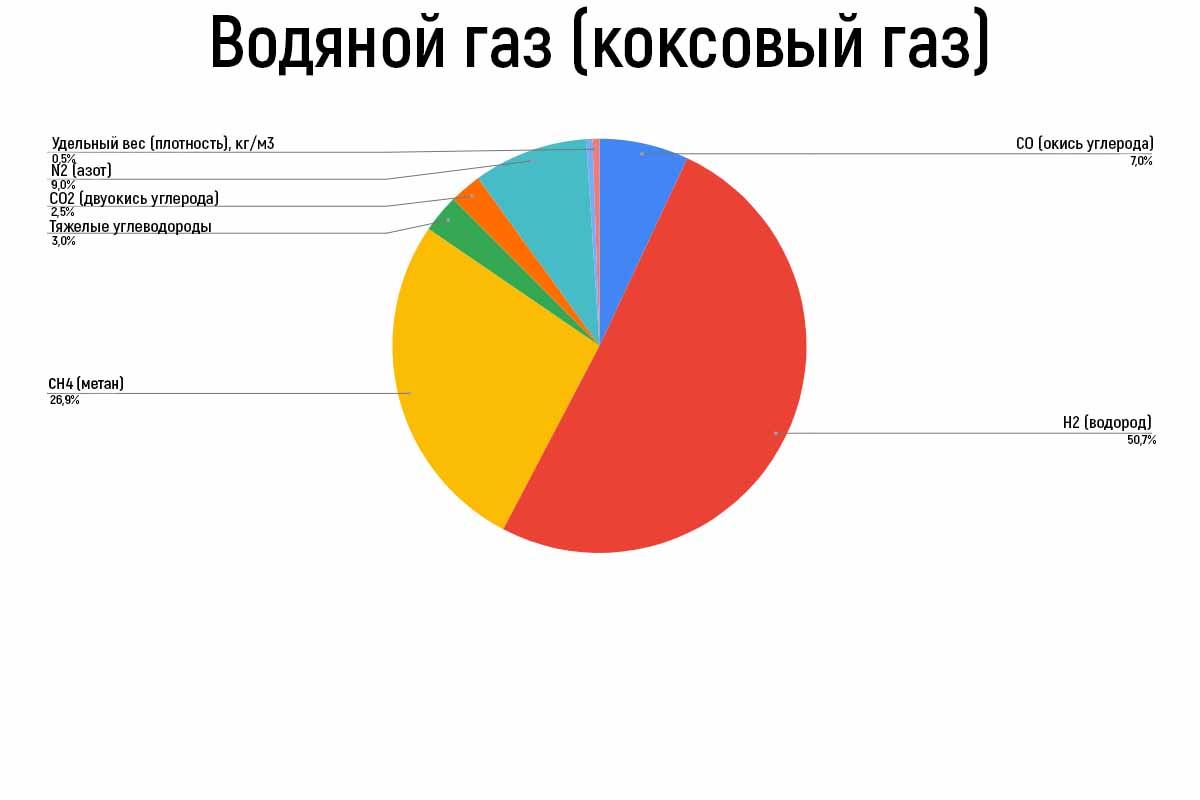 |
| Состав водяного газа (коксовый газ) |
Водяной газ (или коксовый газ)
Этот газ добывают достаточно необычным образом: через кокс пропускают перегретый водяной пар при температуре выше 1000ºС.
Открытие такого взаимодействия раскаленного угля и пара принадлежит Феличе Фонтана (1780 г.). Первый раз применили для освещения в Дублине в 1830 году, и только около 1855 года водяной газ начали использовать во Франции и других странах Европы.
Стоит отметить, что кроме водяного газа есть карбюрированный, чьи свойства зависят от способа и степени карбюрации.
Воздушный газ
Для изготовления воздушного газа применяется газолин. В продаже он чаще всего называется нефтяным эфиром, гидририном и др. Для приготовления воздушного газа воздух пропускается через карбюратор с газолином. Также имеется второй вариант получения, который заключается в смешении определенного объема газолина с определенным количеством сжатого воздуха. Свое применение газ нашел в США: в основном, его использовали для освещения небольшие города, гостиницы, ж/д станции, заводы.
Блаугаз
Свое название блаугаз получил от фамилии немецкого инженера Блау. Ученый получил этот газ путем сжатия нефтяного газа при давлении 2,0 МПа в присутствии абсорбирующих веществ. Получаемый таким образом светильный газ и есть блаугаз, который может быть сжижен, но в отличие от других газов при более высоком давлении.
Из вышесказанного можно сделать вывод: многие искусственные газы производились из твердых материалов и получили большее распространение. Нельзя забыть и о побочных газах, которые, в основном, получают в металлургии, например, доменный газ.
В 30-ые годы XX века один городской житель потреблял: во Франции — 40 м 3 , в Германии — 51 м 3 , в Нидерландах — 74 м 3 , в США- чуть больше 100 м 3 , В Австралии — 117 м 3 , Великобритания была лидером — 178м 3 .
В XX веке газ постепенно вытесняется в сфере освещения электричеством. Созданная инфраструктура для производства и распространения искусственного газа сохранилась. Еще долгое время газ, получаемый из угля, использовали в котельных, на электростанциях для получения электричества и в газовых плитах.
Источник
Искусственные газы
Искусственные газы
В годы, предшествующие развитию промышленности природных газов, широкое применение находил светильный или городской газ, получаемый в результате сухой перегонки (без доступа воздуха) твердого топлива, в частности каменного угля с высоким содержанием летучих или горючих сланцев. Производство таких газов было сосредоточено на специальных газовых заводах. Область применения — в основном бытовые нужды: газовые плиты и водонагреватели.
В настоящее время выработка таких газов, в связи с развитием промышленности природных газов, незначительна.
В больших количествах аналогичные искусственные газы получаются на современных коксохимических заводах в качестве побочного продукта при производстве металлургического кокса из коксующихся каменных углей или в специальных установках полукоксования (низкотемпературного коксования).
Искусственные газы процесса полукоксования (полукоксовый газ) содержит в своем составе различные углеводороды, водород, окись углерода и балласт: двуокись углерода, азот и водяные пары. Значительная часть углеводородов при обычных температурах окружающей среды конденсируется в виде смол, бензола, газового бензина, которые улавливаются, так как представляют собой ценное сырье для химической промышленности. Искусственные газы после улавливания конденсирующихся продуктов и очистки находит применение в качестве топлива. Теплота сгорания полукоксового газа 20,0-30,0 Mдж/м 3 .
Коксовый газ является попутным продуктом производства кокса. Выплавка чугуна требует большого количества металлургического кокса, для получения которого осуществляется процесс высокотемпературного коксования в специальных печах. Процесс сухой перегонки специальных коксующихся углей при температуре 1000-1200° С протекает с выделением значительного количества газа, состоящего из метана, водорода, окиси углерода и балласта.
После улавливания в специальной аппаратуре компонентов ценных для химической промышленности, коксовый газ используется как топливо для промышленных печей и котельных установок. Теплота сгорания коксового газа 15-20 Мдж/м 3 , плотность — 0,45-0,50 кг/м 3 .
Доменный газ выделяется при выплавке чугуна в доменных печах, когда в результате термического воздействия дутья на кокс протекает процесс его газификации, близкий по своим показателям к процессу в специальных газогенераторных установках. Этот доменный, или как его иногда называют колошниковый, искусственные газы состоят из окиси углерода, углекислого газа, азота и очень небольшого количества водорода, углеводородных соединений, водяного пара и кислорода.
Теплота сгорания его лежит в пределах 3,5-4,0 Мдж/м 3 , плотность близка к плотности воздуха или несколько ниже. Количество выделяемого газа колеблется в пределах 3500-4500 м 3 на тонну выплавляемого чугуна.
В связи с низкой теплотой сгорания этот газ неэкономично транспортировать на большие расстояния, поэтому он используется в пределах металлургического комбината: в котельных, на отопление коксовых и нагревательных печей.
Искусственные газы подземной газификации угля получается в результате осуществления генераторного процесса непосредственно в угольном пласте. Подземная газификация угля, впервые осуществленная в нашей стране, выгодно отличается от газификации топлива в специальных газогенераторных установках относительной простотой оборудования и возможностью использовать маломощные и крутопадающие угольные пласты.
Однако управление ходом процесса газификации топлива, протекающего в условиях естественного залегания пласта, является более трудным, чем управление процессом в обычных газогенераторах. В связи с этим качество газа подземной газификации угля обычно несколько ниже, чем генераторного, хотя по мере совершенствования техники оно непрерывно повышается.
Теплота сгорания газа подземной газификации лежит в пределах от 3,5 до 4,5 Мдж/м 3 . Плотность и состав примерно такие же, как и у доменного газа.
Следует заметить, что подземной газификации может подвергаться не только каменный уголь, но также бурый уголь и сланцы, хотя при газификации сланцев возникают дополнительные трудности.
Генераторный газ — результат генераторного процесса, осуществляемого в специальных аппаратах — газогенераторах. Этот процесс представляет собой термическую переработку твердого топлива в присутствии окислителя (свободного или связанного кислорода) с переводом всей горючей части топлива в газ.
До последних лет наиболее распространены были газогенераторные установки, работающие при атмосферном давлении с подачей в них воздуха с некоторым количеством водяного пара. В таких газогенераторах получается так называемый смешанный генераторный газ с теплотой сгорания от 4,5 до 6,5 Мдж/м 3 . Основными горючими компонентами этого газа являются окись углерода и водород при небольшом содержании углеводородных соединений. Негорючая часть (балласт) состоит из азота, углекислого газа и водяных паров.
Газ, получаемый из топлив с большим выходом летучих (бурый уголь, древесина, торф, сланцы), содержит значительное количество смол.
В последние годы получила распространение газификация топлива под давлением 10-25 бар на парокислородном дутье. Такой метод газификации приводит к увеличению количества углеводородных соединений в газе, а за счет этого — к увеличению теплоты сгорания (до 15,0-17,0 Мдж/м 3 ) и плотности газа. Повышенная теплота сгорания и наличие избыточного давления позволяют с выгодой транспортировать зтот газ на умеренные расстояния (100-120 км).
Рассмотренные генераторные искусственные газы (кроме доменного, являющегося отходом производства) относительно дороги и не могут конкурировать с природными. Применение их оправдывается только в районах, которым нельзя подать природный газ.
Водяной газ также относится к генераторным газам. Он получается в результате воздействия водяных паров на раскаленный кокс. Реакция образования водяного газа сопровождается большими затратами тепла, подвод которого осуществляется за счет периодической продувки горящего топлива воздухом, что приводит к интенсивному разогреву слоя до 1100-1200° С. После этого при продувке раскаленного слоя водяным паром образуется водяной газ, горючая часть которого состоит из водорода и окиси углерода, а балластом являются углекислый газ и водяные пары при незначительном содержании других компонентов. Теплота сгорания газа колеблется в пределах 8,5-12,0 Мдж/м 3 , плотность около 0,7 кг/м 3 .
Так как получение этого газа значительно сложнее и дороже, чем получение других горючих газов, и осуществляется с относительно низким к. п. д., то газ не находит применения в качестве промышленного топлива. Используется он как химическое сырье с высоким содержанием водорода или как топливный газ для некоторых специальных технологических аппаратов.
Крекинг-газ — побочный продукт крекинга жидкого топлива. Процесс крекинга сопровождается интенсивным расщеплением углеводородных молекул, входящих в состав этого топлива. В результате этого расщепления наряду с молекулами, образующими жидкие горючие с самыми различными плотностями (бензин, лигроин, керосин, масла), значительная часть молекул образует газовую смесь, состоящую из углеводородов и балластных газов. Количество таких газов в зависимости от технологического процесса переработки и свойств сырья лежит в пределах от 40 до 250 м 3 на тонну исходного топлива. Теплота сгорания крекинг- газа 60,0-80,0 Мдж/м 3 .
При переработке нефти, содержащей сернистые соединения, в крекинг-газе имеется значительное количество сернистых соединений, в частности сероводорода. Крекинг-газ представляет собой ценное химическое сырье, а также хорошее топливо для промышленных печей и котельных установок.
Кроме широко распространенного жидкофазного крекинга в промышленности находят применение и другие процессы термической переработки жидких топлив. Одним из таких процессов является парофазный крекинг — пиролиз, в результате которого имеет место выход больших количеств углеводородных газов с теплотой сгорания 45,0-47,0 Мдж/м 3 .
Источник