- Хлорная, хлорноватая, хлороноватистая, хлористая кислота.
- Хлорная кислота.
- Получение хлорной кислоты.
- Хлорноватая кислота.
- Получение хлорноватой кислоты .
- Хлороноватистая кислота.
- Получение хлороноватистой кислоты .
- Хлористая кислота.
- Свойства хлористой кислоты.
- Получение хлористой кислоты.
- Хлорная кислота
- Содержание
- Свойства
- Физические свойства
- Химические свойства
- Получение
- Применение
- Кислородсодержащие соединения галогенов
- Хлорная кислота – свойства, получение, применение. Предосторожности при работе
Хлорная, хлорноватая, хлороноватистая, хлористая кислота.
Хлорная кислота.
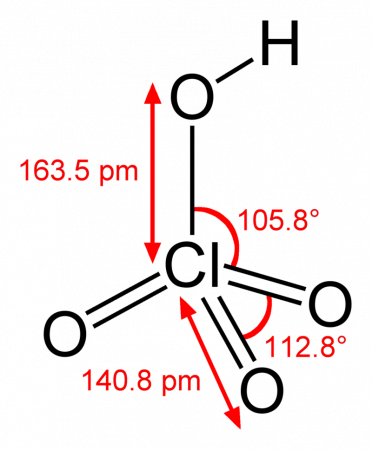
Хлорная кислота HClO4, степень окисления у атома хлора максимальная — +7. Это одна из самых сильных кислот.
Бесцветная летучая жидкость, дымит на воздухе. Безводная кислота очень неустойчива, а активна. Взрывоопасна. Растворяет благородные металлы:
С неметаллами и металлами хлорная кислота реагирует:
Получение хлорной кислоты.
Получение хлорной кислоты из солей:
Хлорноватая кислота.
Хлороноватая кислота HClO3, степень окисления у атома хлора — +5. Сильная одноосновная кислота. В воде хлороноватая кислота диссоциирует:
Получение хлорноватой кислоты .
Хлороноватистая кислота.
Формула хлороноватистой кислоты — HClO, степень окисления у хлора — +1. Кислота неустойчивая.
При комнатных условиях и при низких температурах окислительная способность у данной кислоты самая высокая из других возможных кислородосодержащих кислоты с атомом хлора.
Получение хлороноватистой кислоты .
Хлорную известь под действием влажности воздуха, в котором присутствует углекислый газ, превращается в хлороноватистую кислоту:
Хлористая кислота.
Формула хлористой кислоты – HСlO2. Степень окисления у хлора — +3.
Весьма неустойчива, но более устойчивое соединение, чем хлороноватистая.
Свойства хлористой кислоты.
Получение хлористой кислоты.
1. Из хлоритов хлористой кислоты:
2. По взаимодействию:
Соли хлористой кислоты бесцветны, хорошо растворимы в воде. Хлорит натрия получают так:
Источник
Хлорная кислота
| Хлорная кислота | |||
|---|---|---|---|
| |||
| Систематическое наименование | Хлорная кислота | ||
| Хим. формула | HClO4 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 100,46 г/моль | ||
| Плотность | 1,76 г/см³ | ||
| Температура | |||
| • плавления | −102 °C | ||
| • кипения | 203 °C | ||
| Энтальпия | |||
| • образования | −40,4 кДж/моль | ||
| Константа диссоциации кислоты pKa | −10 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Рег. номер CAS | 7601-90-3 | ||
| PubChem | 24247 | ||
| Рег. номер EINECS | 231-512-4 | ||
| SMILES | |||
| RTECS | SC7500000 | ||
| ChEBI | 29221 | ||
| Номер ООН | 1873 | ||
| ChemSpider | 22669 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
Содержание
Свойства
Физические свойства
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива.
Химические свойства
Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация:
Безводная кислота взрывоопасна из-за наличия в ней оксида хлора (VII). Водные растворы с концентрацией ниже 72% более безопасны, но на свету желтеют с образованием взрывоопасных оксидов хлора. Пожелтевшую кислоту рекомендуется аккуратно разбавлять и нейтрализовать щелочами или карбонатами.
Являясь сильной неустойчивой кислотой, хлорная кислота разлагается:
Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот и окислитель, растворяет золото и платиновые металлы (9HClO4 + 2Au = 2Au(ClO4)3 + 3HClO3 + 3H2O), а в реакции с серебром образует хлорноватую кислоту:
Неметаллы и активные металлы восстанавливают концентрированную хлорную кислоту до хлороводорода
8As + 5HClO4 + 12H2O = 8H3AsO4 + 5HCl (данная реакция используется в металлургии для очистки руд)
Разбавленная хлорная кислота обладает слабыми окислительными свойствами (не окисляет сероводород, диоксид серы, йодоводород, хром(II), азотистую кислоту) и при реакции с металлами до водорода в электрохимическом ряду выделяет водород с образованием перхлоратов. Водные растворы хлорной кислоты устойчивы.
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства (например, с диметилсульфоксидом), может привести к воспламенению и взрыву. С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4·nH2O (где n = 0,25…4). Моногидрат HClO4·H2O имеет ионную природу и температуру плавления +50 °C. Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты. Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4 + ClO4 − , NO2 + ClO4 − .
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
Соли хлорной кислоты называются перхлоратами. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
Получение
- Водные растворы хлорной кислоты получают электрохимическим окислением соляной кислоты или хлора, растворённых в концентрированной хлорной кислоте, а также обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами.
- Безводная хлорная кислота образуется при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой, а также водных растворов хлорной кислоты с олеумом:
KClO4 + H2SO4 → KHSO4 + HClO4
Применение
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель.
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы.
Источник
Кислородсодержащие соединения галогенов
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее — оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
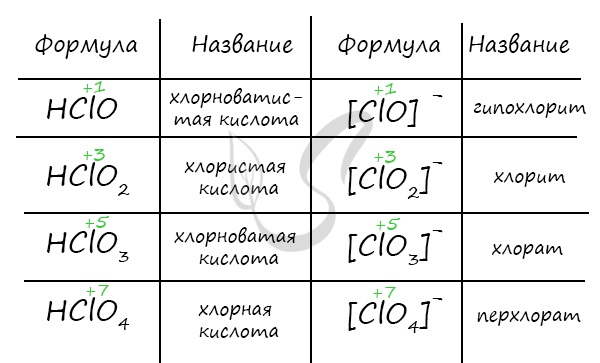
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO — бромноватистая кислота (соли гипобромиты), HIO — иодноватистая кислота (соли гипоиодиты).
HIO3 — иодноватая кислота (соли иодаты), HBrO3 — бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Хлористая кислота может быть получена из собственных солей — хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе — хлорная кислота — может быть получена реакцией перхлората калия или натрия с концентрированной серной кислотой.
Химические свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная — к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.
KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кислородсодержащие соединения галогенов
HBrO2 — бромистая кислота, слабая
HClO4 — хлорная кислота, сильная
Бертолетова соль — KClO3
HClO3 — хлорноватая кислота, сильная
Источник
Хлорная кислота – свойства, получение, применение. Предосторожности при работе
Хлорная кислота (формула HClO4) – это одноосновная безводная кислота. Содержит в себе хлор (Cl) в высшей степени окисления, по этой причине является сильнейшим окислителем. Взрывоопасна.
Свойства хлорной кислоты
1. Это летучая жидкость без цвета, в воздухе сильно дымит, мономерна в парах. Неустойчива и очень реакционна. Для этой кислоты характерна автодегидратация:
3HClO4 = H3O+ (катион) + ClO- (анион) + Cl2O7 (оксид хлора)
2. Данное вещество хорошо растворимо в хлор- и фторорганических растворителях, таких как CH2Cl2 (хлористый метилен), CHCl3 (хлороформ) и другие. Смешивается и с другими растворителями, проявляет восстановительные свойства, при неосторожном обращении может привести к взрыву или воспламенению.
3. Хорошо смешивается с водой (H2O) в любых соотношениях. Образует несколько гидратов. Концентрированные растворы данной кислоты обладают немного маслянистой консистенцией. Растворы водные данной кислоты обладают хорошей устойчивостью и низкой окислительной способностью. С водой рассматриваемое нами вещество образует азеотропную смесь, которая при температуре 203 градуса кипит и содержит 72 процента HClO4.
4. Хлорная кислота (формула HClO4) является одной из самых сильных кислот. Из-за этого в ее среде некоторые кислотные соединения ведут себя подобно основаниям.
5. В условиях пониженного давления при слабом нагревании смеси кислоты хлорной с фосфорным ангидридом образуется маслянистая бесцветная жидкость – ангидрид хлорный:
2HClO4 (кислота хлорная) + P4O10 (ангидрид фосфорный) = Cl2O7 (ангидрид хлорный) + H2P4O11
Способы получения
1. Водные растворы данного вещества можно получить двумя способами. Первый заключается в электрохимическом окислении хлора или соляной кислоты в концентрированной соляной кислоте, а второй – в обменном разложении перхлоратов натрия или калия неорганическими сильными кислотами.
2. Хлорную безводную кислоту можно получить тоже двумя способами. Первый заключается во взаимодействии перхлоратов калия (K) или натрия (Na) с серной кислотой в концентрированной виде, а второй – во взаимодействии олеума с водным раствором хлорной кислоты:
KClO4 (водный раствор хлорной кислоты) + H2SO4 (кислота серная) = KHSO4 (калия гидросульфат) + HClO4 (хлорная кислота)
Применение хлорной кислоты
– концентрированные растворы широко используют для получения перхлоратов (соли данной кислоты) и в аналитической химии;
– хлорная кислота используется при разложении руд, в качестве катализатора и при анализе минералов;
– перхлорат калия (формула: KClO4), соль данной кислоты, применяется при создании взрывчатых веществ, а магния перхлорат (ангидрон, Mg(ClO4)2) используется в качестве осушителя.
Безопасность при работе
Хлорную безводную кислоту нельзя долго хранить и перевозить, так как при стандартных условиях она быстро разлагается и может впоследствии самопроизвольно взорваться.
Другие неорганические хлорсодержащие кислоты:
1. Соляная кислота (формула: HCl) – одноосновная сильная кислота, едкая, дымящая на воздухе жидкость. Применяют в гальванопластике (декапирование, травление) и в гидрометаллургии, для очистки металлов при лужении и паянии, для получения хлоридов марганца, цинка, железа и других металлов. В пищевой промышленности данное вещество зарегистрировано в качестве пищевой добавки Е507.
2. Хлорноватистая кислота (формула: HClO) – одноосновная очень слабая кислота. Может существовать только в растворах. Используется для санитарных целей, а также для отбеливания тканей и целлюлозы.
3. Хлористая кислота (HClO2) – кислота одноосновная средней силы. Неустойчива в свободном виде, в разбавленном водном растворе обычно быстро разлагается. Ангидрид этой кислоты до сих пор неизвестен.
4. Хлорноватая кислота (HClO3) – одноосновная сильная кислота. Не получена в свободном виде, так как распадается в концентрированных растворах. В водных растворах существует при концентрации ниже 30 процентов. Довольно устойчива при низких температурах.
Источник