- Способы получения хлорида марганца
- Хлорид марганца II
- Содержание
- Получение
- Свойства
- Хлорид марганца: свойства, структура, применение, риски
- Содержание:
- Физические свойства
- Внешность
- Молярные массы
- Точки плавления
- Точка кипения
- Плотности
- Растворимость воды
- Растворимость в органических растворителях
- Разложение
- pH
- Стабильность
- Структура хлорида марганца
- Дигидрат
- Безводный
- Номенклатура
- Приложения
- Лаборатория
- Промышленность
- Удобрения и корм для животных
- Риски
- Ссылки
Способы получения хлорида марганца
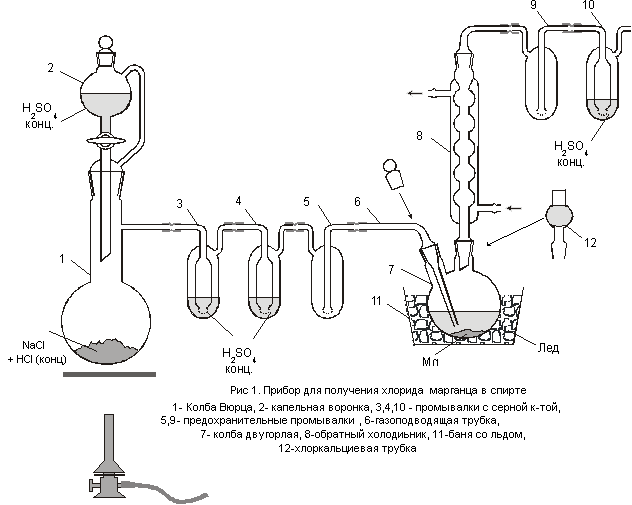
ПОЛУЧЕНИЕ БЕЗВОДНОГО ХЛОРИДА МАРГАНЦА В СРЕДЕ АБСОЛЮТНОГО СПИРТА
Ознакомиться по любому доступному Вам справочнику с физическими и физико-химическими свойствами используемых и синтезируемых Вами веществ, а также промежуточных продуктов реакции. Напишите уравнения реакций.
Собрать прибор, изображенный на рис.1. В колбу Вюрца 1 поместить 20 г хлорида натрия, смочить его 3 – 5 мл концентрированной соляной кислоты. В капельную воронку налить 35 мл концентрированной серной кислоты. В двугорлую колбу 7 поместить 0,2 — 0,3 г марганца в виде порошка и прилить к нему 15 мл абсолютированного этилового спирта. Охладить колбу в бане со льдом..
Осторожно приоткрыть кран капельной воронки и медленно по каплям добавлять в колбу 1 серную кислоту. Хлорид водорода должен пробулькивать через все промывалки, в том числе и через промывалку 10. (Поскольку хлорид водорода поглощается спиртом, скорость потока в последней промывалке меньше чем в осушительных). Ток газа должен быть достаточно интенсивным. Хлористый водород – удушливый газ, вызывает сильные ожоги слизистой оболочки, разрушает зубы и т.д. ПДК в воздухе рабочей зоны 5,0 мг/м 3 . Поток газа регулировать по скорости пробулькивания в последней промывлке (1 – 2 пузырька в сек). Насыщать этанол хлоридом водорода в течение 1 – 1,5 час.
После насыщения спирта хлористым водородом вынуть газоподводящую трубку и закрыть горло колбы стеклянной пробкой. Отсоединить промывалки 9 и 10, а холодильник закрыть хлоркальциевой трубкой. Снять охлаждение. Колбу с реакционной смесью оставить на ночь. За это время оставшийся металл должен вступить в реакцию. Если металл за ночь полностью не прореагирует, то для ускорения реакции можно подогреть колбу на водяной бане.
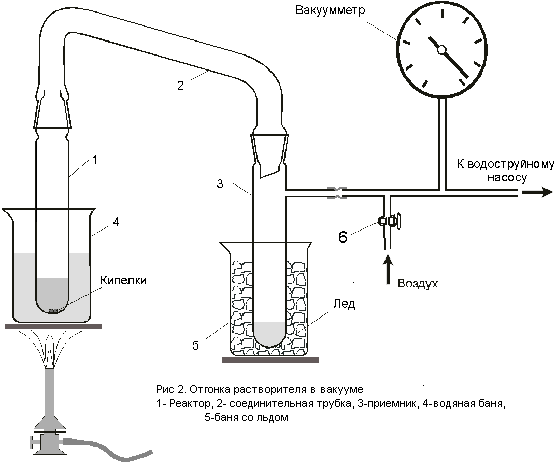
Собрать прибор для отгонки этанола в вакууме (рис.2). Смазать шлифы (только керны) вакуумной смазкой., шлиф реактора 1 смазать снизу на 1/3 высоты. Вставить керны в муфты, поворачивая их вокруг оси. Правильно смазанный шлиф должен быть прозрачным, а вакуумная смазка не выступать из зазора.
Перелить полученный раствор в реактор 1 через воронку.
Поместить реактор в стакан с водой. Присоединить прибор к водоструйному насосу, включить насос, оставив открытым на воздух кран 6. Нагреть воду в стакане до кипения и отогнать большую часть растворителя при атмосферном давлении. Затем медленно закрывать кран 6, следя за интенсивностью кипения раствора. После полной отгонки растворителя, оставить вещество в вакууме еще на 30 мин. Убрать стакан с водой, и охладить прибор в вакууме водоструйного насоса до комнатной температуры. Открыть кран 6 на воздух и выключить насос.
Перенести вещество во взвешенный бюкс, взвесить и определить выход в процентах. Небольшое количество вещества растворить в воде и определить рН раствора. Написать уравнение реакции.
Реактивы: 1. Марганец – 0,2 – 0,3 г. 2. Этанол – 15 мл. 3. Хлорид натрия – 20 г. 4. Серная кислота конц. – 35 мл.
Оборудование: 1. Колба Вюрца. 2. Капельная воронка. 3. Промывалки – 5 шт. 4. Двугорлая колба. 5. Шариковый холодильник. 6 Газоподводящая трубка. 7. Хлоркальциевая трубка. 8. Реактор. 9. Пробирка – приемник. 10. П – образная трубка. 11. Стакан.
Рекомендованная литература: 1. Практикум по неорганической химии /ред В.П.Зломанов, М.: МГУ, 1994.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Источник
Хлорид марганца II
| Хлорид марганца II | |
|---|---|
 | |
| Систематическое наименование | Хлорид марганца |
| Хим. формула | MnCl2 |
| Молярная масса | 125,84 г/моль |
| Плотность | 2,977 г/см³ |
| Температура | |
| • плавления | 650 °C |
| • кипения | 1231 °C |
| Растворимость | |
| • в воде | 73,9 20 ; 112.7 80 г/100 мл |
| ГОСТ | ГОСТ 612-75 ГОСТ 612-67 |
| Рег. номер CAS | 7773-01-5 |
| PubChem | 24480 |
| Рег. номер EINECS | 231-869-6 |
| SMILES | |
| RTECS | OO9625000 |
| ChEBI | 63041 |
| Номер ООН | 3288 |
| ChemSpider | 22888 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид марганца II — неорганическое соединение, соль металла марганца и соляной кислоты с формулой MnCl2. Кристаллы розового цвета. Хорошо растворяется в воде. Образует кристаллогидраты.
Содержание
Получение
В лаборатории получают растворением ферромарганца, металлического марганца или диоксида марганца в соляной кислоте с последующим осаждением примеси железа пастой MnCO3.
При выделении из водных растворов образует кристаллогидраты MnCl2•4H2O и MnCl2•2H2O.
Свойства
При 650 °C возгоняется и в присутствии влаги разлагается. В воде хорошо растворим (42,3 г/100 мл)
Источник
Хлорид марганца: свойства, структура, применение, риски
Содержание:
В хлорид марганца представляет собой неорганическую соль, химическая формула которой MnCl2. Он состоит из ионов Mn 2+ и Cl – в соотношении 1: 2; для каждого катиона Mn 2+ в два раза больше анионов Cl – .
Эта соль может образовывать различные гидраты: MnCl22H2О, (дигидрат), MnCl24H2О (тетрагидрат) и MnCl26H2О (гексагидрат). Наиболее распространенной формой соли является тетрагидрат.
На физические свойства хлорида марганца, такие как плотность, температура плавления и растворимость в воде, влияет степень его гидратации. Например, температура плавления безводной формы намного выше, чем у тетрагидратной формы.
Цвет хлорида марганца бледно-розовый (верхнее изображение). Бледность характерна для солей переходных металлов. Хлорид марганца — слабая кислота Льюиса.
Минерал, известный как escacquita, представляет собой естественно безводную форму хлорида марганца (II); как кемпита.
Хлорид марганца (II) используется в качестве легирующего агента; катализатор в реакциях хлорирования и др.
Физические свойства
Внешность
— Безводная форма: розовые кубические кристаллы.
— Тетрагидратная форма: слегка расплывающиеся красноватые моноклинные кристаллы.
Молярные массы
— Безводный: 125,838 г / моль.
— Дигидрат: 161,874 г / моль.
— Тетрагидрат: 197,91 г / моль.
Точки плавления
— Безводный: 654 ºC.
— Дигидрат: 135 ºC.
— Тетрагидрат: 58 ºC.
Точка кипения
Безводная форма: 1190 ºC.
Плотности
— Безводный: 2,977 г / см 3 .
— Дигидрат: 2,27 г / см 3 .
— Тетрагидрат: 2,01 г / см 3 .
Растворимость воды
Безводная форма: 63,4 г / 100 мл при 0 ° C; 73,9 г / 100 мл при 20 ° С; 88,5 г / 100 мл при 40 ° С; и 123,8 г / 100 мл при 100 ° C.
Растворимость в органических растворителях
Растворим в пиридине и этаноле, не растворим в эфире.
Разложение
Если не принять надлежащих мер предосторожности, дегидратация гидратированных форм до безводной формы может привести к гидролитическому обезвоживанию с образованием хлористого водорода и оксихлорида марганца.
pH
0,2 М раствор тетрагидрата хлорида марганца в водном растворе имеет pH 5,5.
Стабильность
Он стабилен, но чувствителен к влаге и несовместим с сильными кислотами, химически активными металлами и перекисью водорода.
Структура хлорида марганца
Начиная с тетрагидратной соли с ярко-розовыми кристаллами, она должна состоять из координационных комплексов (верхнее изображение). В них металлический центр Mn 2+ он окружен октаэдром, образованным четырьмя молекулами H2O и два аниона Cl – .
Обратите внимание, что лиганды Cl – находятся в цис-позициях; все они эквивалентны в прямоугольном основании октаэдра, и не имеет значения, «перемещается» ли Cl – на любую из трех других позиций. Другой возможный изомер для этой координированной молекулы, в котором как Cl – находятся в транс-позициях; то есть в разных крайностях (одна вверху, другая внизу).
Четыре молекулы воды с их водородными связями позволяют двум или более октаэдрам соединяться диполь-дипольными силами. Эти мостики являются сильно направленными и добавляют электростатическое взаимодействие между Mn 2+ и Cl – , установить упорядоченную структуру, характерную для кристалла.
Розовый цвет MnCl24H2Или это связано с электронными переходами Mn 2+ и его конфигурация d 5 . Точно так же возмущения, вызванные близостью молекул воды и хлоридов, изменяют количество энергии, необходимое для поглощения этими d-электронами. 5 для перехода на более высокие уровни энергии.
Дигидрат
Соль была обезвожена, и теперь ее формула MnCl.22H2О. А как насчет октаэдра выше? Ничего, кроме того, что две молекулы H2Или что заброшенные заменяются двумя Cl – .
Сначала вы можете создать неверное впечатление, что существует четыре Cl – для каждого Mn 2+ ; однако половина октаэдра (в осевом направлении) на самом деле является повторяющейся единицей кристалла.
Таким образом, верно, что существует Mn 2+ согласовано с двумя Cl – и две молекулы воды в транс-положениях. Но для того, чтобы эта единица взаимодействовала с другой, ей нужны два мостика Cl, которые, в свою очередь, позволяют завершить координационный октаэдр для марганца.
Помимо мостиков Cl, молекулы воды также взаимодействуют своими водородными связями, так что эта цепочка MnCl22H2Или не разоружать.
Безводный
Наконец, хлорид магния закончил терять всю воду, содержащуюся в его кристаллах; теперь у нас есть безводная соль MnCl2. Без молекул воды кристаллы заметно теряют интенсивность своей розовой окраски. Октаэдр, как и гидраты, остается неизменным из-за самой природы марганца.
Без молекул воды Mn 2+ заканчивается октаэдром, состоящим только из Cl – . Эта координационная связь имеет как ковалентный, так и ионный характер; по этой причине обычно подразумевают структуру MnCl2 как полимерный кристалл. В нем чередуются слои Mn и Cl.
Номенклатура
Марганец имеет много возможных степеней окисления. Из-за этого традиционная номенклатура MnCl2 неясно.
С другой стороны, хлорид марганца соответствует своему более известному названию, к которому необходимо было бы добавить «(II)», чтобы привести его в соответствие с номенклатурой сырья: хлорид марганца (II). А также существует систематическая номенклатура: дихлорид марганца.
Приложения
Лаборатория
Хлорид марганца служит катализатором хлорирования органических соединений.
Промышленность
Хлорид марганца используется как сырье для изготовления антидетонационных устройств для бензина; сварочный материал для цветных металлов; посредник в производстве пигментов; и сушилка для льняного масла.
Он используется в текстильной промышленности для печати и крашения; при производстве различных солей марганца, в том числе метилциклопентадиенилмарганца трикарбонила, используемого в качестве красителя для кирпича; и в производстве сухих электрических элементов.
Хлорид марганца используется в качестве легирующего агента и добавляется к расплавленному магнию для производства марганцево-магниевых сплавов; как промежуточный продукт при приготовлении сушки лакокрасочных материалов; и как компонент дезинфицирующих средств.
Он также используется для очистки магния.
Удобрения и корм для животных
Хлорид марганца используется в качестве источника марганца, элемента, который, хотя и не является основным элементом питания для растений, например азот, фосфор и калий, но используется в многочисленных биохимических реакциях, типичных для этих живых существ.
Точно так же его добавляют в корм племенным животным для обеспечения марганцем, важным микроэлементом для роста животных.
Хлорид марганца — это диетический компонент, который обеспечивает марганец, элемент, который участвует во многих процессах, необходимых для жизни, включая: синтез жирных кислот и половых гормонов; усвоение витамина Е; производство хрящей; и т.п.
Риски
При контакте с кожей он может вызвать покраснение, раздражение и дерматит. Хлорид марганца вызывает покраснение, болезненность и слезотечение.
При вдыхании соли вызывает кашель, боль в горле и одышку. С другой стороны, проглатывание может вызвать рвоту, тошноту и диарею.
Хроническое чрезмерное вдыхание этой соли может привести к воспалению легких и последующему реактивному заболеванию дыхательных путей.
Его чрезмерное употребление может вызвать психические расстройства, обезвоживание, гипотонию, печеночную и почечную недостаточность, отказ полиорганной системы и смерть.
Нейротоксичность является начальным проявлением нежелательного действия марганца и может проявляться головными болями, головокружением, потерей памяти, гиперрефлексией и легким тремором.
Тяжелая токсичность проявляется симптомами и признаками, аналогичными тем, которые наблюдаются при болезни Паркинсона.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Википедия. (2019). Хлорид марганца (II). Получено с: en.wikipedia.org
- Наноматериалы Sky Spring. (2016). Порошок хлорида марганца. Получено с: ssnano.com
- Химическая книга. (2017). Хлорид марганца. Получено с: chemicalbook.com
- Сеть токсикологических данных. (н.д.). Хлорид марганца. Toxnet. Получено с: toxnet.nlm.nih.gov
- Жерар Кайез. (2001). Хлорид марганца (II). doi.org/10.1002/047084289X.rm020
- Национальный центр биотехнологической информации. (2019). Дихлорид марганца. База данных PubChem. CID = 24480. Получено с: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Минералы: марганец. Получено с: webconsultas.com
Антидепрессанты и алкоголь: эффекты и последствия их сочетания
20 самых острых продуктов в мире (и их ценность по Сковиллу)
Источник