Способы получения хлорангидридов карбоновых кислот
Галогенангидридами карбоновых кислот (ацилгалогенидами) называют производные карбоновых кислот, в которых гидроксильная группа, входящая в состав карбоксильной группы, замещена на атом галогена (хлор, бром, фтор и йод).
где Нal – галоген
Способы получения
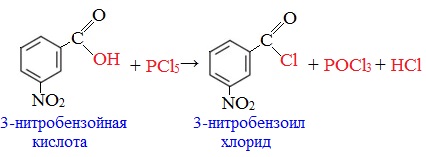
При взаимодействии карбоновых кислот с галогенидами фосфора (три-хлористый фосфор PCl3, пятихлористый фосфор PСl5, бромиды фосфора PBr3 и PBr5, фосфор + йод), либо с тионилхлоридом (SOCl2) образуются галогенангидриды карбоновых кислот:
Номенклатура
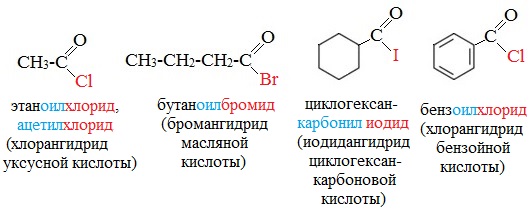
Названия галогенангидридов образуют добавлением к названию соответствующего углеводорода окончания — оил (в случае циклических соединений – окончания — карбонил ) и добавляют название галогенид . А также из названий соответствующих ацильных групп и названия галогена .
Ацил – одновалентный кислотный остаток, образовавшийся после удаления гидроксильной группы.
Физические свойства
Галогенангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества с резким запахом, легколетучи – на воздухе «дымят», раздражают слизистые оболочки и кожу. Простейшие ацилфториды газообразны/
В воде галогенангидриды растворяются мало, но быстро реагируют с ней.
Характеристика реакционной способности
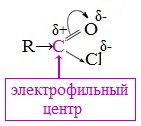
Галогенангидриды относятся к соединениям с высокой реакционной способностью. Они легко обменивают галоген на нуклеофильные группы, поскольку на реакционном центре (С-атоме карбонильной группы) имеется дефицит электронов. Эти превращения могут быть отнесены к реакциям нуклеофильного замещения (SN) .
Для галогенангидридов характерна большая полярность связей, что вызвано электроотрицательным действием атома галогена.
Галогенангидриды являются весьма активными электрофильными реагентами . В результате электроноакцепторных свойств атома галогена (–I-эффект) на атоме углерода карбонильной группы электронная плотность значительно снижается, поэтому галогенангидриды являются более сильными электрофильными реагентами, чем карбоновые кислоты.
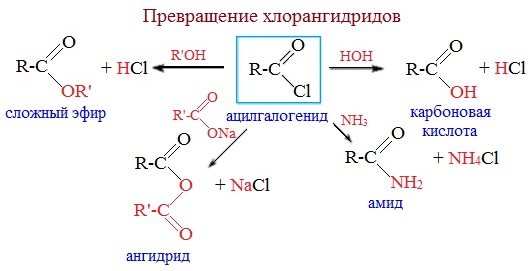
Галогенангидриды карбоновых кислот легко вступают в различные реакции нуклеофильного замещения. Под действием воды они гидролизуются до карбоновых кислот; со спиртами, алкоголятами и фенолятами образуют сложные эфиры; с аммиаком, первичными и вторичными аминами дают амиды; с солями карбоновых кислот — ангидриды кислот.
Поскольку в процессе реакций нуклеофильного замещения в молекулу нуклеофильного реагента вводится ацильная группа, галогенангидриды являются ацилирующими реагентами , а реакции называют реакциями ацилирования . Со слабыми нуклеофильными реагентами, такими, как арены, галогенангидриды реагируют в присутствии кислот Льюиса (AlCl3, FeBr3, SnCl2 и др.).
Химические свойства галогенангидридов
1. Взаимодействие с водой (гидролиз)
Галогенангидриды энергично реагируют с водой, образуя соответствующие карбоновые кислоты:
Гидролиз необратим (это необходимо учитывать при хранении реактивов).
Хлорангидриды или ацилхлориды простых карбоновых кислот – жидкости, часто лакриматоры (вызывают слёзы). Ацилхлориды проявляют лакриматорные свойства из-за гидролиза до HCl и карбоновой кислоты, который происходит на слизистых оболочках глаз и дыхательных путей.
2. Образование амидов
Галогенангидриды энергично реагируют c аммиаком, образуя амиды, с первичными и вторичными аминами, образуя N-замещенные амиды карбоновых кислот:
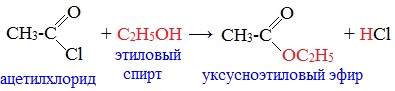
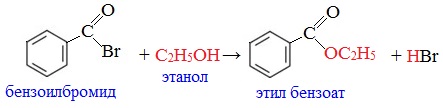
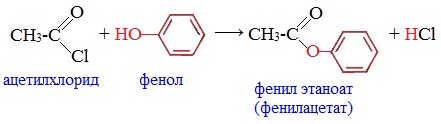
3. Образование сложных эфиров
Галогенангидриды при взаимодействии со спиртами и фенолами образуют сложные эфиры:
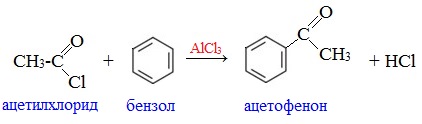
4. Образование ароматических кетонов
При взаимодействии ангидридов с аренами в присутствии хлорида алю-миния образуются кетоны (реакция Фриделя-Крафтса).
5. Реакции восстановления
Восстановление осуществляется гидридами металлов или каталитическим гидрированием:
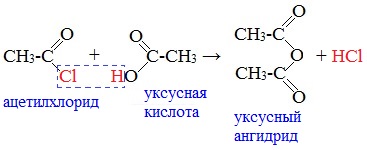
6. Взаимодействие с карбоновыми кислотами
7. Реакции α-водородного атома
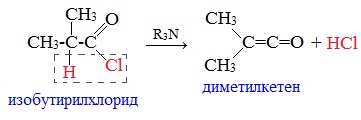
Ацилгалогениды, содержащие атомы водорода при α— углеродном атоме, в присутствии сильных оснований (третичных аминов) отщепляют молекулу галогеноводорода, образуя кетены:
Хлорангидриды чрезвычайно реакционноспособные соединения и находят применение в синтезе других производных карбоновых кислот (ангидридов, сложных эфиров и амидов).
Отдельные представители
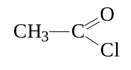
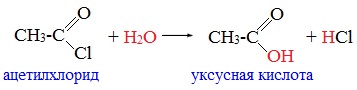
Ацетилхлорид используют как ацилирующий реагент в производстве красителей и лекарственных средств.
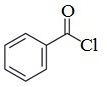
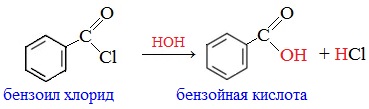
Он применяется для введения бензоильной группы в синтезе индигоидных красителей и лекарственных средств.
Бензоилхлорид умеренно-токсичен, ирритант, обладает лакриматорным воздействием.
Ирританты – группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).
Источник
Способ получения хлорангидридов карбоновых кислот
Использование: получение галоидзамещенных низших карбоновых кислот. Сущность изобретения: хлорангидриды карбоновых кислот получают взаимодействием низшей алифатической кислоты с неорганическим оксогалогенидом при катализе диметилформамидом. В качестве оксогалогенида используют оксохлорид фосфора. Процесс ведут в условиях кипения реакционной смеси при молярном соотношении кислота : оксохлорид фосфора : диметилформамид, равном 1 : 0,67 : (0,25 — 0,33). 3 табл.
Изобретение относится к области химии органических соединений, конкретно к способам получения хлорангидридов карбоновых кислот следующего строения: Данные соединения широко используются в качестве промежуточных продуктов в органическом синтезе.
Известны следующие способы синтеза хлорангидридов карбоновых кислот: 1. Взаимодействие карбоновых кислот с пентахлоридом фосфора.
RCOOH+PCl5__RCOCl+POCl3+HCl 2. Взаимодействие карбоновых кислот с треххлористым фосфором.
3RCOOH+2PCl3__ 3RCOCl+P2O3+3HCl 3. Взаимодействие солей и сложных эфиров карбоновых кислот с хлорокисью фосфора.
2RCOOR(Na)+POCl3__ 2RCOCl+NaPO3+NaCl 4. Взаимодействие карбоновых кислот с хлористым тионилом.
При этом наиболее высокие выходы до 89% хлорангидридов достигнуты при проведении реакции в присутствии каталитических количеств диметилформамида. Именно этот метод с использованием катализатора диметилформамида выбран в качестве прототипа.
Недостатком данного метода является повышенные требования к качеству хлористого тионила. Для получения чистого хлорангидрида карбоновой кислоты исходный хлористый тионил рекомендуют дополнительно очищать. Острый дефицит хлористого тионила затрудняет применение этого метода для получения укрупненных количеств хлорангидридов карбоновых кислот.
Перечисленных выше недостатков не имеет предлагаемый способ получения хлорангидридов карбоновых кислот взаимодействием хлорокиси фосфора с карбоновыми кислотами в присутствии катализатора диметилформамида.
Процесс осуществляется в емкостном реакторе с обогревом, перемешивающим устройством, обратным холодильником и термометром. Процесс проводят при T 80 100oC и молярном соотношении реагентов: карбоновая к-та: POCl3: ДМФ 1: примерно 0,67 0,25 0,33. По предложенному методу хлорангидриды карбоновых кислот получают с выходами до 93% Чистота и строение полученных соединений подтверждены данными элементного анализа, ИК-спектроскопии, ГЖХ, а также соответствием найденных физических констант литературным данным.
Высокий выход галоидангидридов карбоновых кислот, их чистота, использование выпускаемых нашей промышленностью доступных исходных соединений и легкость оформления процесса обуславливают наибольшую технологичность предлагаемого метода по сравнению с известными.
Фосфорный ангидрид, образующийся как побочный продукт после обработки водным аммиаком, может быть предложен в качестве удобрений.
Пример N 1.Получение хлорангидрида уксусной кислоты.
В реактор, снабженный мешалкой, капельной воронкой, обратным холодильником и термометром, помещают 38,2(0,249М) хлорокиси фосфора. В капельную воронку загружают 22,3 г(0,371М) уксусной кислоты и 7 мл(0,019М) диметилформамида. Реакционную массу нагревают до 80oC и в течение 15 -20 мин прибавляют к ней смесь из капельной воронки. Затем обратный холодильник заменяют на прямой и отбирают образующийся хлорангидрид уксусной кислоты при температуре в парах 50 60oC. При повторной перегонке собирают фракцию в температурном интервале 51 53oC. Получено 25,0 г хлорацетилхлорида (выход 86%), n2D0= 1,3893 что соответствует литературным данным: Т. кип. 51 — 52oC, n2D0= 1,38976.
Элементным анализом найдено: гидролизуемый хлор 45,5, для C2H3ClO вычислено: Cl 45,2.
ИК-спектр: 18,19; 1428; 1370; 1102; 1053; 955 (см-1) не обнаружил заметных количеств примесей.
Результаты исследования влияния количества диметилформамида на выход целевого ацетилхлорида приведены в табл.1.
Как следует из данных таблицы, максимальный выход ацетилхлорида достигнут при молярном соотношении реагентов: уксусная кислота хлорокись фосфора диметилформамид 1 0,67 0,25. Дальнейшее повышение содержания диметилформамида не приводит к повышению выхода.
Пример N2. Получение хлорангидрида пропионовой кислоты.
В реактор, снабженный мешалкой, термометром, обратным холодильником и капельной воронкой, загружают 40,4 г(0,263 М) хлорокиси фосфора. В капельную воронку загружают 29,1 г(0,393 М) пропионовой кислоты и 10 мл(0,130 М) диметилформамида. Реакционную массу нагревают до 100oC. Далее процесс ведут по приведенной выше методике. Полученный хлорангидрид пропионовой кислоты перегоняют при атмосферном давлении в температурном интервале 77 — 80oC. Получено 34,1 г хлорангидрида пропионовой кислоты (выход 93%) n2D0 1,4050 что соответствует литературным данным: Т. кип. 80oC, n2D0= 1,40507.
Элементным анализом найдено: Cl 38,1 для C3H5ClO вычислено: Cl 38,4.
ИК-спектр: 19,22; 1785; 1460; 1409; 1390; 1265; 1252; 1115; 1085; 10,12; 915; 780; 650 см-1 -не обнаружил заметных количеств примесей.
Результаты исследования влияния количества диметилформамида на выход целевого пропионилхлорида приведены в табл.2.
Как следует из таблицы, максимальный выход пропионилхлорида достигнут при молярном соотношении реагентов: пропионовая кислота хлорокись фосфора — диметилформамид 1 0,67 0,33. Дальнейшее повышение содержания диметилформамида не приводит к повышению выхода.
Пример N3. Получение хлорангидрида трихлоруксусной кислоты.
В реактор загружают 77,8 г (0,507 М) хлорокиси фосфора. В капельную воронку вносят 123,6 (0,756 М) трихлоруксусной кислоты и 19,2 мл (0,249 М) диметилформамида. Реакционную массу нагревают до 100oC и прибавляют к ней содержимое капельной воронки в течение 20 мин. При этом перемешиваемая реакционная масса находится в состоянии мягкого кипения. Затем температуру доводят до комнатной и реакционную массу экстрагируют хлороформом. Хлороформ отпаривают и остаток перегоняют при атмосферном давлении.
Получают 126,5 (выход 92%) хлорангидрида трихлоруксусной кислоты с температурой кипения 114 118oC, n2D0= 1,4700 что соответствует литературным данным: Т. кип. 118oC. Элементным анализом найдено: Cl 77,7, для C2Cl4O вычислено Cl 78,1. В спектре ПМР протона не обнаружено. ИК-спектр: 1797, 1735, 1017, 839, 800, 732 см-1 не обнаружил заметных количеств примесей.
Результаты исследования влияния количества диметилформамида на выход целевого хлорангидрида приведены в табл.3.
Как следует из таблицы, максимальный выход хлорангидрида трихлоруксусной кислоты достигнут при молярном соотношении реагентов: трихлоруксусная кислота хлорокись фосфора: диметилформамид 1 0,67 0,33. Дальнейшее повышение содержания диметилформамида не приводит к повышению выхода.
Во всех случаях (примеры 1 3) режим мягкого кипения, при котором проводится реакция, является оптимальным, т.к. снижение температуры ведет к снижению скорости реакции.
Предлагаемый способ получения хлорангидридов карбоновых кислот имеет следующие преимущества относительно известных способов.
1. Использование данного способа позволяет получать целевой продукт с выходом до 93%
2. Целевой продукт не содержит нежелательных примесей и не требует дополнительной очистки.
3. Данный способ предусматривает использование в качестве исходного сырья продуктов крупнотоннажного производства в отличие от прототипа.
4. Технологическое оформление процесса предусматривает использование стандартной аппаратуры.
Способ получения хлорангидридов карбоновых кислот взаимодействием низшей алифатической кислоты с неорганическим оксогалогенидом при катализе диметилформамидом, отличающийся тем, что в качестве оксогалогенида используют хлорокись фосфора и процесс ведут в условиях кипения реакционной смеси при мольном отношении кислота хлорокись фосфора диметилформамид 1 0,67 (0,25 0,33).
Источник

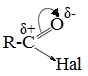
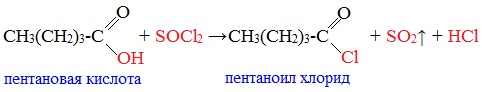
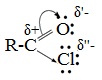

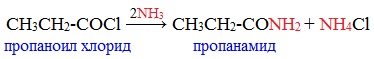
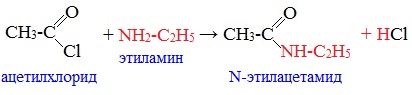
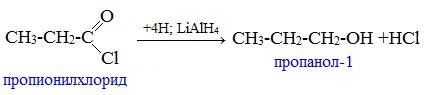

 Ирританты – группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).
Ирританты – группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).


