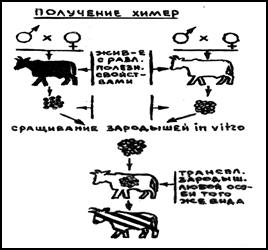
Получение химерных и трансгенных животных
Большое значение генная инженерия имеет в зоотехнической практике для получения химерных и трансгенных животных. Слово «химера» или генетический мозаик. Используется для описания организмов, которые получены из генетически различных клеточных популяций. С генетической точки зрения химеры — это продукт объединения двух и более ранних эмбрионов, которые обладают сложным комбинированным генотипом. Химерных животных получают путём слияния четырёх половинок двух разных 5-дневных эмбрионов. Так был получен химерный бычёк в 1984 году (♀ швицкая + ♂ бурая немецкая и ♀ голштинская + ♂ голштинская). Масть у этого телёнка была как у швицкой и голштинской пород, это уже доказывает наличие химеризма. Химеры широко используются для изучения процесса реализации генома в фенотипе животных. В 1983 году впервые были получены межвидовые химеры овцы и козы, хотя они не относятся к близким видам и между собой не скрещиваются. Преодолеть биологическую нескрещиваемость между видами и создание новых форм животных можно с помощью переноса генов. Если рекомбинантная конструкция гена интегрировалась в геном другого животного, то такой ген называется трансген. Животные, которые содержат в своём геноме трансгены называюттрансгенными. Если животные передают своему потомству трансгены, то образуются родственные группы трансгенных животных или трансгенных линий. Зигота является хорошим объектом для введения гена в генетическую структуру млекопитающих. Так в 1982 году впервые удалось интегрировать в геном линии ген гормона роста крысы. У трансгенных мышат наблюдалась повышенная интенсивность роста по сравнению с контрольными мышатами. Таких трансгенных животных назвали супермышатами, так как они превышали по живой массе нормальных животных в 2 раза.
В Австралии была получена трансгенная овца. Для этого в зиготу овцы был введён ген кодирующий гормон роста овцы. Эмбрион был возвращён в полость матки животного. Через три года полученная трансгенная овца в 1,5 раза превосходила по живой массе обычных овец. Цель таких опытов состоит в том, чтобы создать интенсивно растущих трансгенных овец с высокой шерстной продуктивностью. В настоящее время получены трансгенные кролики, свиньи, овцы, крупный рогатый скот.
В животноводческой практике большой интерес представляет пересадка клеточных ядер одного животного в цитоплазму другого. Такие животные получили названиегибриды. Однако такие опыты проводятся только на мышах, на других видах пока не дали положительных результатов.
В настоящее время на земном шаре население составляет 6 млрд. человек, а через 50 лет 12 млрд. и будет испытывать острую нехватку традиционного продовольствия. Все традиционные площади освоены и увеличить пропорционально поголовье скота вряд ли удастся, но в тоже время потери урожая от вредителей и сорняков колоссальны. Поэтому, начиная с 1980 года американские учёные стали проводить исследования по созданию генетически модифицированных источников (ГМИ). Наряду с селекцией культурных растений которая длится 15-25 лет с помощью ГМИ такие растения удалось получать вдвое быстрее, при этом придавая им ряд заданных качеств. Все работы проводятся на уровне генной инженерии. Из организма одного вида выделяют ген, отвечающий за синтез белка и фермента с необходимыми свойствами и вносят его в генный набор другого вида. Чтобы уничтожить сорняки нужно применять гербициды, однако они накапливаются у растений. Учёные нашли агробактериальный фермент, который не чувствителен к яду, и с помощью генной инженерии создали сорта кукурузы и пшеницы, которые не чувствительны к яду гербицида. Картофель страдает от колорадского жука, потери которого в отдельные годы составляют до 50%. В растения картофеля ввели ген, который был выделен из бактерий и этот ген синтезирует белок токсичный для жизни, но безвредный для человека.
Первые продукты питания полученные с помощью генной инженерии на мировом рынке появились в 1992 году, после 1,5 летнего изучения пищевой её безопасности врачи установили, что вредных последствий на организм человека не установлено. Вопрос об использовании трансгенных продуктов является спорным и требует глубокого изучения. С 2000 года у нас вводится маркировка всех трансгенных продуктов.
Дата добавления: 2018-11-25 ; просмотров: 1050 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
И получение химерных животных



Одним из перспективных направлений микроманипуляций на ранних эмбрионах является искусственное получение химер, или генетических мозаиков.
Понятие химера (греч.Chimaira) означает составное животное. Сущность биотехнологического метода получения химер заключается в искусственном объединении с помощью микрохирургических манипуляций эмбриональных клеток двух (и более) животных, относящихся к разным породам и даже видам. Таким образом, животные – химеры несут в одном организме признаки обоих эмбрионов, отличающихся между собой разными генотипами (рис. 9.8).
Рис. 9.8. Получение химер (генетических мозаиков)
Принято считать, что успешная пересадка эмбрионов может быть осуществлена только между самками одного вида. Пересадка эмбрионов, например, от овец к козам и наоборот, сопровождается их приживляемостью, но не завершается рождением потомства. Во всех случаях межвидовых беременностей непосредственной причиной абортов является нарушение функции плаценты по причине иммунологической реакции материнского организма на инородные антигены плода. Эта несовместимость может быть преодолена получением химерных эмбрионов с помощью микрохирургии.
Первый подход по получению химер основан на получении химерные животные путём объединения бластомеров из эмбрионов одного вида. С этой целью получали сложные химерные эмбрионы овец объединением 2-, 4-, 8-клеточных эмбрионов. Каждый сложный объединённый эмбрион состоял из равного числа бластомеров эмбрионов 2-8 родителей. Пересадку внутренней клеточной массы каждого донора (бластомеры) путём инъекции переносили внутрь бластоцисты реципиентов.
При этом общее число клеток колебалось от четырёх до восьмикратного увеличения нормального числа клеток. Эмбрионы вводили в перевязанные лигатурой яйцеводы овец до развития до стадии бластоцисты. Нормально развивающиеся бластоцисты пересаживали реципиентам и получали живых ягнят, большинство из которых оказались химерными по данным анализа крови и внешним признакам.
Второй подход по получению химер основан на слиянии клеточной массы двух или нескольких эмбрионов внутри одной зоны пеллюцида. Этим методом можно получать агрегационные химеры.Метод состоит в том, что 8-клеточные эмбрионы инкубируют в среде с протеолитическим ферментом, переваривающим оболочки яйцеклетки. Освобождённые от оболочек эмбрионы соприкасаются между собой, в результате чего их клетки сливаются иперемешиваются. Искусственное получение химер началось с середины 70-х годов (М. Ларен, 1976). В животноводстве известны искусственные химеры как внутривидовые, так и межвидовые.
В Германии получены агрегационные химерные животные после соединения половинок 5-6 дневных эмбрионов от коров-доноров швицкой и голштинской пород крупного рогатого скота. Из семи полученных телят у пяти отсутствовали признаки химеризма, а два сочетали в своём фенотипе характерную масть двух исходных пород – бурую и чёрно-пёструю.
Животные-химеры несут в себе признаки обоих эмбрионов, то есть являются потомками не двух, а четырёх родителей. В 1993 году такой четырёхродительский химерный телёнок был получен в результате слияния эмбрионов двух подвидов крупного рогатого скота Bos Taurus и Bos indicus. Но при иммунологическом анализе у него был обнаружен эритроцитарный антиген, характерный для подвида Bos Taurus.
В университете штата Калифорния получены химеры овцы пород рамбулье и финский ландрас (Дж. Батлер и др. 1985). Однако из 15 полученных ягнят только у 5 методом анализа групп крови подтвердился химеризм.
Свои особенности наблюдаются и при получении межвидовых гибридов. Межвидовые химеры – эмбрионы после пересадки эмбрионов приживляются лишь в 10% случаев. Примером получения межвидовых химер в животноводстве служат овцекозы, сочетающие признаки овцы и козы (К. Файл и др., 1994; С. Майнике-Тилмани, Б. Майнике, 1994).
Авторы отмечают, что химерные животные не передают потомству характерную для них генетическую мозаичность. Подобно гетерозиготным или гибридным животным у потомков происходит расщепление, в результате чего нарушаются ценные генетические комбинации.
Хотя химерные животные поддерживают ценные хозяйственно полезные признаки лишь на протяжении одного поколения в скотоводстве, они могут представлять большой практический интерес. Он заключается в создании животных, сочетающие важные хозяйственно-полезные признаки, как, например, мясную и молочную продуктивность, которые являются антагонистами и трудносовместимы в одном животном.

В ближайшей перспективе упрощение биотехнологии получения химер существенно расширит возможность трансплантации эмбрионов и поднимет её на новую, более качественную ступень.
Источник
3. Химеры животных
3. Химеры животных
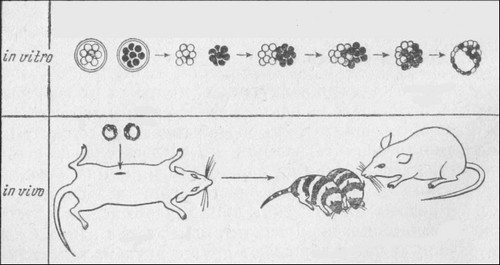
Техника получения химерных, или, как их еще называют, аллофенных, зародышей сейчас лучше всего освоена на млекопитающих. Этому способствует отсутствие у них ооплазматической сегрегации и, следовательно, полное равенство всех клеток на ранних стадиях. Два зародыша на стадиях двух — восьми бластомеров, извлеченных из мышей разных генетических линий (часто используют линии с разной окраской шерсти), помещают в капельку питательной среды и сближают друг с другом, так что они сливаются в один зародыш. Затем химерный зародыш переносят в матку третьей мыши, в которой и происходит его развитие. В большом проценте случаев из таких составных зародышей развиваются и рождаются совершенно нормальные мышата, состоящие из клеток двух линий. Если эти линии различались по окраске шерсти (например, черные и белые), то шкурка этих мышат будет содержать полосы черного и белого цвета.
Другой способ получения химер называется инъекционным. В этом случае используют более поздний зародыш, содержащий около ста клеток и представляющий собой полый пузырек — бластоцисту, в которой только несколько клеток — зародышевый узелок или внутренняя клеточная масса — дадут начало самому эмбриону. В такую бластоцисту инъецируют клетки зародыша другой линии. Часть этих клеток прилипает к зародышевому узелку и включается в состав развивающегося эмбриона.
При обоих методах клетки двух линий мышей распределяются в зародыше совершенно случайно, и поэтому полосы разного цвета у химерных мышат располагаются также случайно. Тем не менее американской исследовательнице Минц удалось при изучении сотен таких мышат показать, что в распределении полос того или иного цвета по шкурке есть некоторая закономерность. Существенно уже то, что окраска образует полосы, а не пятна или точки. В черный или белый цвет может быть окрашена та или иная из 17 поперечных полос, причем отдельно для правой или левой стороны головы, для спины и хвоста, т. е. всего таких полос может быть 34. Каждая из этих полос может быть белой или черной с равной вероятностью. Легко подсчитать, что в этом случае из десятков аллофенных мышат трудно встретить двух одинаково окрашенных.
Из этих опытов Минц сделала важный вывод о том, что в тот момент развития, когда пигментные клетки детерминировались, их было всего 34. Далее каждая из них в результате ряда делений образовала популяцию пигментных клеток, которые перемещались очень ограниченно, только вдоль узкой зоны кожи, идущей от хребта к животу, и каждая из них определила окраску одной полосы. Однако провести такой же анализ клеток пигментного эпителия глаза оказалось невозможно: в ходе развития черные и неокрашенные клетки перемешиваются и группу пигментированных клеток нельзя считать потомством одной первично-детерминированной клетки. Опыты с химерами позволили получить и другие интересные данные, хотя их интерпретация не всегда может быть однозначной.
Пол восьмиклеточных зародышей в момент их слияния друг с другом неизвестен, и поэтому в 50 % случаев возникают химеры, состоящие из смеси женских клеток с двумя Х-хромосомами (XX) и мужских клеток с половыми хромосомами (XY). Оказалось, что чаще, хотя и не всегда, пол таких химер мужской, причем нередко возникают гермафродиты, у которых одна половая железа мужская, а другая — женская. Можно думать, что пол железы определяется случайно возникающим соотношением в ней клеток с XX- и XY-генотипами, причем XY-клетки оказывают более сильное влияние.
У химерных мышей в крови присутствуют эритроциты обеих линий, но оказалось, что доля эритроцитов одной из линий мышей (С57В1) всегда больше, чем другой (СЗН). Очевидно, способность кроветворных клеток к размножению у разных линий мышей различна. Зато в печени у этих химер преобладают клетки линии СЗН.
Кровь химерных мышей содержит лимфоциты обеих линий, которые толерантные (совместимы) с тканями обеих линий. Это означает следующее: кусочки кожи линии С57В1, пересаженные на тело мыши СЗН, быстро отторгаются. He толерантны и обратные пересадки с СЗН на С57В1. Ho кусочки кожи обеих «родительских» линий мышей хорошо приживаются на химерных мышах, полученных из этих двух линий. Мы вернемся к вопросу о тканевой совместимости в главе об иммунитете.
Очень интересны химеры в отношении их способности к образованию опухолей. Так, линия мышей АКР отличается высокой частотой опухолей лимфатической ткани — лимфом, а линия СЗН — опухолей печени — гепатом. У химер между этими линиями возникают и те и другие опухоли, причем лимфомы всегда образуются из клеток АКР, а гепатомы — из СЗН. Создается впечатление, что опухоли возникают совершенно автономно от остального организма и определяются только генотипом клеток. Однако если получать химеры различных высокораковых линий с низкораковой линией СВА, то частота образования опухолей заметно снижается. Механизм этого важного явления пока непонятен.
Особо следует остановиться на опытах с инъекционными химерами, когда в бластоцисту вводили клетки особой опухоли — тератокарциномы. Эту опухоль можно получить искусственно, если пересадить нормальный зародыш какой-либо линии мышей под кожу взрослой мыши и потом регулярно переносить растущий трансплантат от мыши к мыши. В результате возникает тератокарцинома — перевиваемая опухоль, в центре которой находятся быстро размножающиеся недифференцированные клетки, а по периферии образуются участки самых различных дифференцированных тканей. Но при инъекции в бластоцисту центральной части такой опухоли ее клетки входят в состав зародыша и перестают быть опухолевыми. Они ведут себя как обычные химеры, т. е. становятся нормальными клетками различных органов взрослой мыши. Вероятно, это первый пример того, как опухолевые клетки под влиянием эмбриональных тканей превращаются в нормальные клетки организма. Однако потомство с генотипом опухолевой линии от этих химерных мышей получить пока не удалось. Клетки тератокарциномы, являясь опухолевыми, сохраняют большие потенции и могут дифференцироваться во многих направлениях, но способность образовывать нормальные половые клетки ими, вероятно, все же утрачивается. Особые химеры были получены в нашей стране Н. Г. Хрущовым. Облученной мыши, чьи кроветворные клетки были убиты, в кровяное русло вводили клетки костного мозга или селезенки крысы. У мыши образовывались кроветворные колонии крысиных клеток. Их судьбу и дальнейшие превращения было легко проследить благодаря особенностям мышиных и крысиных клеток, легко различимым под микроскопом.
У дрозофилы химеры создаются при инъекции эмбриональных ядер одной линии мух в оплодотворенное яйцо другой линии, имеющее свои ядра. Судьба инъецированных ядер зависит от места их введения. На заднем конце яйца они становятся половыми клетками. В других частях яйца они попадают в ту или иную область поверхностной цитоплазмы и соответственно образуют клетки, входящие в состав тканей личинки или взрослой мухи. При этом они сохраняют отличительные особенности своей генетической линии. Сходный результат получают и при инъекции в яйцо ядер из некоторых многократно перевиваемых культур клеток дрозофилы, но половые клетки при этом не образуются. Очень важно, что при некоторых обстоятельствах клетки еще не теряют способности к дифференцировке, но уже не могут образовать половые клетки. Это заставляет взглянуть на зародышевый путь не как на полезную абстракцию, а как на определенную реальность.
В этой главе мы старались показать, как различные способы гибридизации создают комбинации двух генотипов и цитоплазмы или комбинации клеток с разными генотипами. Возможности, которые открывают эти методические подходы, еще не исчерпаны, и работа в этих направлениях (особенно с соматическими гибридами и с химерами) активно продолжается. Гибридизация животных и растений уже привела к огромным практическим достижениям в получении новых пород и сортов. Можно ожидать, что и методы «клеточной инженерии» дадут не только важные теоретические, но и чисто практические результаты.
Слияние ранних зародышей приводит к появлению аллофенных мышей (химер)
Эмбрионы мышей разных линий (например, с черной и белой окраской) на стадии восьми клеток извлекают из материнских организмов, освобождают от оболочек и сближают. При этом образуется один зародыш смешанного происхождения. Его пересаживают в третью мышь — «мать-воспитательницу», которая и рождает химерных мышат
Источник