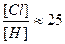- Получение HCl
- Урок №19. Соляная кислота и её соли
- Соединения хлора
- Хлороводород, соляная кислота (HCl)
- Хлорноватистая кислота (HClO) и ее соли
- Хлористая кислота (HClO2) и ее соли
- Хлорноватая кислота (HClO3) и ее соли
- Хлорная кислота (HClO4) и ее соли
- Оксид хлора (I), оксид дихлора ( Cl2O)
- Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
- Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
- Оксид хлора (VII) (Cl2О7)
Получение HCl
Хлороводород в промышленности получают либо прямым синтезом из хлора и водорода, либо из побочных продуктов при хлорировании алканов (метана). Мы будем рассматривать прямой синтез из элементов.
HCl – бесцветный газ с резким, характерным запахом
t°пл= –114,8°C, t°кип= –84°C, t°крист= +57°C, т.е. хлороводород можно получать при комнатной температуре в жидком виде, увеличивая давление до 50 – 60 атм. В газовой и жидкой фазе находится в виде отдельных молекул (отсутствие водородных связей). Прочное соединение Есв= 420 кДж/моль. Начинает разлагаться на элементы при t>1500°C.
2HCl 
Эффективный радиус HCl = 1,28 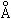
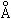
RCl — = 1,81 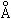
Хлороводород хорошо растворим в воде в любых соотношениях (в одном объеме H2O расторяется до 450 объемов HCl), с водой образует несколько гидратов и дает азеотропную смесь – 20,2% HCl и t°кип= 108,6°C.
Образование хлороводорода из элементов:
Смесь водорода и хлора при освещении взрывается, что указывает на цепной характер реакции.
В начале века Баденштейн предложил следующий механизм реакции:
Инициирование: Cl2 + hν → ē + Cl2 +
Обрыв цепи: Cl + + ē → Cl
Но ē в сосуде обнаружен не был.
В 1918 г. Нернст предложил другой механизм:
Инициирование: Cl2 + hν → Cl• + Cl•
Цепь: Cl• + H2 → HCl + H•
Обрыв цепи: H• + Cl• → HCl
В дальнейшем этот механизм получил дальнейшее развитие и дополнение.
1 стадия – инициирование
реакция Cl2 + hν → Cl• + Cl•
Инициируется фотохимическим путем, т.е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
– количество прореагировавших молекул приходящихся на 1 квант света.
γ в обычных фотохимических реакциях ≤1. Однако в случае цепных реакций γ>>1. Например, в случае синтеза HCl γ=10 5 , при распаде H2O2 γ=4.
Если молекула Cl2 поглотила квант света, то она находится в возбужденном состоянии
10 -8 -10 -3 сек и, если полученной с квантом света энергии хватило для превращения, то происходит реакция, если нет, то молекула снова перейдет в основное состояние, либо с испусканием кванта света (флуоресценция или фосфоресценция), либо электронное возбуждение конверсируется в энергию колебания или вращения.
Посмотрим, что происходит в нашем случае:
Еобр HCl = 432,82 кДж/моль – без облучения реакция не идет.
Квант света имеет энергию Екв = 41,1*10 -20 Дж. Энергия, необходимая для начала реакции (энергия активации) ровна энергии, затраченной диссоциацию молекулы Cl2:
В отличие от катализа, при котором потенциальный барьер снижается, в случае фотохимических реакций он просто преодолевается за счет энергии кванта света.
Еще одна возможность инициирования реакции – добавление паров Na в смесь H2+Cl2. Реакция идет при 100°C в темноте:
Na + Cl2 → NaCl + Cl•
и образуется до 1000 HCl на 1 атом Na.
2 стадия – продолжение цепи
Реакции продолжения цепи при получении HCl бывают следующих типов:
1. Cl• + H2 → HCl + H• Ea=2,0 кДж/моль
2. H• + Cl2 → HCl + Cl• Ea=0,8 кДж/моль
Это звенья цепи.
Скорость данных реакций можно представить следующим образом:
Т.к. энергии активации этих реакций малы, то их скорости велики. Цепи в данном случае неразветвленные, а по теории неразветвленных цепей:
Wразвитие цепи = Wициируется фотохимическим путем, т.е. путем поглощения кванта светаобрыва,
тогда, если считать, что обрыв квадратичен:

в данном случае W1 =W2, т.к.цепи достаточно длинные (из теории цепных реакций)
Данное кинетическое уравнение справедливо в отсутствие примесей в смеси H2 + Cl2. Если в систему попадет воздух, то кинетическое уравнение будет иное. В частности
Wобр = K[Cl•], т.е. не квадратичный обрыв и ход процесса полностью меняется.
Т.к. есть вещества, являющиеся ингибиторами цепных реакций. Ингибитором реакции образования HCl является кислород:
Этот радикал малоактивен и может реагировать только с таким же радикалом, регенерируя кислород
Расчеты показывают, что в присутствии 1% O2 реакция замедляется в 1000 раз. Еще более сильно замедляет скорость процесса присутствие NCl3, который замедляет реакцию в 10 5 раз сильнее, чем кислород. Т.к. хлорид азота может присутствовать в хлоре в процессе его получения в промышленности, необходима тщательная очистка исходного хлора перед синтезом HCl.
Механизм действия NCl3:
и восстановление Cl• идет чрезвычайно медленно и идет процесс
3 стадия – обрыв цепи
Представление Нернста о механизме обрыва цепи при тщательном исследовании не подтвердилось.
В данном случае возможно 3 способа рекомбинации радикалов:
1. Cl• + Cl• +М → Cl2 + М
2. H• + H• + М → H2 + М
3. H• + Cl• + М → HCl + М

Отсюда , что при t
600°C и [Cl2] ≈ [H2] (условия синтеза HCl), дает
Следовательно, скорость рекомбинации по 1 будет в 25 раз выше, чем по 3 и в 625 раз, чем по 2, т.е. процессами 2 и 3 можно практически пренебречь.
Дата добавления: 2015-06-17 ; просмотров: 4594 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Урок №19. Соляная кислота и её соли
Соляная кислота
Физические свойства:
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) реагирует с металлами , стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl 2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg 2 Cl 2 — каломель — не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl 2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl 2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Источник
Соединения хлора
Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
- Синтез из простых веществ:
- Образуется как побочный продукт при хлорировании углеводородов:
R-H + Cl2 = R-Cl + HCl
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
- при слабом нагревании
- при очень сильном нагревании
Физические свойства хлороводорода
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
- реагирует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода Н:
- взаимодействует с основными и амфотерными оксидами:
- реагирует с основаниями и амфотерными гидроксидами:
- Вступает в реакцию с аммиаком:
- взаимодействует с солями более слабых кислот:
- Реагирует с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. При этом анион Cl — окисляется до свободного хлора:
2Cl — — 2e — = Cl2 0
- Качественная реакция – взаимодействие с растворимыми солями серебра с образованием белого творожистого осадка хлорида серебра:
- С органическими соединениями
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
- Диспропорционирование хлора в холодной воде:
- Реакция гипохлоритов с диоксидом углерода и водой :
Химические свойства хлорноватистой кислоты:
- Несмотря на то, что хлорноватистая кислота HClO –слабая кислота, она является сильным окислителем, особенно в кислой среде. При этом хлор хлорноватистой кислоты восстанавливается до степени окисления -1.
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
- на свету хлорноватистая кислота разлагается:
- Как кислота реагирует с сильными основаниями:
HClO + KOH → KClO + H2O
- Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
- Разложениегипохлоритов при нагревании:
- Кислоты, более сильные, чем хлорноватистая вытесняют гипохлориты из солей:
NaClO + 2HCl → NaCl + Cl2 + H2O
- Взаимодействуют с другимисолями, если продуктом является слабый электролит:
Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
- Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
- Вступает в реакциис щелочами с образованием хлоритов:
- При длительном хранении разлагается:
Соли хлористой кислоты – хлориты
- разлагаются при нагревании:
- реагируют с сильными кислотами:
- являются слабыми восстановителями и сильными окислителями в кислой среде:
Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
- Взаимодействует с щелочами с образованием хлоратов:
- Окисляет некоторые вещества:
- Разлагается при слабом нагревании:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
- Хлораты сильные окислители.
- хлорат калия (бертолетова соль) при нагревании разлагается диспропорционируя на хлорид и перхлорат калия:
- В присутствии оксида марганца (IV) в качестве катализатора хлорат калия разлагается с выделением кислорода:
Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
- Как сильная кислота вступает в реакции с щелочами с образованием перхлоратов:
- Как сильный окислитель окисляет многие вещества:
- Хлорная кислота является неустойчивой и разлагается при умеренном нагревании:
Химические свойства солей хлорной кислоты – перхлоратов:
- Перхлораты также являются сильнымиокислителями
- Взаимодействуют с сильными кислотами:
- При нагревании более 550ºС разлагаются:
Оксиды хлора
Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
- Имеет кислотные свойства. Реагирует с водой, щелочами:
- Является сильным окислителем:
- При температуре выше 20ºС или на свету разлагается:
Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
- ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
- Разлагается в концентрированной хлороводородной кислоте:
- Проявляет окислительно-восстановительные свойства:
Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
- В обычных условиях постепенно разлагается на ClO2 и О2:
- ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
- При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
- При взаимодействии Cl2О7 с щелочами образуются перхлораты:
- При нагревании разлагается:
Источник