- Получение гипохлорита натрия электролизом поваренной соли
- Технологическая линия для получения ГПХН из поваренной соли
- Характеристики получаемого вещества
- Применение продукта
- Процесс получения гипохлорита натрия электролизом поваренной соли
- Преимущества способа в сравнении с другими методами
- Плюсы использования установок для получения гипохлорита натрия
- Электролизные установки для водоканалов и предприятий
- Сотрудничество с компанией «ГИДРАВЛИЧЕСКИЙ ИНСТРУМЕНТ»
- Чистая вода — дело техники!
- 1. Общие сведения
- 2. Производство ГПХН с мембранным разделением электродного пространства
- 3. Производство ГПХН без мембранного разделения электродного пространства
- 4. Влияние межэлектродного расстояния на процесс получения ГПХН
- 5. Непроточные установки получения ГПХН
Получение гипохлорита натрия электролизом поваренной соли
Компания «ГИДРАВЛИЧЕСКИЙ ИНСТРУМЕНТ» на протяжении долгого времени занимается производством средств механизации с гидравлическим приводом в России. Одно из направлений – установки для получения гипохлорита натрия. Для изготовления решений мы используем собственные проекты, качественные материалы и современные технологические линии, что позволяет поставлять клиентам высококлассное оборудование, соответствующее индивидуальным эксплуатационным требованиям.
Также для клиентов компании предусмотрены выгодные условия сотрудничества: низкие цены, разные формы оплаты, доставка оборудования по всем городам России. Для консультации или помощи в выборе средств механизации свяжитесь с сотрудниками компании по телефону, через онлайн-форму или другим удобным для вас способом.
Технологическая линия для получения ГПХН из поваренной соли
Система предназначена для производства гипохлорита натрия с большей эффективностью и более высоким качеством, чем с помощью периодических или непрерывных методов. Процесс универсален и обладает конструктивной способностью доводить любую концентрацию раствора гипохлорита натрия от 20 до 200 граммов на литр доступного хлора.
Установка изготовлена из высококачественных компонентов для обеспечения длительного срока эксплуатации при минимальном техническом обслуживании. Оборудование устроено таким образом, что для охлаждения раствора нет необходимости использовать механические способы. Для производства ГПХН путем электролиза поваренной соли потребуется:
- Мягкая вода – морская или минерализованная.
- Пищевая поваренная соль (не йодированная, либо «Экстра»).
- Подключение к источнику питания – стандартному 220 В, либо 380 В.
Спецификации стандартного оборудования:
- Удельное потребление соли – 1.8 килограмма на 2.3 кг.
- Степень конверсии — до 99,9 процентов (соль в хлор).
- Содержание активного хлора в гипохлорите – до 8 грамм на литр.
Устройство размещено в раме из конструкционной стали, поэтому может быть полностью изготовлено на нашем заводе и доставлено как единое целое на ваш объект. Технологические системы могут быть разработаны для использования жидкости или паров хлора из электролизеров. Стандартные системы предназначены для получения концентраций от 125 до 200 граммов на литр хлора с производительностью от 40 до 150 галлонов в минуту.
Характеристики получаемого вещества
ГПХН – соединение, используемое для дезинфекции и очистки воды. Применяется для обработки поверхностей, отбеливания, удаления запаха и обеззараживания. Получают его двумя основными методами:
- Добавление соли в водный раствор с последующей электризацией.
- Добавление хлора в газообразном состоянии к каустической соде.
Первый метод уникальный. Он использует влажный пар хлора и гидроксид натрия, полученные непосредственно из хлор-щелочи. Таким способом можно безопасно производить высококачественное сырье при минимальных эксплуатационных расходах.
Завод оснащен многочисленными предохранительными устройствами, которые предназначены для отключения системы в случае нарушения технологического процесса. Система полностью автоматизирована и требует только внимания оператора при появлении сигналов о нарушениях технологического процесса. Установки доступны с различной производительностью.
Применение продукта
Раствор имеет обеззараживающий и дезинфицирующий состав, поэтому используется для уничтожения болезнетворных микроорганизмов. Основными тремя сферами применения сырья являются следующие:
- Медицина;
- Легкая промышленность;
- Сфера услуг.
Часто раствор применяется для обеззараживания воды в бассейнах, обработки различных тканей и поверхностей.
Процесс получения гипохлорита натрия электролизом поваренной соли
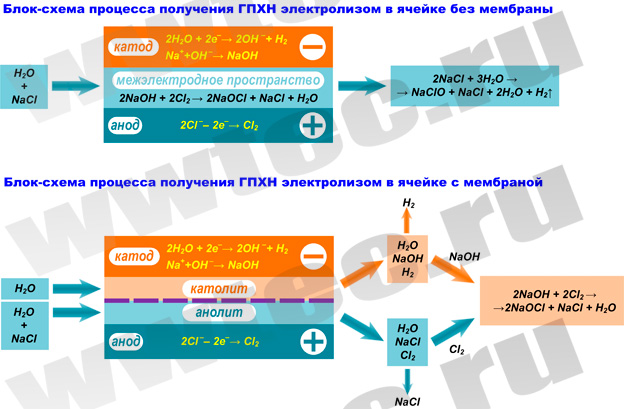
Получение гипохлорита натрия путем электролиза поваренной соли возможно двумя способами: с применением мембранного разделения катодного и анодного пространства и без.
Первый способ: в электролизной установке происходит отделение анодного и катодного пространства катион-проницаемой мембраной. В анодный резервуар подается раствор поваренной соли, а в катодный – вода. На катоде происходит разложение воды на ионы гидроксила и водород (под действием электротока). На аноде происходит окисление хлоридов до молекул хлора. Дальше катионы натрия переходят в католит (катодное пространство), где происходит образование едкого натрия. Потом анолит отправляется в сепаратор, где происходит конечное отделение хлора с перенаправлением в реактор, содержащий едкий натрий и водород, после чего образуется ГПХН.
Второй способ: метод прямого электролиза. Более простой и распространенный. Здесь в качестве электролизера выступает емкость, куда помещаются анод и катод. Гидрооксид натрия взаимодействует с хлорной и хлорноватистой кислотами, в результате чего образуется хлорид и гипохлорит натрия.
Преимущества способа в сравнении с другими методами
Преимуществом использования системы электролиза поваренной соли является безопасность. Не требуется транспортировка или хранение. При длительном хранении химикат становится неактивным.
- Экологическая безопасность.
- Соответствие рекомендациям в области защиты окружающей среды.
- Отсутствие необходимости хранения большого объема обеззараживающих веществ.
- Минимальные требования к содержанию поваренной соли (сухой и теплый склад).
- Полный контроль концентрации активного вещества при получении раствора ГПХН.
При других методах получения гипохлорита натрия образуется газообразный водород, который является взрывоопасным. Для предотвращения эксполяции необходимо оборудовать специальную вентиляционную систему. Обычно она работает медленно, поэтому необходимо использовать буфер дополнительной хлорной кислоты. Обслуживание и приобретение электролизной системы намного безопаснее.
Плюсы использования установок для получения гипохлорита натрия
Производители химических средств, использующие непрерывную систему нашего изготовления, значительно сократят количество человеко-часов, необходимых для получения стандартного объема сырья, по сравнению с другими производственными процессами. За всем сможет следить 1 оператор. К другим преимуществам нашего оборудования относится следующее:
- Система обеспечивает значительную экономию затрат на сырье благодаря 100% эффективности.
- Благодаря чрезвычайно высокой производительности установки достигается значительная экономия за счет использования меньшего количества сырья. Остаточные уровни могут быть снижены, а качество конечного продукта повышено.
- Тип охлаждения обеспечивает значительную экономию ресурсов.
Срок производства оборудования определяется индивидуально, поскольку зависит от индивидуальных эксплуатационных характеристик. После изготовления системы полностью проверяются и тестируются. Мы также производим монтаж и пуско-наладку, обучение сотрудников клиента. По интересующим вопросам можете связаться с нашими консультантами.
Электролизные установки для водоканалов и предприятий
Электролизные установки для получения ГПХН из поваренной соли позволяют решить задачи, стоящие перед водоканалом и предприятиями, работающими с водоснабжением. Следует в первую очередь выделить безопасность технологического процесса. Поскольку гипохлорит натрия производится на месте, нет необходимости хранить хлор – опасное для здоровья окружающих вещество. Конструктивно установка состоит из следующих элементов:
- Электролизеры, оснащенные электродными блоками;
- Резервуары для приготовления раствора;
- Насос для дозирования;
- Трубы и фитинги;
- Выпрямитель.
Оборудование поставляется комплектно на стальной раме и собирается на месте. Процесс монтажа занимает около 6-8 часов.
Сотрудничество с компанией «ГИДРАВЛИЧЕСКИЙ ИНСТРУМЕНТ»
Наша компания много лет занимается производством эффективных технологических линий для различных отраслей промышленности. За это время мы завоевали репутацию надежного партнера и ответственного исполнителя, но не останавливаемся на достигнутом, постоянно ставя новые цели. Сотрудничество с компанией «ГИДРАВЛИЧЕСКИЙ ИНСТРУМЕНТ» имеет массу преимуществ, среди которых:
- Изготовление средств механизации в кратчайшие сроки на заказ.
- Низкие цены на все виды оборудования.
- Оперативная поставка установок по России.
- Качественное техническое обслуживание оборудования.
- Гарантия от 1 года.
Индивидуальное производство осуществляется по проекту клиента в соответствии с технологическими требованиям к эксплуатации системы. Срок изготовления зависит от конструктивных особенностей установки. По всем интересующим вопросам можете связаться с нашими сотрудниками в любое время.
Источник
Чистая вода — дело техники!
БИБЛИОТЕКА ЗНАНИЙ МВТ
БИБЛИОТЕКА ЗНАНИЙ МВТ
ГИПОХОРИТ НАТРИЯ. ПРОЦЕСС ПОЛУЧЕНИЯ
(автор: Ген.директор компании «МИРОВЫЕ ВОДНЫЕ ТЕХНОЛОГИИ» — С.В.Черкасов)
1. Общие сведения
Производство гипохлорита натрия (ГПХН) осуществляют методом электролиза раствора хлористого натрия NaCl (поваренной соли). При этом используют два пути получения конечного продукта: с применением мембранного разделения катодного и анодного (электродного) пространства электролизера и без такого разделения. В зависимости от этого процесс получения ГПХН происходит по различным схемам:
2. Производство ГПХН с мембранным разделением электродного пространства
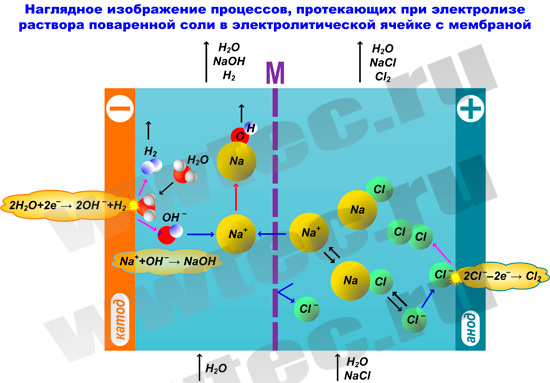
В мембранной электролизной установке анодное и катодное пространство отделяются друг от друга катион-проницаемой мембраной. При этом в анодную камеру подается раствор поваренной соли, а в катодную камеру – вода.
На катоде вода (H2O) под воздействием электрического тока разлагается на ионы гидроксила (OH – ) и водород (H2):
2Н2О + 2е – → 2ОН – + Н2
На аноде — хлориды (Cl – ) окисляются до молекулярного хлора (Cl2):
2 Cl – → Cl2 + 2 e – ↑
Под воздействием электрического тока катионы натрия (Na + ) диффундируют через мембрану, переходят в катодное пространство (католит) и взаимодействуют с анионами OH – , образуя при этом едкий натрий (NaOH):
Технологическая схема процесса производства ГПХН с использованием диафрагменного электролизера приведена на следующем рисунке:
Из электролизера анолит, содержащий молекулярный хлор и часть поваренной соли, которая не разложилась на аноде, направляется в сепаратор для отделения из него хлора. После отделения хлора в сепараторе происходит измерение плотности анолита и при помощи насоса-дозатора добавляется необходимое количество насыщенного раствора поваренной соли.
Выделенный из анолита хлор подается в реактор, где он вступает в реакцию с католитом, который содержит едкий натрий и водород, образуя ГПХН, который собирают в приемную емкость. Водород из реактора сбрасывается на «свечу» или в атмосферу при многократном разбавлении его воздухом. Для снижения энергозатрат в схеме устанавливают два рекуперационых теплообменника.
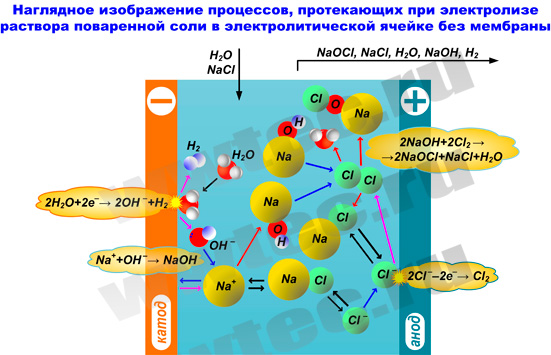
3. Производство ГПХН без мембранного разделения электродного пространства
Производство ГПХН прямым электролизом раствора поваренной соли (без мембранного разделения электродного пространства) является более простым и более распространенным методом. В этом случае электролизер выполняется в виде некоторой емкости (реактора), в которой размещаются электроды (катод и анод).
При прямом электролизе раствора хлорида натрия происходят следующие реакции:
на катоде:
2Na + + 2e – → 2Na;
2Na + 2H2O → 2NaOH + H2↑;
2Cl – — 2e – → Cl2;
Cl2 + H2O → HClO + HCl.
Получающийся в результате реакции гидрооксид натрия взаимодействует с хлорной и хлорноватистой кислотами, образуя соответственно хлорид и гипохлорит натрия. Суммарную реакцию можно записать следующим образом:
2NaCl + 3H2O → NaClO + NaCl + 2H2O + H2↑
Основным показателем процесса электролиза является выход по току целевого продукта (ГПХН), выражаемый в %,
где G и Gm – количество продукта, кг, фактически и теоретически получаемого при электролизе.
Количество продукта Gт, кг, которое теоретически должно выделиться на аноде при электролизе, может быть определено по закону Фарадея:
где, А – электрохимический эквивалент, г/(А·ч)
I – полный ток через электролизер, А
n – число работающих анодов
t – продолжительность работы электролизера, час
Таким образом, теоритически из 1,64 кг соли (NaCl) можно получить 1 кг гипохлорита натрия (NaClO). Однако помимо основной электрохимической реакции и на катоде, и на аноде протекают побочные реакции и вторичные процессы, снижающие выход по току ГПХН:
- электрохимическое окисление гипохлорита до хлората ClO3–:
6ClO – – 6е – → ClO3 – + 1,5О2 + 5Cl – ;
- химическая реакция разложения аниона гипохлорита:
2ClO – → О2 + 2Cl – ,
которая особенно активируема в присутствии загрязнений электролита железом, медью, никелем.
- восстановление гипохлорита и хлората на катоде:
ClO – + Н2O + 2е – → Cl – + 2ОH – .
Величина выхода по току (h ) является основным показателем любого процесса электролиза. Чем выше его значение, тем эффективнее протекает процесс электролиза, тем ниже энергетические затраты на получение единицы готового продукта. При высоких значениях h можно уменьшить требуемую площадь рабочей поверхности электродов для достижения заданной производительности, применить более компактные установки и снизить расходы на их изготовление. И хотя целевым продуктом процесса электролиза в нашем случае является ГПХН основным показателем процесса надо считать выход по току хлора.
На изменение выхода по току h влияет ряд факторов:
- величина напряжения на электролизере
Величина выхода хлора по току ГПХН сказывается в первую очередь на изменении затрат электроэнергии W, кВт-ч/кг, при получении гипохлорита натрия, которые могут быть подсчитаны по формуле:
W = I· U· t / G или W = U / A· h· n
где U – напряжение на токоподводящих электродах, В.
Выход по току гипохлорита увеличивается с возрастанием анодной плотности тока, так как в этих условиях затрудняется доступ ионов СlO – к аноду. При очень малых плотностях тока, отвечающих интервалу потенциалов +0,8 – 1,33 В, на аноде будет выделяться кислород, затем при достижении равновесного потенциала выделения хлора начнется совместное выделение кислорода и хлора, причем с ростом плотности тока выход по току хлора будет быстро возрастать. При плотностях тока около 1000 А/м 2 на выделение кислорода будет расходоваться всего несколько процентов тока. 

Повышая напряжение на токоподводящих электродах, мы увеличиваем силу тока. Таким образом, при сохранении максимально возможного значения выхода по току хлора можно увеличить (в определенных пределах) производительность установки без существенного отклонения энергетических затрат от минимальных.
- исходная концентрация электролита
Чем выше концентрация хлоридов, тем меньше перенапряжение выделения хлора, т.к. его равновесный потенциал сильнее сдвигается в электроотрицательную сторону. Следовательно, увеличение концентрации NaCl облегчает выделение хлора. С другой стороны, чем выше концентрация раствора NaCl, тем больше удельный расход поваренной соли на 1 кг гипохлорита натрия. Поэтому для практического использования концентрацию исходного раствора хлористого натрия выбирают в зависимости от требуемой концентрации гипохлорита натрия.
- степень использования раствора хлоридов
Технико-экономические показатели работы электролизера определяются не только затратами электроэнергии, но и достигаемой степенью использования исходного раствора поваренной соли, поскольку затраты на соль являются одной из главных статей расхода при производстве гипохлорита натрия.
Под степенью использования соли (процентом разложения) λ, %, понимают отношение концентрации активного хлора в растворе гипохлорита натрия, полученного в результате электролиза, к концентрации NaCl, вводимой в установку:
λ = (ССlакт / CNaCl) · 100,
где ССlакт – концентрация активного хлора в гипохлорите натрия, CNaCl – концентрация NaCl в электролите, г/л.
По мере увеличения концентрации активного хлора и растворе расход соли на получение единицы готового продукта снижается. Так, при электролизе раствора с концентрацией 100 г/л NaCl и достижении содержания активного хлора на выходе из электролизера 5 г/л расход соли составляет 20 г на 1 г готового продукта (5% – ое разложение). При содержании же хлора в растворе 10 г/л затраты на соль уменьшаются и составляют всего 10 г/л (10% – ое разложение).
Таким образом, для снижения расходов на соль предпочтительно ведение процесса электролиза при глубоком разложении NaCl. Однако увеличение степени использования поваренной соли приводит к росту энергетических затрат, поэтому должен быть найден какой-то оптимальный режим эксплуатации установки, при котором суммарные затраты на соль и электроэнергию будут минимальны.
- образование отложений на катодах
Еще одним фактором, влияющим на процесс электролиза раствора хлорида натрия и снижения выхода по току гипохлорита натрия, является образование на катодах отложений (чаще всего отложений солей жесткости).Рядом исследователей было установлено, что скорость образования осадков и их структура зависят от:
- плотности тока и времени поляризации – с увеличением плотности тока и времени поляризации обрастание катода происходит интенсивнее;
- химического состава раствора – с увеличением жесткости исходной воды и применении в качестве исходного сырья неочищенной (технической) поваренной соли скорость образования катодных отложений возрастает;
- состояния поверхности электродов – скорость «налипания» отложений снижается при применении электродов с более гладкой поверхностью. Наилучшие результаты достигаются при использовании полированных катодов.
Механизм образования отложений, по всей вероятности, следующий: в прикатодном пространстве первичным продуктом электрохимического процесса является щелочь, образующаяся в результате разложения воды. При наличии в растворе катионов Са 2+ и Mg 2+ происходит образование соответствующих гидроокисей, а в присутствии анионов СО3 2 – карбонатов. Первоначально на катоде появляются тонкая пленка и отдельные кристаллы, количество которых со временем увеличивается, и вся поверхность катода постепенно покрывается осадком. Толщина осадка непрерывно возрастает, и, в конце концов, межэлектродное пространство забивается отложениями, снижается сила тока, проходящего через электролизер, и уменьшается производительность установки.
Существует несколько технических приемов, применение которых предотвращает рост осадков на катодах:
- создание высокой линейной скорости движения жидкости относительно электродов;
- механическая очистка поверхности катодов;
- периодическая кислотная обработка поверхности катодов;
- «скалывание» осадков с катодов путем кратковременного изменения полярности электродов.
- характер движения электролита
Весьма существенное значение имеет характер движения электролита. Если прианодный слой электролита не нарушается, то в нем находится преимущественно слабо диссоциированная хлорноватистая кислота, а образование гипохлорита натрия происходит на некотором расстоянии от анода. В этом случае ионы СlO – могут поступать к аноду из глубины раствора только благодаря диффузии и электропереносу, поэтому при отсутствии перемешивания прианодного слоя в растворе может накапливаться гипохлорит натрия более высокой концентрации, чем это соответствует началу разряда ионов СlO – . Из всего перечисленного следует, что необходимо избегать механического перемешивания раствора.
Если в качестве катодного материала могут использоваться обычная сталь, графит, титан, то к анодам предъявляются особые требования.
Во-первых, аноды работают в условиях непосредственного контакта с химически активными веществами, поэтому основным требованием к материалу анода является их химическая устойчивость.
Во-вторых, для проведения процесса электролитического получения ГПХН с минимальными энергетическими затратами большое значение имеет материал анода. Материал анода должен способствовать разряду ионов Сl – , т.е. перенапряжение выделения хлора на нем должно быть наименьшим.
До 70-х годов предыдущего века для электролитического производства ГПХН наиболее широко применяли графитовые электроды, у которых главным недостатком является то, что они разрушаются в процессе электролиза, особенно в растворах хлоридов с невысокой концентрацией. Срок службы графитовых анодов в установках получения гипохлорита составляет не более 3–4 месяцев.
Поэтому графитовые аноды стали заменяться на титановые с активным покрытием из диоксидов рутения и титана, у которых срок службы более 12 месяцев. За рубежом такие аноды имеют аббревиатуру DSA (от англ., Dimensionally Stable Anodes, размерно стабильные аноды), в отечественной практике они более известны под торговой маркой «оксидные рутениево-титановые аноды» (ОРТА). Аноды типа ОРТА и их модификации в процессе эксплуатации не меняют своей формы и в первую очередь межэлектродного расстояния по отношению к противоэлектроду (катоду), чем «грешит» графит, отчасти из-за своей нестойкости. Титановую подложку анодов по мере срабатывания активного покрытия можно подвергать многократной регенерации и повторному нанесению активного покрытия. Это в условиях дефицитности и относительной дороговизны титана является немаловажным положительным фактором.
ОРТА (см. рис.) по сравнению с графитовыми обладают более высокими селективными и электрокаталитическими свойствами по отношению к основному процессу – выделению хлора на аноде, что дает возможность проводить электролиз до более глубокой степени конверсии поваренной соли и снижают ее удельный расход. Все это позволяет при всех прочих равных условиях ведения электролиза осуществлять процесс при более низком значении напряжения в реакторе и интенсифицировать его, используя более высокие анодные плотности тока. Если при использовании графитовых анодов электролиз можно провести при плотностях тока до 1,4 кА/м 2 , то при электролизе с ОРТА: 1,5 – 2 кА/м 2 (для сравнения на платино-титановых анодах можно достичь плотности тока 4 кА/м 2 ).Тем самым увеличивается выход конечного продукта с единицы поверхности анода и обеспечивается возможность выполнять конструкции электролизеров меньших габаритов при аналогичной производительности.
Основным недостатком ОРТА является их сравнительно высокая стоимость. Помимо этого ОРТА нельзя рекомендовать для использования в установках с периодическим изменением полярности электродов, поскольку в результате восстановления окислов на их поверхности образуется металлический рутений, который не стоек в условиях анодной поляризации.
- температура раствора электролита
Процесс окисления гипохлорита с последующим образованием хлоратов замедляется при понижении температуры раствора, поэтому электролиз целесообразно вести при низких температурах в интервале 20 – 25°С.
4. Влияние межэлектродного расстояния на процесс получения ГПХН
Теоритически, чем меньше величина межэлектродных зазоров, тем более эффективен энергетически процесс электролиза хлорида натрия.
Однако минимальная величина межэлектродных зазоров ограничена условием обеспечения протекания через них раствора хлорида натрия, а также технологическими возможностями выполнения плоских поверхностей пластинчатых электродов. Кроме того выяснено, что межэлектродное расстояние δ существенно не влияет на изменение величины h и другие параметры работы электролизера. Изменение величины δ при сохранении площади рабочей поверхности электродов сказывается только на производительности установки. При увеличении межэлектродного расстояния происходит пропорциональное снижение плотности тока i и соответственно снижение общего выхода гипохлорита натрия.
Экспериментально было обнаружено, что в интервале величин межэлектродных зазоров от 1 до 3 мм обеспечивается протекание раствора хлорида натрия между пластинчатыми электродами с минимально возможным гидравлическим сопротивлением. Кроме того, указанный межэлектродный зазор обеспечивает технологическую безопасность соприкосновения поверхностей электродов при изготовлении кассеты.
При использовании в электролизере не одной, а нескольких кассет необходимо учитывать, то, что наличие значительно между электродными кассетами каналов, объединяющими пластинчатые электроды, более широких, чем межэлектродные зазоры, а также канала вдоль дна емкости, обеспечивают равномерную подачу раствора хлорида натрия ко всем электродным кассетам с пластинчатыми электродами. Кроме того такие конструктивные особенности позволяют в ламинарном режиме пропускать через электролизер с меньшим гидравлическим сопротивлением больший поток раствора хлорида натрия, требуемый для получения заданного количества ГХН.
На практике применяются разнообразные конструкции реакторов бездиафрагменных электролизных установок. Их можно разделить на две основные группы: монополярные и биполярные (см. рисунок).
Простота и надежность работы электролизных установок, а также заинтересованность потребителей в применении безопасного электрохимического метода обеззараживания воды привели к созданию огромного числа самых разнообразных по конструкции электролизеров. Они отличаются как принципом включения электродов (биполярные и монополярные), так и конструкцией электродов (коаксиальные, плоскопараллельные) и по другим конструктивным признакам. При создании электролизных установок большой единичной мощности предпочтение отдается плоскопараллельному размещению электродов. В таких электролизерах электролит проходит по синусоидальному пути через ряд биполярных ячеек. Электроды могут быть расположены вертикально или под небольшим углом к вертикали. Применяются также конструкции с горизонтальными электродами. В рамках данной публикации мы рассмотрим наиболее простые из них.
По организации движения электролита в электролизной ванне бездиафрагменные электролизные установки получения гипохлорита натрия подразделяют на проточные и непроточные.
5. Непроточные установки получения ГПХН
Эти установки нашли наиболее широкое распространение. Как правило, конструктивно они представляют собой ванну с установленным там пакетом (или кассетой) электродов. Электроды монополярно или биполярно подключаются к источнику постоянного тока.
Электролизная ванна заполняется раствором поваренной соли, после чего электродная кассета (или кассеты) устанавливается на ванну и на нее подается напряжение. Известно, что при прохождении электрического тока через раствор хлорида натрия происходит образование гипохлорита натрия и выделение водорода, который в виде пузырьков поднимается вверх, увлекая за собой раствор хлорида натрия. Подъемная сила этих пузырьков увеличивает скорость течения раствора хлорида натрия в межэлектродных зазорах, тем самым затягивая его из около донного потока в межэлектродные зазоры между пластинчатыми электродами, которые значительно меньше расстояний между электродными кассетами. При этом в потоке над пластинчатыми электродами будет собираться продукт электролиза – гипохлорит натрия. Процесс электролиза ведут до получения требуемой концентрации активного хлора, после чего готовый раствор сливают в бак-накопитель и весь цикл повторяется сначала.
При работе электролизера необходимо свести к минимуму распад образованного NaClO. Для этого следует процесс электролиза проводить при низкой температуре и большой плотности тока на аноде, воздержаться от перемешивания электролита в ванне.
Примерами таких установок служат установки получения ГПХН серии «Санер», выпускаемые серийно.
ПОСЛЕДНИЕ НОВОСТИ:
08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины.
08.02.2018 Компания «Мировые Водные Технологии» создала новый раздел Реагентная обработка воды, процессы которой осуществляют путем внесения того или иного химического вещества (реагента) в обрабатываемую воду с целью изменения того или иного показателя качества воды до требуемой величины.
Источник