- Гидроксид аммония
- Получение гидроксида аммония
- Применение гидроксида аммония
- Вред гидроксида аммония
- Аммиачная вода: получение, формула, применение
- Образование иона аммония
- Меры предосторожности
- Получение гидроксида аммония. Физические свойства
- Химические свойства гидроксида аммония
- Аммиачная вода: применение в разных отраслях хозяйства
- Соли аммония: свойства и практическое значение
- Гидроксид аммония
- Общие сведения о гидроксида аммония
- Примеры решения задач
- Соли аммония: получение и химические свойства
- Соли аммония
- Способы получения солей аммония
- Химические свойства солей аммония
Гидроксид аммония

Получение гидроксида аммония
Гидроксид аммония представляет собой водный раствор аммиака. Раствор прозрачный, с резким и едким запахом. Промышленным способом и в больших количествах получение гидроксида аммония возможно растворением в воде продуктов сжигания каменного угля.
Применение гидроксида аммония
Как пищевая добавка гидроксид аммония имеет обозначение Е527 и разрешен на территории России и Украины. Его добавляют в конфеты из карамели, какао-продукты и некоторые виды шоколада. В этих продуктахгидроксид аммония поддерживает необходимое по рецептуре значение кислотности, играя роль буфера. Дело в том, что какао-бобы содержат до 2% кислот в своем составе, которые при добавлении гидроксида аммония в состав продукта нейтрализуются.
Кроме пищевой промышленности, растворы гидроксида аммония широко используются в медицине, в домашнем обиходе. 10% раствор этого вещества более известен как нашатырный спирт или аммиачная вода. При вдыхании его происходит стимуляция дыхательного центра, что применяют при потере сознания, обмороках и когда необходимо вызвать рвоту. Наружно благодаря своим антисептическим и охлаждающим свойствам гидроксид аммония подходит для обработки рук, царапин и ссадин, укусов насекомых.

Вред гидроксида аммония
Гидроксид аммония добавляется в пищевые продукты согласно технологическим инструкциям и рекомендациям, часто в комбинации с другими гидроксидами. Норма содержания этого вещества в шоколаде и какао не должна превышать 70 г/кг сухого вещества.
В ряде стран (Новая Зеландия, Австралия, некоторые европейские страны) гидроксид аммония запрещен в качестве пищевой добавки. Имеются сведения, по которым это вещество способно негативно отражаться на здоровье человека, вызывая токсические поражения печени и кишечника.
Вред гидроксида аммония заключается в том, что это довольно нестабильное вещество легко превращается в аммиак и воду. Аммиак раздражающе действует на слизистую оболочку пищеварительного тракта. Четких норм суточного потребления гидроксида аммония не разработано.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Упав с осла, вы с большей вероятностью свернете себе шею, чем упав с лошади. Только не пытайтесь опровергнуть это утверждение.
Желудок человека неплохо справляется с посторонними предметами и без врачебного вмешательства. Известно, что желудочный сок способен растворять даже монеты.
Даже если сердце человека не бьется, то он все равно может жить в течение долгого промежутка времени, что и продемонстрировал нам норвежский рыбак Ян Ревсдал. Его «мотор» остановился на 4 часа после того как рыбак заблудился и заснул в снегу.
Ученые из Оксфордского университета провели ряд исследований, в ходе которых пришли к выводу, что вегетарианство может быть вредно для человеческого мозга, так как приводит к снижению его массы. Поэтому ученые рекомендуют не исключать полностью из своего рациона рыбу и мясо.
На лекарства от аллергии только в США тратится более 500 млн долларов в год. Вы все еще верите в то, что способ окончательно победить аллергию будет найден?
Согласно исследованиям ВОЗ ежедневный получасовой разговор по мобильному телефону увеличивает вероятность развития опухоли мозга на 40%.
Стоматологи появились относительно недавно. Еще в 19 веке вырывать больные зубы входило в обязанности обычного парикмахера.
Самая высокая температура тела была зафиксирована у Уилли Джонса (США), который поступил в больницу с температурой 46,5°C.
Люди, которые привыкли регулярно завтракать, гораздо реже страдают ожирением.
Кроме людей, от простатита страдает всего одно живое существо на планете Земля – собаки. Вот уж действительно наши самые верные друзья.
Самое редкое заболевание – болезнь Куру. Болеют ей только представители племени фор в Новой Гвинее. Больной умирает от смеха. Считается, что причиной возникновения болезни является поедание человеческого мозга.
Когда влюбленные целуются, каждый из них теряет 6,4 ккалорий в минуту, но при этом они обмениваются почти 300 видами различных бактерий.
Общеизвестный препарат «Виагра» изначально разрабатывался для лечения артериальной гипертонии.
У 5% пациентов антидепрессант Кломипрамин вызывает оргазм.
Для того чтобы сказать даже самые короткие и простые слова, мы задействуем 72 мышцы.
Суставы после коронавируса могут быть повреждены. Дело в том, что новая коронавирусная инфекция ударяет практически по всем органам человека, и суставы не исклю.
Источник
Аммиачная вода: получение, формула, применение
Бесцветный газ с резким запахом аммиак NH3 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами H2O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
Образование иона аммония
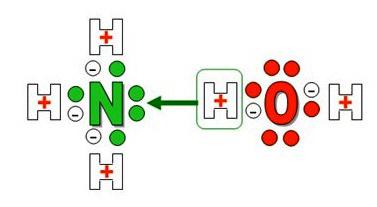
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа NH3, увеличивается количество менее вредных для живых организмов катионов NH4 +
Получение гидроксида аммония. Физические свойства
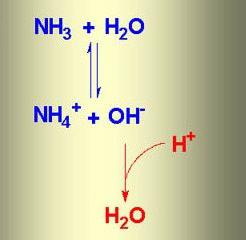
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – NH4OH, но на самом деле одновременно присутствуют ионы
NH4 + , OH – , молекулы NH3 и H2O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота — покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.
Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона NH4 + бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: NH4OH + HCl = NH4Cl + H2O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2 (синий осадок).
Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.
На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом — 10-процентным раствором аммиака.
Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
Источник
Гидроксид аммония
Общие сведения о гидроксида аммония
Аммиак очень хорошо растворяется в воде (при 20 o С один объем воды растворяет около 700 объемов NH3). Хорошая растворимость объясняется образованием водородной связи между молекулами аммиака и воды. Поскольку молекула NH3 – лучший акцептор протона, чем H2O, то в растворе имеет место ионизация:
Появление ионов OH — создает щелочную среду раствора. Но, как это видно из значения константы основности
реакция протекает в незначительной степени. В растворе с молярной концентрацией аммиака 1 моль/л ионизируется, например, всего лишь 0,4% молекул NH3 и H2O.
При взаимодействии ионов NH4 + иOH — вновь образуются молекулы NH3 и H2O, между которыми имеет место водородная связь. Следовательно, ионное соединение NH4OH(гидроксид аммония) не существует, как не существуют гидроксид оксония OH3OH и дигидронитрид аммония NH4NH2.
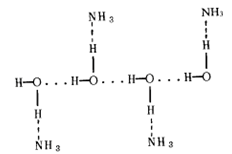
Из водных растворов аммиака выделяются два кристаллогидрата NH3×H2O и 2NH3×H2O, устойчивые лишь при низкой температуре. Молекулы аммиака и воды связаны в кристаллогидратах водородной связью. Так, NH3×H2O имеет структуру, в которой основой являются цепи из молекул воды, объединенных водородными связями. Цепи объединяются между собой в трехмерную решетку молекулами аммиака также посредством водородных связей:
Примеры решения задач
| Задание | Каковы масса и объем аммиака, которые потребуются для получения 5т нитрата аммония? |
| Решение | Запишем уравнение реакции получения нитрата аммония из аммиака и азотной кислоты: |
Масса нитрата аммония, рассчитанная по уравнению будет равна:
Тогда, масса аммиака, рассчитанная по уравнению:
Составим пропорцию и найдем истинную массу аммиака:
x = 17 × 5 / 80 = 1,06, значит
Найдем объем аммиака:
17 т NH3 – 22,4×10 3 м 3 NH3.
х = 22,4×10 3 × 1,06 /17 = 1,4×10 3 , значит
| Задание | Промышленному способу получения аммиака соответствует реакция: |
| Понравился сайт? Расскажи друзьям! |