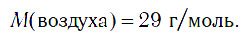Краткие теоретические сведения



Практическая работа №2
«Получение и распознавание газов»
Краткие теоретические сведения
Строение газообразных веществ отличается от строения веществ в твердом и жидком состояниях. Газы не имеют собственной формы и расширяются до тех пор, пока не заполнят весь сосуд принимая его форму, по этой же причине газы не имеют собственного объема. Объем газа определяется объемам сосуда. Газ оказывает на стенки сосуда одинаковое во всех направлениях давления. Газы легко сжимаются. Благодаря большому расстоянию между молекулами газы смешиваются друг с другом в любом отношении. Основные газы получаемые и используемые в лабораториях это водород, кислород, углекислый газ.
Лабораторные способы получения этих газов:
Водород получают в аппарате Киппа, при взаимодействии соляной кислоты и металлического цинка (в гранулах) — при комнатной температуре:
Zn + 2HCl = ZnCl2 + H2
Оксид углерода (IV) = углекислый газ можно получить, действуя соляной или разбавленной серной кислотой на мрамор (основное вещество — карбонат кальция) или другой карбонат (при комнатной температуре). Сильная кислота (серная или соляная) будет вытеснять слабую угольную кислоту из её солей; угольная кислота нестойкая, поэтому практически сразу разлагается на углекислый газ и воду:
СаСО3 + 2HCl = CaCl2 + CO2 + H2O
Можно получить углекислый газ, сжигая лучину, бумагу или кусочек угля.
Кислород можно получить разложением при нагревании бертолетовой соли или лучше перманганата калия:
2KClO3 = 2KCl + 3O2 (есть опасность взрыва)
2KMnO4 = K2MnO4 + MnO2 + O2
Собирание газов
В устройстве аппарата Киппа предусмотрена газоотводная трубка с краником; для получения углекислого газа и кислорода реактивы помещают в пробирку и закрывают её пробкой с газоотводной трубкой. Пробирку с перманганатом калия закрепляют в штативе и нагревают пламенем спиртовки.
Водород легче воздуха, поэтому его собирают над воздухом, в перевёрнутую пробирку. Кислород и углекислый газ тяжелее воздуха, поэтому их можно собирать вытеснением воздуха, опустив газоотводную трубку на дно пробирки. Кислород малорастворим в воде, поэтому его можно также собирать над водой, в перевёрнутую пробирку (этот способ лучше, т.к. разница молярных масс кислорода (32 г/моль) и воздуха (29 г/моль) невелика).
Чтобы распознать эти газы, нужно знать их свойства.
Так, кислород поддерживает горение — опущенная в пробирку с кислородом тлеющая лучинка начинает ярко гореть; углекислый газ не поддерживает горение — горящая лучинка, опущенная в пробирку с углекислым газом, гаснет.
Углекислый газ, кроме того, мутит известковую воду: при его взаимодействии с гидроксидом кальция («известковой водой») образуется нерастворимый в воде осадок карбоната кальция:
Са(ОН)2 + СО2 = СаСО3 + Н2О
Чистый водород сгорает с легким звуком «пах», водород с примесью воздуха взрывоопасен «гремучий газ» и в небольшом количестве сгорает с резким лающим звуком.
Водород (Н2) – самый легкий, бесцветный, не имеет запаха.
Кислород (О2) без запаха и цвета,тяжелее воздуха, мало растворим в воде.
Аммиак (NН3) имеет резкий характерный запах, без цвета, хорошо растворим в воде, легче воздуха.
Это оформить в тетради!
Практическая работа №2
Получение и распознавание газов
Цель: изучить процессы и химизм получения газов на примере водорода, кислорода и углекислого газа.
Оборудование:цинк в гранулах, раствор соляной кислоты, мел, раствор пероксида водорода, оксид марганца (II); пробирки, спиртовка, лучинка
Последовательность выполнения работы:
Внимание: Записи о наблюдаемых явлениях по всем опытам внесите в таблицу по форме:
| Что делали | Что наблюдали | Уравнения реакций |
| В пробирку поместить две гранулы цинка. 2. Прилить 2 мл раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса. 3. Накрыть пробирку-реактор пробиркой большего диаметра. 4. Через 4 минуты поднимите большую пробирку и, не переворачивая, поднесите её к пламени спиртовки. Что наблюдаете? Запишите уравнение реакции. Что можете сказать о «чистоте» собранного водорода? | ||
| 1. В пробирку прилить 5 мл раствора пероксида водорода. 2. Подготовьте тлеющую лучину. 3. Добавьте в пробирку несколько крупинок оксида марганца (IV). Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса. 4. Внесите тлеющую лучину в пробирку с раствором пероксида водорода. | ||
| 1. В пробирку поместить кусочек мела. 2. Прилить к мрамору 4 мл раствора уксусной кислоты. Что наблюдаете? Запишите уравнение химической реакции в молекулярной и ионной форме. 3. Зажгите лучину. 4. Внесите горящую лучину в пробирку-реактор. |
Контрольные вопросы:
1. Почему водород собирают в перевернутую пробирку?
2. Если через раствор известковой воды посредством стеклянной трубки продувать выдыхаемый воздух, то через некоторое время известковая вода помутнеет. Почему?
3. Какое свойство углекислого газа лежит в основе его применения в углекислотном огнетушителе.
Список литературы
Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля. М. Издательский центр «Академия». 2017
Тема 2. Практическая работа №3
Решение экспериментальных задач по теме «Металлы и неметаллы»
Это для ознакомления, не писать!
Краткие теоретические сведения
Распознавание веществ производится с помощью качественных реакций.
Качественные реакции – это химические реакции, с помощью которых можно определить то, чем одно вещество отличается от другого по элементарному составу, иначе говоря, эти реакции позволяют определить отдельные ионы или молекулы, из которых состоит исследуемое вещество или смесь веществ. В качественном анализе применяют реакции, сопровождающиеся каким-либо эффектом, который можно легко обнаружить органами чувств:
· Изменение окраски раствора;
· Выпадение или растворение осадка;
· Выделение газов (иногда обладающих характерным запахом)
В таблице приведены некоторые из качественных реакций.
| Катион | Воздействие или реактив | Наблюдаемая реакция |
| Na + | Пламя | Желтое окрашивание |
| К + | Пламя | Фиолетовое окрашивание |
| Са 2+ | Пламя | Кирпично-красное окрашивание |
| Аg + | хлорид | Выпадение белого осадка |
| Fe 2+ | гексациано-феррат (III) калия (красная кровяная соль) | Выпадение синего осадка |
| Fe 3+ | роданид | Красное окрашивание |
| Анион | Воздействие или реактив | Наблюдаемая реакция |
| S04 2- | соль бария | Выпадение белого осадка |
| СО3 2- | кислота | вскипание или пузырьки газа |
| Cl — | ионы Аg+ | Выпадение белого осадка, не растворимого в HN03 |
Для выполнения опытов отбирается проба (небольшое количество вещества помещается в чистую пробирку) и исследуется реактивом.
Источник
Урок 15. Воздух как смесь газов
В уроке 15 «Воздух как смесь газов» из курса «Химия для чайников» мы выясним из чего состоит воздух; узнаем о получении, собирании и хранении газов, а также об их герметичности.
Вы уже знаете, что вещества могут находиться в различных агрегатных состояниях: газообразном, жидком и твердом.
В окружающей нас природе многие вещества при обычных условиях находятся в газообразном состоянии. Прежде всего, это компоненты воздушной оболочки Земли — атмосферы. Очень много газов растворено в водах Мирового океана. Во время извержения вулканов в атмосферу также выбрасывается большое количество вулканических газов. В недрах нашей планеты хранятся огромные запасы природного газа.
Атмосфере принадлежит важнейшая роль в жизни человека, животных и растений. Ее исследованиям были посвящены труды многих ученых прошлого. С давних времен был известен лишь один вид газа — воздух. При этом он изучался в основном физиками и интереса у химиков не вызывал. Лишь во второй половине XVIII в. было установлено, что воздух представляет собой смесь газов.
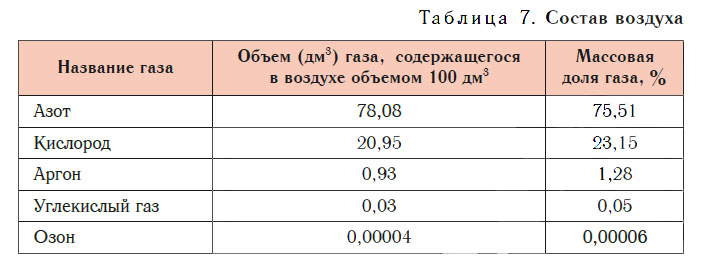
Состав воздуха
Основные компоненты воздуха — азот и кислород. При нормальных условиях в воздухе объемом 100 дм 3 содержится азот объемом около 78 дм 3 и кислород объемом около 21 дм 3 , а на долю всех остальных газов приходится около 1 дм 3 . В заметных количествах в воздухе присутствуют аргон, углекислый газ, озон и другие газы (табл. 7).
Для решения некоторых задач и проведения расчетов в физике, химии, технике очень удобно рассматривать воздух не как смесь газов, а как одно газообразное вещество. Экспериментальным путем можно установить, что при нормальных условиях масса воздуха объемом 22,4 дм 3 равна 29 г. Поскольку такой объем при н. у. занимает любой газ химическим количеством 1 моль, то молярную массу воздуха можно условно считать равной 29 г/моль:
Все газы, молярная масса которых меньше 29 г/моль, принято называть газами легче воздуха (например, водород H2, аммиак NH3, угарный газ CO, метан CH4), а газы, у которых она больше 29 г/моль — газами тяжелее воздуха (например, кислород O2, озон O3, углекислый газ CO2).
Получение, собирание и хранение газов
Газы имеют важное значение в жизни и деятельности человека. Поэтому необходимо уметь их получать, собирать и хранить.
В химической лаборатории небольшие объемы газов можно получать различными способами. Например, газы выделяются при нагревании некоторых твердых веществ (рис. 66).
Газообразные вещества могут образовываться при действии некоторых жидких веществ на твердые. Так, при действии уксуса на мрамор или мел выделяется углекислый газ (рис. 67).
В промышленности используют значительно большие, чем в химических лабораториях, количества различных газов. Большие объемы кислорода и азота получают из воздуха. Позднее вы узнаете, как это делается.
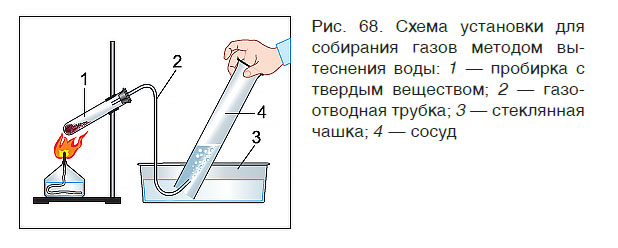
В лабораторных условиях собрать газ в сосуд можно двумя способами: вытеснением воды (рис. 68) и вытеснением воздуха. Первый способ применяют для собирания только нерастворимых в воде газов (кислород, азот, водород). Вто-
рой — для собирания как растворимых (аммиак, углекислый газ), так и нерастворимых в воде газов.
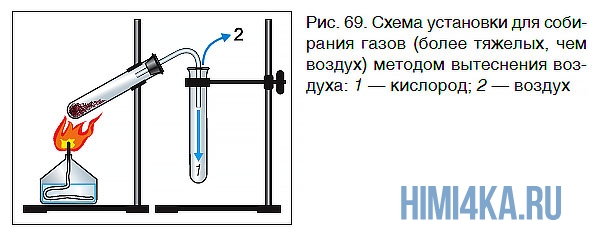
Для собирания газов, которые легче воздуха, сосуд для сбора газа следует закрепить дном вверх, а для газов, которые тяжелее воздуха, — дном вниз (рис. 69)
Для хранения газов следует использовать сосуды, не сообщающиеся с окружающей средой. Такие сосуды называют герметичными (т. е. не имеющими отверстий для выхода газа из сосуда наружу). В быту примером герметичного сосуда является бутылка с плотной пробкой, завязанный воздушный шарик или накачанная камера от велосипедного колеса, в химической лаборатории — пробирка, плотно закрытая пробкой, газометр.
Из курса физики вы знаете, что при нагревании газы расширяются. Это свойство можно использовать для проверки прибора для получения газов на герметичность (рис. 70). Для этого после сборки прибора следует погрузить конец газоотводной трубки в воду, а пробирку на несколько секунд зажать в ладони. Нагреваясь от тепла руки, воздух в пробирке расширяется и выходит из газоотводной трубки в виде пузырьков. Если пузырьки не наблюдаются, то это свидетельствует о том, что прибор собран негерметично и для газа имеется другой выход, кроме газоотводной трубки.
В промышленности для хранения газов чаще всего используют более прочные сосуды — баллоны (рис. 71), в которых сжатые газы находятся под большим давлением; для предупреждения разрушения баллона сжатым газом его стенки делают из толстой стали. Узнать, какой газ содержится в баллоне, можно по окраске баллона, цвету надписи на нем и цвету полосы. Например, баллон с кислородом должен быть окрашен в голубой цвет и иметь черную надпись «Кислород», баллон с азотом должен быть окрашен в черный цвет, иметь желтую надпись «Азот» и коричневую полосу, баллон с очень чистым аргоном должен быть окрашен в серый цвет, иметь зеленую надпись «Аргон» и зеленую полосу.
Краткие выводы урока:
- Вещества могут находиться в газообразном, жидком или твердом агрегатном состоянии.
- Воздух представляет собой смесь газов. Основными компонентами воздуха являются азот и кислород.
- При нормальных условиях в воздухе объемом 100 дм 3 содержится азот объемом около 78 дм 3 и кислород объемом около 21 дм 3 .
- Воздух можно условно рассматривать как газ, молярная масса которого равна 29 г/моль.
Надеюсь урок 15 «Воздух как смесь газов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник