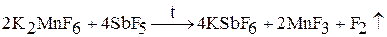№ 9 Фтор
История открытия:
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор» (от fluere — «течь», по свойству этого соединения понижать температуру плавления руды и увеличивать текучесть расплава). В 1771 году Карл Шееле получил плавиковую кислоту. Как один из элементов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Название «фтор» (от греч. fqoroz — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluor».
Нахождение в природе, получение:
Фтор является «чистым элементом», то есть в природе содержится только изотоп фтора 19 F. Известны 17 радиоактивных изотопов фтора с массовым числом от 14 до 31. Самым долгоживущим из них является 18 F с периодом полураспада 109,8 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
В лабораторных условиях фтор можно получать с помощью электролиза. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза, газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C: 2K2MnF6 + 4SbF5 = 4KSbF6 + 2MnF3 + F2
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития) при температуре около 100°С в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства:
Слабо светло-оранжевый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит. Сжижается при 88 К, при 55 К переходит в твердое состояние с молекулярной кристаллической решёткой, которая может находиться в нескольких модификациях. Структура a-фтора (стабильная при атмосферном давлении) является моноклинной гранецентрированной.
Химические свойства:
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до -252°C). Фтор также способен окислять кислород образуя фторид кислорода OF2.
С азотом фтор реагирует лишь в электрическом разряде, с платиной — при температуре красного каления. Некоторые металлы (Fe, Сu, Al, Ni, Mg, Zn) реагируют с фтором с образованием защитной плёнки фторидов, препятствующей дальнейшей реакции.
Фтор взаимодействует со многими сложными веществами. Он замещает все галогены в галогенидах, легко фторируются сульфиды, нитриды и карбиды. Гидриды металлов образуют с фтором на холоду фторид металла и HF; аммиак (в парах) — N2 и HF. Фтор замещает водород в кислотах или металлы в их солях:
НNО3(или NaNO3) + F2 => FNO3 + HF (или NaF);
Карбонаты щелочных и щелочноземельных металлов реагируют с фтором при обычной температуре; при этом получаются соответствующий фторид, СО2 и О2.
В атмосфере фтора горит даже вода: 2F2 + 2H2O = 4HF + O2.
Фтор энергично реагирует с органическими веществами.
Важнейшие соединения:
Фтороводород — бесцветный газ с резким запахом, при комнатной температуре существует преимущественно в виде димера H2F2, ниже 19,9°C — бесцветная подвижная жидкость. Хорошо растворим в воде в любом отношении с образованием фтороводородной (плавиковой) кислоты. Образует азеотропную смесь с концентрацией 35,4% HF, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей.
Фторид кислорода , OF2 бесцветный ядовитый газ, малорастворим в воде. Получают реакцией фтора с разб. раствором щелочи: 2NaОH + 2F2 => OF2 + 2NaF + H2O. Сильный окислитель.
Смесь паров воды и дифторида кислорода взрывоопасна: H2O + OF2 = 2HF + O2.
Гексафторид серы , SF6 (элегаз) — тяжелый газ, практически бесцветный, обладает высокими электроизолирующими свойствами, высоким напряжением пробоя, при этом практически инертен.
Фториды металлов — типичные соли, обычно менее растворимы, чем соответствующие хлориды, но AgF лучше растворим, чем другие галогениды серебра.
Применение:
Газообразный фтор используется для получения:
— гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности,
— OF2, трёхфтористый хлор ClF3 — фторирующие агенты и мощные окислители ракетного топлива,
— шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности,
— фреонов — хороших хладагентов,
— тефлонов — химически инертных полимеров,
— гексафтороалюмината натрия — для последующего получения алюминия электролизом и т.д.
Осипов Антон Анатольевич
ХФ ТюмГУ, 561/2 группа
Источник
Получение фтора
Нахождение в природе. История получения фтора
Фтор – распространенный элемент в природе, содержание фтора в земной коре составляет » 0,06 мас. %. В свободном состоянии фтор не встречается. Важнейшими минералами, содержащими фтор, являются CaF2 – флюорит (плавиковый шпат) (Прибайкалье), Na3AlF6 – криолит, 3Са3(PO4)2 × CaF2 – фторапатит (Кольский полуосторов).
История открытия фтора связана с минералом флюоритом (плавиковым шпатом) CaF2. В давние времена флюорит использовался в металлургии для понижения температуры плавления руды и шлаков.
В 1771 году обработкой флюорита серной кислотой шведский химик Карл Шееле приготовил кислоту, которую он назвал «плавиковой»:
Французский ученый Антуан Лавуазье предположил, что в состав этой кислоты входит новый химический элемент, который он предложил назвать «флюорем», что в переводе означает «текущий» (Лавуазье считал, что плавиковая кислота – это соединение флюория с кислородом, ведь, по мнению Лавуазье, все кислоты должны содержать кислород). Однако выделить новый элемент он не смог. За новым элементом укрепилось название «флюор».
Длительные попытки выделить этот элемент в свободном виде не привели к успеху. Многие ученые, пытавшиеся получить его в свободном виде, погибли при проведении таких опытов или стали инвалидами. Это и английские химики братья Т. и Г. Ноксы, и французы Жозеф-Луи Гей-Люссак и Луи Жак Тенар, и многие другие. Сам Гемфри Дэви, первым получивший в свободном виде натрий, калий, кальций и другие элементы, в результате экспериментов по получению фтора электролизом отравился и тяжело заболел.
В 1816 году для нового элемента было предложено другое название – фтор (от греч. phtoros – разрушение, гибель). Это название элемента принято только в русском языке, французы и немцы продолжают называть фтор fluor, англичане –fluorine. Получить фтор в свободном виде не смог и такой выдающийся ученый, как Майкл Фарадей.
Только в 1886 году французский химик Анри Муассан, используя электролиз жидкого фтороводорода HF, охлажденного до температуры – 23°C (в жидкости должно содержаться немного фторида калия KF, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, чрезвычайно реакционноспособного газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины (Pt) и иридия (Ir). При этом каждый грамм полученного фтора «съедал» до 6 г платины. Позднее Муассан стал использовать значительно более дешевый медный электролизер.
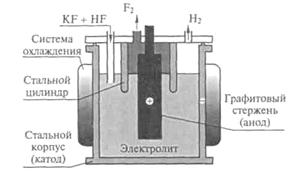
Рис. 1. Схема электролизера для получения фтора
Электролизу подвергается HF, а KF обеспечивает электрическую проводимость расплава:
2. В лабораторных условиях фтор получают разложением высших фторидов металлов (церия, марганца):
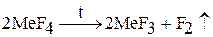
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
§ 1. Фтор
Получение фтора осуществляется путем электролиза фтористых соединений, причем фтор выделяется на аноде по схеме:
Электролитом обычно служит легкоплавкая смесь состава KF × 2HF. Процесс проводят при температурах около 100 °С в стальных электролизерах со стальными катодами (на которых выделяется водород) и угольными анодами.
Свободный фтор состоит из двухатомных молекул и представляет собой почти бесцветный (в толстых слоях зеленовато–желтый) газ, имеющий резкий запах. Он сгущается в желтоватую жидкость при –188 °С и затвердевает при –218 °С. Распад молекулы F2 на отдельные атомы осуществляется довольно легко (энергия диссоциации 38 ккал/моль).
С химической стороны фтор может быть охарактеризован как одновалентный металлоид и притом самый активный из всех металлоидов. Обусловлено это благоприятным сочетанием ряда факторов – непрочности молекулы F2 , сравнительно малых размеров атома фтора и тем, что он имеет большое сродство к электрону, т. е. энергично притягивает недостающий ему для заполнения внешнего слоя валентный электрон:
Это число –82 ккал/г–атом – и является количественным выражением сродства фтора к электрону.
Подавляющее большинство металлов соединяется с фтором уже при обычных условиях. Однако взаимодействие часто ограничивается образованием поверхностной пленки фтористого соединения, которая предохраняет металл от дальнейшего разъедания.
Так как фтористые производные металлоидных элементов обычно легколетучи, образование их не предохраняет поверхность металлоида от дальнейшего действия фтора. Поэтому взаимодействие с металлоидами часто протекает значительно энергичнее, чем со многими металлами. Например, фосфор и сера воспламеняются в газообразном фторе и сгорают по реакциям:
С азотом и кислородом фтор непосредственно не соединяется.
От водородных соединений других элементов фтор отнимает водород. Большинство окислов разлагается им с вытеснением кислорода, В частности, вода разлагается по схеме
причем вытесняемые атомы кислорода соединяются не только друг с другом, но отчасти также с молекулами воды и фтора. Поэтому, помимо газообразного кислорода, при этой реакции всегда образуются также перекись водорода и окись фтора (F2 O). Последняя представляет собой бесцветный газ, похожий по запаху на озон.
1) Окись фтора (иначе – фтористый кислород – OF2 ) может быть получена по реакции:
Она малорастворима в воде и почти не разлагается ею, но под действием сильных восстановителей разложение F2 O (т. пл. –224 °С, т. кип. –145 °С) идет довольно быстро. Окись фтора сильно ядовита.
Практическое использование фтора широко развилось за последние годы. Потребляется он главным образом для фторирования органических соединений (т. е. замены в них водорода на фтор). Процесс этот приобрел большое значение, так как многие фторорганические производные обладают ценными свойствами.
В отличие от свободного фтора, фтористый водород (HF) и многие его производные использовались уже с давних пор.
Непосредственное соединение фтора с водородом сопровождается очень большим выделением тепла:
Реакция протекает обычно со взрывом, который происходит даже при сильном охлаждении газов и в темноте. Практического значения для получения HF этот прямой синтез не имеет.
Техническое получение фтористого водорода основано на взаимодействии СаF2 с концентрированной H2 SO4 по реакции:
Процесс проводят в стальных печах при 120–300°С. Части установки, служащие для поглощения HF, делаются из свинца.
Фтористый водород представляет собой бесцветную легколетучую жидкость (т. пл. – 83°С. т. кип, +19,5 °С), смешивающуюся с водой в любых соотношениях. Он обладает резким запахом, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно раздражает дыхательные пути.
2) Связь Н–F характеризуется весьма высокой полярностью (0,45). Этим обусловлена резко выраженная склонность фтористого водорода к ассоциации путем образования водородных связей по схеме [···H···F···H···F···].
Энергия такой связи составляет около 7 ккал/г–атом, т. е. она несколько прочнее, чем водородная связь между молекулами воды.
Химические свойства HF существенно зависят от отсутствия или наличия воды. Сухой фтористый водород не действует на большинство металлов. Не реагирует он и с окислами металлов. Однако если реакция начнется, то дальше она некоторое время идет с самоускорением, так как в результате взаимодействия по схеме
Подобным же образом действует фтористый водород и на окислы некоторых металлоидов. Практически важно взаимодействие его с двуокисью кремния – SiO2 (песок, кварц), так как последняя входит в состав стекла. Реакция идет по схеме
Поэтому фтористый водород нельзя получать и сохранять в стеклянных сосудах. Обычно его растворы хранят в бутылях из искусственных пластмасс, на которые HF не действует.
На взаимодействии HF с SiO2 основано применение фтористого водорода для «травления» стекла. Вследствие удаления частичек SiO2 поверхность его становится матовой, чем пользуются для нанесения на стекло различных надписей и т.п.
3) Рассмотренные выше случаи взаимодействия сухого фтористого водорода с окислами металлов и металлоидов могут служить типичным примером аутокаталитических реакций, т. е. таких процессов, при которых катализатор (в данном случае – вода) не вводится в систему извне, а является одним из продуктов реакции. Как показывает рис. 95, скорость подобных процессов сначала, по мере увеличения в системе количества катализатора, нарастает до некоторого максимума, после чего начинает уменьшаться вследствие понижения концентраций реагирующих веществ.
В водном растворе HF ведет себя, как одноосновная кислота средней силы. Продажный раствор этой фтористоводородной (иначе, плавиковой) кислоты содержит обычно 40% HF.
Фтористоводородная кислота более или менее энергично реагирует с большинством металлов. Однако во многих случаях реакция протекает лишь на поверхности металла, после чего последний оказывается защищенным от дальнейшего действия кислоты слоем образовавшейся труднорастворимой соли. Так ведет себя, в частности, свинец, что и позволяет пользоваться им для изготовления частей устойчивой к действию HF аппаратуры.
4) Помимо электролитической диссоциации по уравнению HF H · + F · (K = 710 – 4 ), для плавиковой кислоты характерно равновесие: F’ + HF HF2 . Значение константы этого равновесия [HF’2 ]/[F’][HF] = 5 показывает, что в растворах HF содержится больше сложных анионов (FHF)’ [имеющих линейную структуру с d(FF) = 2,3 А], чем простых анионов F’.
Соли фтористоводородной кислоты носят название фтористых или фторидов. Большинство их трудно растворимо в воде – из производных обычных металлов хорошо растворяются лишь фториды Na, К, Ag, Al, Sn и Hg. Все соли плавиковой кислоты ядовиты. Сама она при попадании на кожу вызывает образование болезненных и трудно заживающих ожогов (особенно под ногтями). Поэтому работать с ней следует в резиновых перчатках.
Практическое применение плавиковой кислоты довольно разнообразно. Она используется в нефтяной промышленности (при синтезе высококачественных бензинов), для удаления песка с металлического литья, при анализах минералов и т. д. Широкое практическое применение находят также некоторые фториды, которые будут ближе рассмотрены при соответствующих элементах.
Источник