- Производство ферментных препаратов. Ферменты, используемые как лекарственные средства. Традиционные способы получения ферментных препаратов.
- Технология производства ферментных препаратов
- Поверхностный способ
- Глубинный способ
- Производство технических и очищенных ферментных препаратов
- Получение препаратов с индексом П2х и Г2х, П3х и Г3х
- Получение препаратов с индексом П10х и Г10х
- Получение кристаллических ферментных препаратов
Производство ферментных препаратов. Ферменты, используемые как лекарственные средства. Традиционные способы получения ферментных препаратов.
Микрокапсулирование открывает интересные перспективы использования ряда лекарственных веществ, по сравнению с их использованием в виде обычных лекарственных форм.
Применение микрокапсул не ограничивается целью только медикаментозной терапии. Перспективным направлением в области технологии является получение микрокапсул с растворами белков, микрокапсулированных ферментов, антидотов. Исследуется применение микрокапсулированных ферментов – уреазы, уриказы, трипсина. Так, микрокапсулы с уреазой при внутрибрюшинном введении вызывают увеличение концентрации аммиака в крови, после чего мочевина начинает диффундировать из крови во внутрибрюшинную полость и затем в микрокапсулы, подвергаясь новому превращению в аммиак. Микрокапсулирование позволяет также предохранять ферменты от инактивации в результате образования антител-иммуноглобулинов при инъекционном введении.
Включение ферментов в микрокапсулы. Микрокапсулирование ферментов состоит во включении их водных растворов в полупроницаемые мембраны толщиной около 20 нм, непроницаемые для ВМС и клеток, но через которые могут проникать низкомолекулярные вещества. Наличие ультратонкой мембраны позволяет создать высокие концентрации фер-мента в малых объемах раствора, находящегося в микрокапсуле, и сохранять стабильность и биологическую активность инкапсулированных ферментов. Использование фермента в высоких концентрациях, а также большие значения отношения площади поверхности микрокапсул к их объему обеспечивают быструю диффузию низкомолекулярного субстрата из внешней среды к ферменту и продукта реакции из внутреннего объема микрокапсулы в межкапсулярное пространство.
Получены и исследованы микрокапсулированные формы ряда ферментоз, катализирующих различные превращения низкомолекулярных субстратов. Так, микрокапсулированная каталаза, введенная внутривенно или внутрибрюшинно мышам с наследственным нарушением синтеза этого фермента, эффективно снижала содержание перборатов в крови и имела более длительный период жизни в оргаинзме, чем свободный фермент. Микрокапсулированная аспарагиназа, введенная мышам с аспарагинзависимыми опухолями, вызывала стойкое и длительное снижение аспарагина в крови, что препятствовало росту злокачественных новообразований. Микрокапсулированная уреаза после введения крысам в желудочно-кишечный тракт вызывала существенное понижение содержания мочевнны в крови. Следует отметить, что все исследования микрокапсулирозанных ферментов проводятся только на животных. Это связано с тем, что при интракорпоральном их введении материал, используемый для создания мембран, накапливается в основном в селезенке и печени и может быть далеко не безразличен для организма.
Идеальным материалом с точки зрения биологической утилизации микрокапсул в организме человека и животных могут быть различные природные мембраны клеток крови. Фермент при относительно мягких условиях (нейтральная среда, небольшая ионная сила и т. д.) может быть заключен в частично гемолизованные клетки крови (эритроциты, тромбоциты) с последующим восстановлением целостности их мембран. Поскольку размер ферментных элементов крови мал, а время жизни их в кровяном русле относительно велико, такие микрокапсулы могут беспрепятственно и длительно циркулировать в крови. В форменные элементы крови включены такие ферменты, как глюкозидаза, галактозидаза, амилаза, пероксидаза, аргиназа, аспарагиназа и некоторые другие. Все иммобилизованные в клетки крови ферменты имеют неизменяемые каталитические параметры и отличаются большей устойчивостью к повышению температуры.
Применение микрокапсул, содержащих ферменты, экстракорпорально через шунты или камеры имеет хорошую перспективу. Одно из преимуществ состоит в том, что не происходит контакта фермента с иммунокомпетентными клетками, тем самым исключается возможность сенсибилизации организма со всеми неблагоприятными последствиями. Кроме того, применение вне организма исключает накопление в нем искусственных клеток и снимает проблему разрушения и утилизации полимерных материалов. Благодаря ультратонкой полупроницаемой мембране и высоким значениям отношения площади поверхности микрокапсул к их объему, скорость диффузии низкомолекулярных веществ через микрокапсулы выше, чем через диализную мембрану в аппарате «искусственная почка». Принцип энзиматического превращения вредных метаболитов с помощью микрокапсулированных ферментов разрабатывается для применения в аппаратах «искусственная почка» и «искусственная печень». Перспективным может оказаться использова-ние микрокапсулированных ферментов для удаления мочевины — одного из самых токсичных метаболитов клетки. Одним из способов является превращение мочевины под действием микрокапсулированной уреазы в аммоний и углерода диоксид. Вторым — использование экстракорпорального шунта, снабженного микрокапсулами с мультиферментными рециклирующими комплексами.
Большой интерес представляет применение микрокапсул с полиуретановой оболочкой, содержащих водные суспензии антидотов: активированного угля, ионообменных смол и других соединений, характеризующихся способностью к связыванию и инактивации токсических веществ, образующихся и циркулирующих в крови в процессе метаболизма. Очистка крови от указанных веществ осуществляется специальными аппаратами, содержащими сосуды с микрокапсулами, при экстракориаральной циркуляции крови. При этом кровь освобождается также от аммиака. Подобная система может быть эффективно использована при лечении ряда заболеваний почек.
Иммобилизованные ферменты имеют огромное значение для медицины. В частности, большой рынок сбыта занимают тромболитические ферменты, предназначенные для борьбы с сердечнососудистыми заболеваниями. Так, в отечественную клиническую практику внедрен препарат «стрептодеказа», содержащий стрептокиназу — активатор предшественника протеиназы плазмина предотвращающий образование тромба в кровеносной системе.
Ферменты, разрушающие некоторые незаменимые аминокислоты (например, аспарагиназа) используют для борьбы со злокачественным ростом опухолей. Протеолитические ферменты (трипсин, химотрипсин, субтилизин, коллагеназа), иммобилизованные на волокнистых материалах (целлюлоза, полиамидные волокна, декстран и др.), применяют для эффективного лечения ран, язв, ожогов, абсцессов, а их белковые ингибиторы — в заместительной терапии для лечения эмфиземы и панкреатитов.
Исключительно важны с практической точки зрения работы, посвященные направленному транспорту лекарственных веществ. В этом отношении особенно выгодны инкапсулированные ферменты типа искусственной клетки. Так, микрокапсулы, стенки которых представлены оболочкой эритроцита («тень эритроцита»), а их содержимое заполнено ферментом аспарагиназой, переносятся кровотоком к зонам скопления аспарагина и поэтому применяются для лечения аспарагинзависимых опухолей, в частности саркомы. Колонки, заполненные микрокапсулами с ферментом, используют для диализа в аппарате «искусственная почка», которая работает в 100 раз эффективнее обычного аппарата.
Таким образом, использование иммобилизованных ферментов во многих жизненно важных отраслях народного хозяйства становится все более массовым. Выгодное сочетание избирательности и эффективности с долговечностью и стабильностью иммобилизованных ферментов способствует созданию новых биотехнологических процессов и методов терапии, совершенствует медицинскую диагностику, анализ, органический синтез и оказывает огромное влияние на образ жизни человека.
Биотехнология аминокислот. Преимущества микробиологического синтеза перед другими способами получения. Общие принципы конструирования штаммов микроорганизмов — продуцентов аминокислот как первичных метаболитов.
Аминокислоты — главный строительный материал организма, из которого формируютея пептиды и белки. Растения и микроорганизмы способны сами синтезировать все нужные им аминокислоты из более простых химических соединений. Однако человеческий организм способен синтезировать лишь 12 из 20 аминокислот, необходимых ему для жизнедеятельности. Остальные 8 аминокислот получили название незаменимых и должны поступать в организм извне — с пищей. При нехватке хотя бы одной из незаменимых аминокислот замедляется рост организма, проявляется патология. Поэтому важно синтезировать эти аминокислоты в промышленных масштабах для корректировки рационов питания, в лечебных и профилактических целях и т. д. Кроме того, аминокислоты (как заменимые, так и незаменимые) являются важнейшим сырьем для обеспечения многих биотехно-логических процессов.
Производство многих аминокислот, в том числе и незаменимых, — крупнотоннажиая отрасль химической промышленности. Однако с помощью химических методов получается смесь опти-ческих изомеров аминокислот, иначе говоря, смесь L- и D-аминокислот, молекулы которых в L- и D-форме представляют собой зеркальные изомеры. В химических реакциях эти изомеры практически неразличимы, одиако человеческий организм усваивает лишь L-аминокислоты (за исключением метионина). Для большинства биотехнологических процессов D-аминокислоты также не представляют ценности.
Разделение смеси L- и D-аминокислот, так называемой рацемической смеси, на составляющие их изомеры стало первым процессом в мире, осушествленным с помощью иммобилизованных ферментов на промышленном уровне. Этот процесс был реализован в Японии на предприятии, принадлежащем компании «Танабе Сейяку» в 1969 г. В течение 15 предшествующих лет данный процесс проводился с применением растворимого фермента — аминоацилазы, но он был недостаточно экономичен (I. Chibata, 1976). После перехода на иммобилизованную аминоацилазу экономическая эффективность процесса возросла в полтора раза, и в настоящее время компания осуществляет на промышленном уровне производство пяти L-аминокиелот, из них четыре незаменимые (метионин, валин, фенилаланин, триптофан).
В качестве исходного вещества используются ацилированные D, L-аминокислоты, полученные с помощью обычного химического синтеза. Фермент аминоацилаза гидролизует один ацил-L-изомер, отщепляя от него объемную ацильную группу, и тем самым резко увеличивая растворимость образующейся L-аминокислоты по сравнению с присутствующим в реакционной системе ацил-D-изомером. После этого вещества легко отделяются друг от друга путем известных физико-химических методов. Так выделяется чистая L-аминокислота.
Остающаяся ацил-О-аминокислота при нагревании рацемизуется, т. е. переходит опять в смесь ацилированных D, L-амино-кислот, и процесс повторяют сначала. Таким образом, в итоге единственным продуктом является L-аминокислота. Оказалось, что для аминоацилазы не имеет значения, какую аминокислоту ей гидролизовать, важно лишь строение ацильной части, к кото-рой фермент имеет строгую специфичносгь. В результате этого одна и та же реакционная колонна с иммобилизованной аминоацилазой может быть применена в производстве самых различных L-аминокислот.
Иммобилизованный фермент легко готовить, так как он легко адсорбируется ма специальной смоле, которую затем помещают в реакционную колонну. Время полуииактивации иммобилизованного фермента в промышленных условиях составляет 65 сут. Когда активность катализатора падает ниже нормы, в колонну добавляют раствор свежего фермента (раз в несколько месяцев), который опять адсорбируется на носителе. Устойчивость полимерного носителя высокая; так, на предприятии японской ком-пании «Танабе Сейяку» он используется более 8 лет в одной и той же колоине без замены (I. Chibata, I978).
Источник
Технология производства ферментных препаратов
Производство ферментных препаратов осуществляется двумя способами — поверхностным и глубинным. Поверхностный способ в основном применяется для культивирования микроскопических грибов. В его основе выращивание микроорганизмов на твердых (реже жидких), рыхлых питательных средах; при глубинном культивировании микроорганизмы выращивают в толще жидких питательных сред. В этих условиях можно культивировать как аэробные, так и анаэробные микроорганизмы.
Поверхностный способ
Технологический процесс производства ферментных препаратов при поверхностном культивировании микроорганизмов-продуцентов состоит из следующих основных стадий: получение посевного материала, приготовление питательной среды, выращивание культуры микроорганизма, сушка культуры или выделение из культуры очищенных препаратов ферментов.
Получение посевного материала. Для промышленного получения ферментных препаратов из микроорганизмов, выращиваемых в поверхностных условиях, в качестве посевного материала используют культуру микроскопических грибов, выращенную на твердой питательной среде, а также споры (конидии) и мицелиальную массу продуцента, выращенного в глубинных условиях на жидкой питательной среде.
Для получения посевной культуры на твердой питательной среде используют увлажненные пшеничные отруби. Среда должна быть рыхлой. С этой целью к пшеничным отрубям добавляют 5-10% Древесных опилок или 15-20% солодовых ростков. После стерилизации в течение часа при 0,15 МПа влажность питательной среды должна составлять 35-60%.
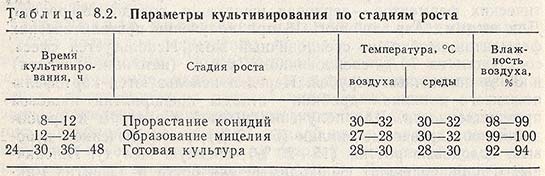
Питательную среду, охлажденную до 35 °С, засевают суспензией конидий (500-600 тыс. конидий в 1 мл на 10-15 г отрубей), а затем раскладывают слоем 10-15 см по стерильным посевным кюветам. Закрытые кюветы со средой помещают в растильные камеры, где поддерживают определенную влажность и температуру. Для большинства микроскопических грибов в первые сутки роста поддерживается температура 28-32 °С, влажность 70-95%; во вторые — 26-30 °С, влажность 60-85%, в третьи — 24-26 °С, влажность 55-64%. Максимум образования конидий обычно приходится на 72-85-й часы роста. После этого посевные кюветы выдерживают еще 72-96 ч при температуре 8-10 °С. Подсохшая культура может сохранять способность к прорастанию конидий в течение 15-20 сут.
Споровый посевной материал может быть получен из подсушенной культуры. Для этого культура гриба подается в вибросепаратор, где отделяются споры (конидии). С помощью вакуума они поступают в приемник, предварительно проходя через сетчатый фильтр. Такой споровый материал может храниться в течение 1,5 лет при температуре 8-24 °С. Культивирование посевного материала, например Aspergillus terricola, глубинным способом проводится в ферментаторах на 8-10 л, которые заполняют 3 л питательной среды, в течение 24-30 ч при температуре 30 °С. Полученный посевной материал — глубинную культуру гриба — вносят в стерилизатор со стерильными, охлажденными до температуры 33-34 °С увлажненными отрубями из расчета 1-2% исходного глубинного посевного материала к массе воздушно-сухих отрубей. Влажность питательной среды после внесения посевной культуры должна быть не ниже 58-60%.
Приготовление питательной среды. Основным компонентом питательной среды для выращивания микроскопических грибов рода Aspergillus поверхностным способом служат пшеничные отруби, для Tr. roseum — продуцента цитолитических ферментов — зерновая шелуха и солодовые ростки. Для штамма Asp. awamori 16 при получении пектолитических ферментов необходим свекловичный жом. Используется смесь, состоящая из 70% свекловичного жома (источник пектина) и 30% пшеничных отрубей. Нередко используются картофельная мезга и пивная дробина — отходы предприятий пищевой промышленности. Для получения рыхлой структуры к средам добавляют древесные опилки (5-10%), за исключением дубовых, солодовые ростки (15-20%), овсяную шелуху. Пшеничные отруби содержат необходимые для роста и развития микроорганизмов питательные вещества, в том числе незаменимые аминокислоты метионин (19%), триптофан (0,3%) и лизин (0,6%), 16-20% крахмала, 10-12% белка, до 4% жира, различные фосфорные соединения, минеральные соли, микроэлементы и некоторые другие вещества.
Подготовка твердых питательных сред для выращивания микроорганизмов состоит в том, что пшеничные отруби, солодовые ростки, опилки, как правило, смешивают в стерилизаторе (50-60% по объему) и полученную смесь перед стерилизацией увлажняют до 20-40%-ной влажности. Стерилизаторы рассчитаны для работы при температуре от 104 до 140 °С при избыточном давлении до 0,03 МПа. Вместимость стерилизаторов колеблется от 300 до 500 кг.
Для получения высокоактивных культур существенное значение имеет начальная влажность питательной среды. Она обычно колеблется в пределах 58-60%. При повышении влажности среды ухудшается аэрация растущей культуры, а при понижении замедляется рост мицелия и снижается активность синтезируемых ферментов. В производственных условиях к концу цикла выращивания влажность снижается до 35-40% даже несмотря на поддержание относительной влажности воздуха, близкой к 100%.
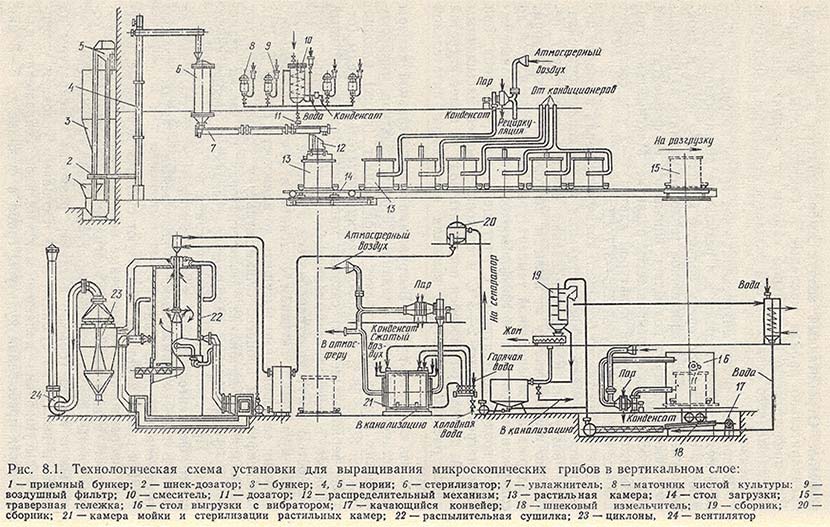
Выращивание культуры-продуцента в производственных условиях. В простерилизованную и охлажденную до температуры 40 °С питательную среду при непрерывном перемешивании вносят посевной материал и стерильную воду с таким расчетом, чтобы конечная влажность подготовленной среды была 58-60%. Засеянную конидиями чистой культуры грибов или глубинной посевной культурой питательную среду раскладывают слоем 2-3 см в кюветы или в вертикальные кассеты толщиной 4-5 см. Выдерживают обычно при температуре 28-32 °С в течение 22-40 ч в специальных растильных камерах или на механизированных установках. Готовая культура в кюветах подается к дробилке.
В растильных камерах на 1 м3 объема приходится (по сухой массе) от 8 до 18 кг отрубей. Микроорганизмы культивируют при строго определенных температуре, аэрации, влажности (табл. 8.2).
Общая длительность культивирования составляет, например, для Asp. oryzae 30-36 ч, для Asp. awamori (продуцент амилазы) — 36-42 ч, для Asp. awamori (продуцент пектиназы) — 46-48 ч, для Asp. terricola — 44-48 ч, для Asp. foetidus — 48-52 ч.
Кондиционирование воздуха, идущего на аэрацию, осуществляется в кондиционерах. В главном кондиционере воздух, забираемый из атмосферы, подогревают или охлаждают в зависимости от времени года до температуры 22-24 °С. Затем последовательно частично воздух обеспложивается на висциновом и ватном фильтрах и поступает в индивидуальные кондиционеры. В них очищенный воздух подогревается в калорифере до температуры 30 °С и увлажняется паром до влажности, близкой к 100%.
Рециркулирующий в системе воздух проходит следующую обработку: забранное воздухом тепло при прохождении через камеру (установку для выращивания) снимается на воздухоохладителе, затем воздух из главного кондиционера смешивается с 10% свежего воздуха, доводится до требуемых параметров и вновь поступает в камеру или установку для выращивания. Отработанный воздух выбрасывается в атмосферу, предварительно пройдя масляные и бактериальные фильтры. Для предохранения растильной камеры от проникновения необеспложенного воздуха в ней создается небольшое избыточное давление.
В процессе роста микроскопические грибы потребляют 25-35% сухих веществ среды и в результате диссимиляции выделяют в окружающую среду большое количество тепла и диоксида углерода. Если избыточное тепло не удалять из растильных камер, культура подсыхает, снижается ее ферментативная активность и даже прекращается развитие. Максимальное тепловыделение растущей культурой длится 1-2 ч и составляет к массе исходных отрубей 335-377 кДж/кг.
Для отвода такого большого количества тепла проводят интенсивное вентилирование растильных камер кондиционированным воздухом. Кондиционирование воздуха преследует несколько целей: очистку от пыли и посторонней микрофлоры, поддержание определенной температуры, насыщение влагой до содержания, близкого к 100%. Проходя через растильные камеры, воздух контактирует с растущей культурой гриба, при этом нагревается на 2-3°С и становится менее насыщенным влагой, поэтому он способен поглощать воду из более нагретой массы растущей культуры, вызывая подсыхание питательной среды.
Сушка культуры. Выгружаемая из растильной камеры или установки для выращивания готовая культура микроскопических грибов представляет собой брикет (корж) влажностью от 35 до 58%, в котором частицы питательной среды (отруби, зерновая шелуха) связаны мицелием. Это неустойчивый продукт, в результате выделяющегося тепла ферменты почти полностью могут инактивироваться в течение 3 ч. Для сохранения культуры в активном состоянии в течение длительного времени ее необходимо высушить до влажности 10-13%. Для интенсификации процесса сушки культуру гриба измельчают на различных дробилках, дезинтеграторах до частиц размером 2-3 мм. К этим машинам предъявляются особые требования. При дроблении культура гриба во избежание инактивации ферментов не должна разогреваться, распыление ее должно быть минимальным, и получаемые гранулы должны иметь определенную величину.
Для сушки культуры используют сушилки ленточные, шахтные, вибрационные, прямоточные непрерывного действия и др. Скорость сушки зависит от многих факторов: химического состава среды, влажности, температуры, скорости движения сушильного агента (обычно воздуха), разности температуры на входе и выходе из сушилки и др. Основным условием успешного высушивания является максимальное сокращение длительности пребывания культуры гриба в сушилке до 5-8 мин при температуре продукта на выходе не выше 40-42°С, что снижает потери активности до минимума. Высушенную культуру гриба фасуют в крафт-мешки по 18-30 кг. Сухая культура микроскопических грибов товарный продукт.
Технологическая схема получения культуры микроорганизма, выращенной поверхностным способом на твердой питательной среде, представлена на рис. 8.1.
Глубинный способ
Данный способ выращивания микроорганизмов имеет ряд преимуществ по сравнению с поверхностным: позволяет изменять состав питательной среды, обеспечивая максимальный выход того или иного фермента, исключает тяжелый малопроизводительный ручной труд, упрощает механизацию и автоматизацию различных устройств, контролирующих параметры процесса в динамике.
Процесс производства ферментных препаратов при глубинном культивировании состоит из следующих технологических стадий: получение посевного материала, приготовление питательной среды и ее стерилизация, стерилизация воздуха, выращивание микроорганизмов-продуцентов в производственных ферментаторах, отделение биомассы от культуральной жидкости, очистка и выделение ферментов.
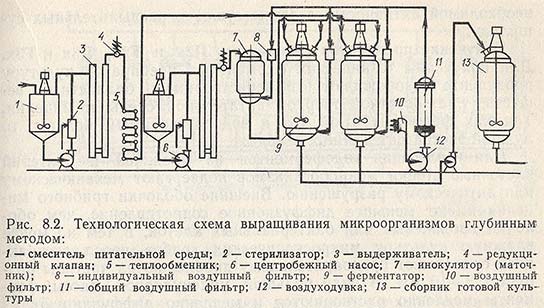
Получение посевного материала. Для получения посевного материала микроорганизм-продуцент пересевают в пробирки на скошенную агаризованную питательную среду. Микроскопические грибы при температуре 28-32 °С выращивают до обильного конидиеобразования, для бактериальных культур наиболее благоприятный возраст посевного материала устанавливают экспериментально. Водную суспензию культуры, выращенной на твердой питательной среде, из расчета 1-5% пересевают на жидкую питательную среду (50-100 мл) в колбы на 750 мл. Культивирование микроскопических грибов проводится при температуре 28-32°С, бактерий — при температуре 32-37 °С в течение 30-40 ч на качалке при 180-200 об/мин. Чтобы обеспечить посевным материалом большие объемы засеваемой производственной среды, культуру, выросшую в колбах, стерильно переносят в малый, а затем в большой инокулятор. Вместимость больших инокуляторов составляет 10% от объема производственного ферментатора.
Выращивание проводят при указанных выше температурах для микроскопических грибов и бактерий при непрерывном перемешивании и аэрации стерильным воздухом. Расход воздуха на 1 м3 аэрируемой жидкости обычно составляет 60 м3/ч. Необходимое количество посевного материала зависит от физиологических показателей микроорганизма-продуцента. Например, если продуцент обильно образует споры, расход посевного материала уменьшается и, наоборот, увеличивается, если микроорганизм размножается вегетативно. Для актиномицетов расход посевного материала может быть 5-20%, для спороносных бактерий — около 1%.
Приготовление питательных сред. При глубинном способе культивирования состав питательных сред подбирают в зависимости от физиолого-биохимических особенностей микроорганизма-продуцента и того фермента или ферментного комплекса, который необходимо получить в производственных условиях. Для приготовления питательных сред для глубинного культивирования основным сырьем служат кукурузная мука, крахмал пшеничный и картофельный, кукурузный экстракт, свекловичный жом. Источником азота могут быть минеральные соли NaNO3, (NH4)2SO4, NH4NO3, (NH4)HPO3, NH4H2PO4, (NH4)2HPO4 и азот органических соединений, гидролизаты казеина и дрожжей. В качестве источника углерода используют различные углеводы, наиболее легко усваиваемые микроорганизмом, — крахмал, глюкоза, декстрины, мальтоза и др.
При биосинтезе целлюлозолитических ферментов источником углерода в среде может быть целлюлоза (в виде древесины), хлопок, солома; при биосинтезе липолитических ферментов источником углерода служат липиды. В состав питательной среды должны входить такие минеральные вещества, как фосфор, сера, железо, цинк, калий, кальций, магний и др. Питательные среды готовят на водопроводной воде. В зависимости от микроорганизма-продуцента содержание сухих веществ в средах колеблется от 1,5 до 10% и более.
Приготовление и стерилизация питательной среды для глубинного культивирования микроорганизмов-продуцентов ферментов не отличаются от общепринятых приемов, применяемых в производстве других продуктов микробного синтеза.
Технологическая схема культивирования микроорганизмов-продуцентов ферментов. Схема представлена на рис. 8.2.
Приготовление питательной среды для выращивания посевного материала и производственного культивирования осуществляется в смесителях. Стерилизацию проводят на установках типа УНС. Посевной материал, выращенный в инокуляторе, подается для засева питательной среды ферментатора. Для аэрирования растущей культуры в инокуляторе и ферментаторе воздух проходит подготовку и очистку в аппаратах: в фильтре предварительной очистки 10, воздуходувке 12, головном фильтре 11 и индивидуальных фильтрах 8, установленных у инокулятора и у каждого ферментатора. Готовая культуральная жидкость насосом 6 перекачивается в сборник 13, из которого поступает на выделение ферментного препарата.
Производство технических и очищенных ферментных препаратов
Технические и очищенные ферментные препараты представляют собой либо жидкости с концентрацией сухих веществ не менее 50%, либо порошки различного цвета с определенной стандартной активностью. Иногда они содержат один фермент, но чаще — комплекс ферментов. Технические и очищенные ферментные препараты имеют целый ряд преимуществ по сравнению с сухой культурой грибов. Они содержат ферменты в более концентрированном виде, способны дольше сохраняться без потерь активности. Кроме того, очищенные ферментные препараты не содержат спор микроорганизмов — продуцентов ферментов.
Технологическая схема получения очищенных ферментных препаратов при поверхностном или глубинном способе культивирования состоит из следующих стадий: получение посевного материала, подготовка и стерилизация питательной среды, стерилизация воздуха, засев питательной среды, культивирование микроорганизмов-продуцентов в ферментаторах, растильных камерах на кюветах или механизированных растильных установках, отделение биомассы от культуральной жидкости, экстракция ферментов из культуры гриба, выращенной поверхностным способом на твердых питательных средах, концентрирование культуральной жидкости, стандартизация ферментных препаратов, сушка стандартизованных ферментных растворов в распылительных сушилках.
Очищенные ферментные препараты получают из водных растворов ферментов. Для очистки от балластных веществ применяют различные методы: диализ, осаждение органическими растворителями и нейтральными солями, извлечение ферментов из сложных комплексов методом их иммобилизации. Ферментные осадки, полученные осаждением органическими растворителями и солями, растворяют в воде и стандартизуют до необходимой активности, а затем сушат в распылительных сушилках.
Получение препаратов с индексом П2х и Г2х, П3х и Г3х
Для получения технических ферментных препаратов культуру продуцента освобождают от нерастворимых балластных веществ, т. е. остатков твердой питательной среды и мицелия. Так как ферменты относятся к водорастворимым белкам, то лучший экстрагент для них — вода.
Для извлечения эндоферментов из дрожжей и бактерий клеточные стенки микроорганизмов подвергают механическому или литическому разрушению. Внешние оболочки грибного мицелия имеют меньшее диффузионное сопротивление, чем оболочки дрожжевых или бактериальных клеток, и тем не менее влажную культуру микроскопических грибов перед экстракцией подвергают предварительному дроблению на частицы размером 3-10 мм. В силу большой молекулярной массы ферменты медленно растворяются и медленно диффундируют из поверхностной культуры микроскопических грибов в экстрагирующую жидкость. Лабильность ферментов вынуждает проводить процесс при температуре 27-30 °С, а это увеличивает длительность экстракции, приводит к инфицированию культуры и инактивации ферментов.
Культура микроскопических грибов, выращенная в поверхностных условиях на твердом питательном субстрате, содержит около 50-55% сухих веществ. Если общее количество СВ культуры принять за 100%, то только 25-30% составляют водорастворимые соединения, в состав которых входят белки, ферменты, аминокислоты, углеводы, минеральные соли. Нерастворимая часть (70-75% СВ) в основном содержит клетчатку, гемицеллюлозу и др. Таким образом, экстрактивная обработка культуры гриба водой позволяет избавиться на 70-75% от балластных веществ и повысить концентрацию ферментов (по отношению к сумме СВ, содержащихся в растворе) в 3,5-4 раза. Основной движущей силой экстракции является разность концентраций извлекаемого вещества в смачивающей культуру жидкости и в экстрагирующей жидкости. Процесс диффузии прекращается при выравнивании концентраций.
Растворимые вещества, перешедшие в экстракт, на 50% состоят из азотистых соединений, из которых 0,5% составляют ферменты, около 29,5%-углеводы, а остальные 20%-минеральные вещества.
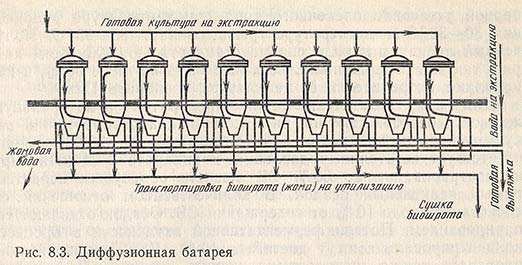
Наиболее эффективной является противоточная экстракция. В промышленности для экстракции ферментов из поверхностных культур микроскопических грибов применяют специальные 8-секционные диффузионные батареи Роберта, в которых также используется этот принцип (рис. 8.3).
Все диффузоры батареи унифицированы и имеют форму вертикального цилиндра с откидной герметически закрывающейся крышкой и коническим днищем. В верхней части на расстоянии 150-200 мм от переливного штуцера расположена двойная сетка с ребрами жесткости. Все диффузоры соединены коммуникациями таким образом, что в каждый аппарат можно подавать как свежий растворитель, так и вытяжку из предыдущего диффузора. Любой аппарат можно отключить, не нарушая работы всей батареи. В процессе работы все восемь диффузоров заполнены культурой. Один из аппаратов находится под разгрузкой, а другой под загрузкой. В каждый из диффузоров вместимостью 300 л загружают 54-60 кг культуры по абс. СВ. Вода температурой 25-27 °С с небольшим количеством антисептика (0,02%-ный раствор формалина) поступает в первый (хвостовой) диффузор. После его заполнения воду перекрывают и массу выдерживают 30 мин. Затем возобновляют подачу воды и жидкая среда из первого диффузора переходит во второй. Массу во втором аппарате также выдерживают 30 мин. Процесс продолжается до головного — восьмого диффузора, из которого вытяжка собирается в сборник. Полученная вытяжка содержит 10-12% СВ. Выход ферментов в экстракт в значительной степени зависит от количества отобранной вытяжки по отношению к культуре, находящейся в диффузоре. Например, полное извлечение амилолитических и протеолитических ферментов из культуры Asp. oryzae достигается при отборе экстракта не менее 220% к абсолютно сухой массе загруженной культуры, а пектолитических ферментов из культуры гриба Asp. awamori — при отборе 350% экстракта к загружаемой массе. Полнота извлечения амилолитических ферментов из культуры гриба Asp. awamori достигается при отборе экстракта 400% к загруженной культуре.
Полученную диффузионную вытяжку направляют на вакуум-выпарную установку, где концентрация сухих веществ повышается до 50%. Вытяжка концентрируется в вакуум-выпарной установке пленочного типа при температуре упаривания 30-32 °С и температуре греющего пара 80-85 °С. Полученный препарат в виде сиропа стандартизуют хлоридом натрия, так как содержание СВ должно быть не ниже 50%, и направляют потребителю. Номенклатура препарата П2х.
Для получения технических препаратов культуральную жидкость освобождают от биомассы и концентрируют в вакуум-выпарных аппаратах при температуре 25-30 °С, что соответствует остаточному давлению в аппарате 3-4 кПа. При концентрировании до 50% СВ веществ образуется нерастворимый неактивный осадок. В количественном отношении он составляет около 10% от содержания СВ. Осадок отделяют сепарированием. Потери ферментативной активности в процессе концентрирования могут достигать 10%. Для стандартизации препарата также используют хлорид натрия. Полученный стандартный сироп с индексом Г2х разливают в емкости по 40-50 кг.
При высушивании в распылительной сушилке диффузионной вытяжки и концентрата глубинной культуры с содержанием 10-12% СВ получают препараты с индексом ПЗх и Г3х. В процессе сушки большое количество сахаров в диффузионной вытяжке и в концентрате глубинной культуры приводит к налипанию препарата на внутреннюю поверхность сушилки. Для предотвращения этого к диффузионной вытяжке добавляют хлорид натрия из расчета 50%-ного содержания СВ, а к концентрату культуральной жидкости — 200 кг/м3. Высушенный препарат стандартизуют по активности хлоридом натрия и фасуют в крафт-мешки с полиэтиленовыми вкладышами.
Получение препаратов с индексом П10х и Г10х
В качестве примера можно представить технологический процесс получения препарата прототерризина П10х. Готовую культуру Asp. terricola штамм 3374 для очистки от балластных веществ направляют на диффузионную батарею. Получаемая диффузионная вытяжка содержит около 10% СВ, концентрация протеолитических ферментов составляет 0,25-0,28 ед./мл.
Процесс экстракции в диффузионной батарее проводят в таком режиме, чтобы отбор вытяжки составлял примерно 300% от массы абсолютно сухой культуры гриба, предназначенной для экстракции. Потери протеолитических ферментов не превышают 25%. Очистку ферментного экстракта от балластных веществ проводят на непрерывно действующих сепараторах. Перед подачей на сепаратор в вытяжку добавляют раствор аммиака и доводят pH до 8,4-8,6. На стадии сепарирования удается отделить до 6% балластных веществ от общего содержания СВ в вытяжке, потери протеолитических ферментов составляют не более 1%. Из сепаратора фугат направляют на непрерывно действующую установку, где к нему добавляют уксусную кислоту с тем, чтобы pH осветленной вытяжки довести до значения 6,0-6,2, и этанол концентрацией 96% об. Для осаждения ферментов могут быть использованы и другие органические растворители: метанол, ацетон, изопропанол.
Способ выделения ферментов из водных растворов органическими растворителями принято считать более эффективным по сравнению с высаливанием, т. к. он менее сложен, а растворители легко регенерировать перегонкой. Действие органических растворителей основано на снижении диэлектрической постоянной среды. Известно, что силы электростатического притяжения и отталкивания обратно пропорциональны диэлектрической постоянной. При смешивании водной вытяжки ферментов со спиртом происходит уменьшение этой постоянной, что способствует взаимодействию белковых молекул. Они теряют растворимость, образуют агрегаты и выпадают в осадок.
Осаждение ферментов проводят либо в реакторах периодического действия, либо в непрерывном потоке, регулируя ротаметрами объемы смешиваемых жидкостей. Чтобы сократить потери ферментов при смешивании экстракта с растворителем, осаждение проводят при пониженных температурах. Этанол перед подачей в установку охлаждают до — 5-8°С, а водную вытяжку — до 5-6 °С. Для отделения ферментного осадка от водно-спиртовой смеси применяют центрифугирование. Полученный осадок смешивают в смесителе с двумя объемами 96%-ного этанола на единицу массы осадка с целью промывки и дальнейшего обезвоживания. После центрифугирования осадок влажностью 30-35% направляют на сушку, которая ведется в вакуум-сушильных аппаратах периодического действия или в распылительных и сублимационных сушилках. Длительность периодической сушки (8-16 ч) зависит от температуры сушки и конечной влажности осадка. По достижении осадком влажности 10-13% сушку прекращают. Сухой продукт измельчают, смешивают с наполнителем до получения стандартной активности. Стандартный препарат фасуют по 0,5 кг в полиэтиленовые мешки, которые укладывают в жестяные коробки.
Для получения очищенных ферментных препаратов с индексом Г10х (на примере получения препарата пектаваморина Г10х) культуральную жидкость отделяют от биомассы. Биомасса поступает на сушку при температуре греющего воздуха 300-350 °С. Выход биомассы из 1 м3 культуральной жидкости составляет 100 кг при содержании сухих веществ 15%. Потери ферментов на этой стадии не превышают 5%. Полученный фильтрат культуральной жидкости упаривают до 1/7 первоначального объема, в результате содержание СВ в концентрате увеличивается с 2 до 12,5%. При концентрировании раствора ферментов наблюдается выпадение неактивного осадка. Потери ферментов на этой стадии не превышают 10%. Концентрат культуральной жидкости освобождают от неактивного осадка на сепараторах. Для осаждения пектолитических ферментов используют охлажденный до 4-6°С фугат концентрата с содержанием 12,5 % СВ. В качестве осадителя ферментов применяют охлажденный до температуры — 4-10 °С этанол. Осаждение проводится при концентрации спирта в смеси 76% об. при соотношении объемов концентрата культуральной жидкости и этанола 1:4,5. Полученная водно-спиртовая смесь подается на сепаратор. Ферментный осадок, полученный после сепарации, растворяют в трех объемах воды, а затем стандартизуют бентонитом или желатином, применяемыми в качестве наполнителя. Количество наполнителя рассчитывают с учетом активности концентрата, готового продукта и потерь в процессе сушки стандартизованного ферментного раствора.
Полученный полупродукт направляют в распылительную сушилку. Ферментный осадок сушат при температуре теплоносителя на входе в сушилку 160 °С и на выходе из сушилки 60-75 °С. Режимы сушки обеспечивают достижение 8%-ной влажности материала. На этой стадии потери ферментов составляют 5-8%.
Высушенный и стандартизованный до пектолитической активности 3000 ед./г (по медному методу) препарат фасуют по 0,5 кг в полиэтиленовые мешки, которые упаковывают в жестяные коробки. Отделенный на сепараторе отработанный этанол направляют на ректификацию, где его крепость доводят до 96,5% об. Потери спирта при ректификации составляют 1%.
Выделение препаратов с помощью органических растворителей в ряде случаев позволяет фракционировать комплекс ферментов. Например, разработан способ разделения амилолитического и протеолитического комплекса гриба Asp. oryzae методом фракционного осаждения диализованных ферментных экстрактов органическими растворителями.
Наиболее четкое разделение амилазы и протеазы происходит при температуре 0°С, pH 5,1. При концентрации этанола в смеси 48-52% протеаза осаждается почти полностью, а амилаза — только на 10%. После отделения осадка протеазы концентрацию этанола повышают до 70-74%, при этом выпадает амилаза со следами протеазы. Освобождение второй фракции от остатков протеазы проводят обработкой 5% бентонита при pH раствора 4,5. Из таких высокоочищенных препаратов можно получать кристаллические ферменты.
Получение кристаллических ферментных препаратов
Технологическую схему получения кристаллических ферментов можно проиллюстрировать на примере выделения а-амилазы Asp. oryzae. Схема очистки и кристаллизации представлена ниже.
Выделение а-амилазы проводилось из комплексного ферментного препарата, полученного из поверхностной культуры гриба Asp. oryzae фракционным осаждением этиловым спиртом.
Ферментный раствор освобождали от большей части пигментов обработкой 10%-ным раствором ацетата свинца. Первичное выделение а-амилазы проводилось высаливанием сульфатом аммония. После растворения полученного осадка и освобождения от примеси аммония а-амилазу осаждали риванолом в две стадии. Первыми в осадок выпадали различные примеси, которые удаляли центрифугированием. При повторном добавлении риванола в количестве 0,07% от объема раствора а-амилаза выпадала в осадок. После перерастворения осадка и осветления полученного ферментного раствора бентонитом а-амилазу осаждали ацетоном. Осадок, растворенный в 0,02 М растворе ацетата кальция, фильтровали, а затем фильтрат насыщали ацетоном до 25-30%-ной концентрации. а-Амилаза Asp. oryzae хорошо кристаллизуются при концентрации ацетона 35-45% и выдерживании раствора при температуре 2-3 °С. Отделенные и лиофильно высушенные кристаллы имели активность 25000 ед./г.
Источник