Сульфат железа (III)
| Сульфат железа (III) | |
|---|---|
 | |
| Систематическое наименование | сульфат железа (III) |
| Традиционные названия | сернокислое железо (III), тетрасульфид (VI) железа (III) |
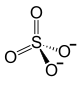
| Хим. формула | Fe2(SO4)3 |
| Рац. формула | Fe2O12S3 |
| Состояние | безводный — светло-жёлтый порошок |
| Молярная масса | |
| • разложения | 600 |
| Мол. теплоёмк. | 271,75 Дж/(моль·К) |
| Энтальпия | |
| • образования | −2580 кДж/моль |
| Растворимость | |
| • в воде | (безв.) растворим(нонагидрат) 440 г/100 мл |
| • в этаноле | (нонагидрат) растворим |
| Рег. номер CAS | 15244-10-7 (для всех гидратов с формулой Fe2(SO4)3·nH2O (где n=1, 3, 4, 6, 7, 9, 10, 12) |
| PubChem | 24826 |
| Рег. номер EINECS | 233-072-9 |
| SMILES | |
| RTECS | NO8505000 |
| ChEBI | 53438 |
| ChemSpider | 23211 и 21493902 |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
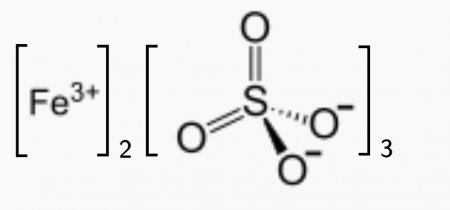
Сульфат железа (III) (лат. Ferrum sulfuricum oxydatum ) — неорганическое химическое соединение, соль, химическая формула— Fe2(SO4)3 .
Содержание
Физические свойства
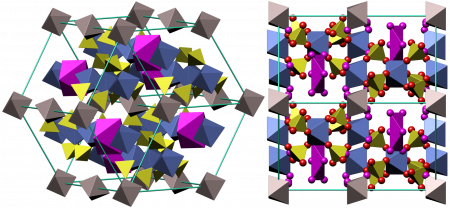
Безводный сульфат железа (III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде, трудно растворим в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа (III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды). В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минералогическая форма сульфата железа (III) — микасаит (англ. mikasaite ), смешанный сульфат железа-алюминия. Его химическая формула — (Fe 3+ , Al 3+ )2(SO4)3 . Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
- Кокимбит (англ. coquimbite ) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
- Паракокимбит (англ. paracoquimbite ) — другой нонагидрат — редкая форма.
- Корнелит (англ. kornelite ) — гептагидрат — и куэнстедтит (англ. quenstedtite ) — декагидрат — тоже встречаются редко.
- Лаусенит (англ. lausenite ) — гекса- или пентагидрат (самостоятельность этого минерала под вопросом).
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа (III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа (III) в серной кислоте:
В лабораторной практике сульфат железа (III) можно получить из гидроокиси железа (III):
Препарат той же чистоты можно получить окислением сульфата железа (II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа (III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа (II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа (III), хрома (III), аммония и калия, и вода:
Сульфат железа (III) можно получить как один из продуктов термического разложения сульфата железа (II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа (III):
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа (III):
Сульфат железа (II) можно окислить триоксидом ксенона:
Химические свойства
Сульфат железа (III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа (III):
Безводный сульфат железа (III) при нагревании разлагается:
Растворы щелочей разлагают сульфат железа (III), продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа (III) и железа (II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа (III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа (III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа (III) (гетерозит):
Источник
Сульфат железа(III)
| Сульфат железа(III) | |
 | |
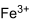   | |
| Общие | |
|---|---|
| Систематическое наименование | сульфат железа(III) |
| Традиционные названия | сернокислое железо(III), тетрасульфид(VI) железа(III) |
| Химическая формула | Fe2(SО4)3 |
| Эмпирическая формула | Fe2O12S3 |
| Физические свойства | |
| Состояние (ст. усл.) | безводный — светло-жёлтый порошок |
| Молярная масса | (безв.) 399.88 г/моль |
(пентагидрат) 489.96 г/моль
(нонагидрат) 2.1 г/см³
(нонагидрат) 175 °C
(безв.) растворим в разбавленной серной кислоте, ацетоне
15244-10-7 (для всех гидратов с формулой Fe2(SО4)3·nН2О (где n=1, 3, 4, 6, 7, 9, 10, 12)
Сульфат железа(III) (лат. Ferrum sulfuricum oxydatum , нем. Eisensulfat (oxyd) Ferrisulfat [2] ) — неорганическое химическое соединение, соль, химическая формула — 
Содержание
Физические свойства
Безводный сульфат железа(III) — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 3. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды) и этаноле, не растворяется в ацетоне. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минерал, содержащий в себе смешанный сульфат железа-алюминия называется микасаит (англ. mikasaite ), с химической формулой (Fe 3+ , Al 3+ )2(SO4)3 является минералогической формой сульфата железа(III). Этот минерал несет в себе безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще всего, например:
- Кокимбит (англ.coquimbite ) — Fe2(SO4)3·9H2O — нонагидрат — наиболее чаще встречающийся среди таковых.
- Паракокимбит (англ.paracoquimbite ) — нонагидрат — наоборот — наиболее редко встречающийся минерал в природе.
- Корнелит (англ.kornelite ) — гептагидрат — и куэнстедтит (англ.quenstedtite ) — декагидрат — так же встречаются редко.
- Лаусенит (англ.lausenite ) — гекса- или пентагидрат, малоизученный минерал.
Все перечисленные выше природные гидраты железа являются непрочными соединениями и в открытом состоянии быстро выветриваются.
Сульфат железа и ярозит были обнаружены двумя марсоходами: Спирит и Оппортьюнити. Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года марсоход Спирит застрял, когда он ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта [3] . Вследствие того, что сульфат железа имеет очень низкую плотность, то марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:

Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммиака и калия, и вода:

Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа(III):
Сульфат железа(II) можно окислить таким экзотическим окислителем, как оксид ксенона(III):
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:


Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:

Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:

Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Источник