- Способы получения элементоорганических соединений
- Элементоорганические соединения
- Элементорганические соединения. Введение С момента своего возникновения как науки до середины нынешнего века химия разделялась на неорганическую и органическую, — презентация
- Похожие презентации
- Презентация на тему: » Элементорганические соединения. Введение С момента своего возникновения как науки до середины нынешнего века химия разделялась на неорганическую и органическую,» — Транскрипт:
Способы получения элементоорганических соединений
Элементоорганические соединения
Элементоорганические соединения — органические вещества, молекулы которых содержат химическую связь «элемент — углерод». К этой группе, как правило, не относят вещества, содержащие связи углерода с атомами азота, кислорода, серы и галогенов. Согласно такой классификации, одним из элементоорганических соединений считается, например, метилнатрий CH3Na, но к ним не относится метилат натрия CH3ONa, так как он не имеет связи элемент — углерод.
Элементоорганические соединения различаются как по химическим и физическим свойствам, так и по методам их получения. Большую группу представляют металлоорганические соединения. Первое из них — диэтилцинк (C2H5)2Zn — было получено в 1849 г. Э. Франклендом. Соединения цинка широко применялись в синтезах А. М. Бутлеровым и другими учеными-химиками конца XIX в. Решающую роль в развитии химии элементоорганических соединений сыграло открытие магний- и ртутьорганических веществ. Они используются при синтезах многих элементоорганических и органических соединений.
Магнийорганические соединения были открыты в 1900 г. французским химиком Ф. Барбье и глубоко изучены его коллегой В. Гриньяром. Последний разработал метод их синтеза из галогеносодержащих углеводородов: RX + Mg → RMgX (R-углеводородный радикал, например СН3, С2Н5, С6Н5 и др., а Х-атом галогена). В наше время реакции, подобные реакции Гриньяра, стали общим методом получения металлоорганических соединений (Li, Be, Mg, Са, Sr, Ва, А1 и Zn). Причем если атом металла не одновалентен, то он образует металлоорганические соединения, содержащие как органические радикалы, так и атомы галогенов: CH3MgCl, C6H5ZnBr, (С2Н5)2АlСl.
Исследования в области ртутьорганических соединений, а также соединений свинца, олова и других металлов были начаты А. Н. Несмеяновым в 1922 г. Ртутьорганические соединения применяют для синтеза веществ, содержащих менее электроотрицательные элементы, стоящие в ряду напряжений до Hg (см. Ряд напряжений). Так получают очень активные соединения щелочных металлов и алюминия:
С помощью металлоорганических соединений получены различные производные углеводородов.
Многие металлоорганические соединения чрезвычайно легко реагируют с различными веществами. Так, метилнатрий и этилнатрий взрываются при соприкосновении с воздухом; самопроизвольно воспламеняются на воздухе органические соединения Be, Са, Ва, В, Al, Ga и др. Соединения Li, Mg и Be воспламеняются даже в атмосфере СO2.
Поскольку металлоорганические соединения очень легко окисляются, работа с ними требует специальной техники. Значительно устойчивее эфирные растворы магнийоргани-ческих веществ. Ими и пользуются обычно в лабораторной практике.
Химическая связь элемент — углерод в элементоорганических соединениях бывает как полярной (ионной), так и неполярной. Металлы, катионы которых имеют малый объем и большой заряд, образуют ко валентные связи; так возникают ртутьорганические соединения и соединения элементов IV и V групп. Металлы, легко отдающие электроны, т. е. имеющие большой объем и малый заряд ядра, например щелочные металлы, образуют ионные связи, в которых атом углерода С несет отрицательный заряд 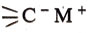
В элементоорганических соединениях фосфора и мышьяка связи элемент — углерод поляризованы в обратном, по сравнению с другими металлоорганическими соединениями, направлении. Поэтому их химические свойства сильно отличаются от свойств иных веществ аналогичного состава. Родственный углероду элемент кремний образует с ним прочные малополярные связи. При этом возникает возможность использовать способность кремния заменять посредством химических реакций нестабильные (неустойчивые) связи 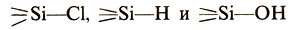
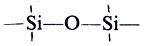
Элементоорганические соединения находят все большее применение в различных областях человеческой деятельности. Так, ртуть — и мышьякорганические вещества применяют в медицине и в сельском хозяйстве как бактерицидные, лекарственные и антисептические препараты; оловоорганические соединения — в качестве инсектицидов и гербицидов и т. д.
Источник
Элементорганические соединения. Введение С момента своего возникновения как науки до середины нынешнего века химия разделялась на неорганическую и органическую, — презентация
Презентация была опубликована 3 года назад пользователемАнна Паненкова
Похожие презентации
Презентация на тему: » Элементорганические соединения. Введение С момента своего возникновения как науки до середины нынешнего века химия разделялась на неорганическую и органическую,» — Транскрипт:
2 Введение С момента своего возникновения как науки до середины нынешнего века химия разделялась на неорганическую и органическую, две ветви, в значительной степени обособленные друг от друга. На их стыке зародилась и сейчас бурно развивается новая пограничная область химии, которая представляет собой как бы «третью» химию — химию соединений, включающих в себя непосредственно связанные между собой атомы углерода и других элементов Периодической системы, за исключением соединений углерода с водородом, кислородом, азотом, серой, хлором, бромом и иодом. Последние, как известно, называют элементами- органогенами.
3 Особенно велики заслуги академика А.Н. Несмеянова, предложившего термин «элементорганическая химия» и создавшего первый в мире Институт элементоорганических соединений (ИНЭОС) Российской Академии наук. А.Н. Несмеянов стал основоположником крупнейшей школы химиков- элементоргаников в Москве. В те же годы сложились и в настоящее время успешно работают крупнейшие школы элементоргаников и в других научных центрах России. Широкое развитие эта область химической науки и промышленности получила практически во всех развитых странах. академик А.Н. Несмеянов Введение
4 Элементорганические соединения Ферроцен – пример элементоорганического соединения Элементорганические соединения органические вещества, в которых углерод непосредственно связан с атомами, отличными от водорода, кислорода, серы, азота, галогенов. Обычно элементорганические соединения подразделяют на борорганические, кремнийорганические, металлоорганические соединения, а также фосфорорганические соединения. Реакционная способность данных соединений определяется прежде всего прочностью связи между атомами углерода и элемента и полярностью. В природе соединения встречаются крайне редко; большинство из них являются синтезированными.
6 1)изучение строения, физико-химических свойств и реакционной способности элементорганических соединений; 2)установление взаимосвязей между строением и свойствами элементорганических соединений; 3)направленный синтез соединений с практически важными свойствами или новыми структурами. Задачи элементорганической химии Области исследований ЭОС достаточно широка: 1.Синтез, выделение и очистка новых соединений. 2. Разработка новых и модификация существующих методов синтеза ЭОС. 3. Исследование механизмов и стереохимии химических реакций. 4. Развитие теории химического строения ЭОС. 5. Разработка новых экспериментальных и теоретических методов изучения строения, физико-химических свойств и реакционной способности ЭОС. 6. Выявление закономерностей типа структура – свойство. 7. Выявление практически важных свойств ЭОС. 8. Создание технологий синтеза элементорганических соединений.
7 Реакционная способность элементорганических соединений определяется прежде всего характером связи углерод-элемент, ее прочностью, полярностью и т. п. Основная группа элементоорганических соединений — металлоорганические соединения. Особое место среди них занимают p- комплексы переходных металлов с ненасыщенными органическими лигандами. В таких соединениях присутствуют делокализованные ковалентные связи металл-лиганд, в образовании которых участвуют целиком или частично заполненные d- орбитали металла. В элементорганических соединениях других элементов, включая большинство элементоорганических соединений непереходных металлов, а также некоторые соединения переходных металлов, как правило, существуют s-связи углерод-элемент различной полярности. Реакционная способность
8 Особенности связи «углерод-элемент» Практически все элементы, включая инертные газы, способны образовывать с атомами углерода химические связи Э-С, характер которых зависит в первую очередь от положения элемента в Периодической системе. Любая химическая связь характеризуется совокупностью свойств: прочностью (энергией), длиной, полярностью, кратностью и т.д. В классической теории валентности (теории валентных связей) каждой химической связи между атомами соответствует одна обобществленная пара электронов. В зависимости от способа образования химической связи в ЭОС выделяют ковалентную связь, образованную с участием электронов, предоставляемых обоими атомами, и координационную связь, в которой пара электронов принадлежала одному из атомов (донору); его партнер (акцептор) предоставляет для образования связи вакантную орбиталь. По степени смещения центра тяжести связующего электронного облака химические связи делят на неполярные и полярные. Крайним случаем последних являются ионные связи, в которых электронная пара полностью принадлежит одному из атомов. По числу электронных пар, образующих химическую связь, ковалентные и координационные связи разделены на простые (ординарные) и кратные.
9 Особенности связи «углерод-элемент» 1) преимущественно ионные, образованные элементами главных подгрупп I (Li-Fr) и II (Be-Ba) групп; 2) преимущественно ковалентные, образованные элементами главных подгрупп III (B-Tl), IV (Si-Pb) и V (P-Bi) групп и подгрупп Cu и Zn; 3) преимущественно с участием d-орбиталей (ЭОС переходных металлов): Sc-Ni, Y-Pd, La-Pt. Все ЭОС по характеру связи Э-С можно условно разделить на три типа:
10 Все типичные элементы могут образовывать простые s-связи Э-С с участием негибридизованных s- орбиталей (элементы I группы) и гибридных sp-, sp 2-, sp 3-орбиталей. Партнеры связи Э-С различаются по электроотрицательности. Это понятие ввел в 1932 году Л. Полинг. Углерод в этом ряду занимает промежуточное положение среди наиболее распространенных элементов. В общем случае полярность связи С-Э с участием типичных элементов возрастает в главных подгруппах Периодической системы сверху вниз: растет эффективный отрицательный заряд на атоме углерода и снижается стабильность веществ. В пределах периода полярность связи уменьшается слева направо; в этой же последовательности растет устойчивость ЭОС. Простые связи Э-С шкала Полинга
11 До 60-х годов считали, что элементы третьего и более высоких периодов не способны образовывать кратные связи между собой и атомом углерода (гипотеза Малликена-Пицера). Неоднократные попытки синтезировать фосфорные, кремниевые и другие аналоги этилена и ацетилена были безуспешными, однако (начиная с 1961 года) при низких температурах были зафиксированы спектральными методами некоторые фосфор- и кремнийорганические непредельные вещества. Позднее были синтезированы вполне устойчивые элементоорганические аналоги алкенов, ацетиленов, пиридина и многие другие. Однако существуют ЭОС типичных элементов, которые не поддаются описанию в рамках классических представлений о локализованных двухцентровых двухэлектронных связях. Это так называемые электронодефицитные молекулы, в которых число валентных электронов меньше 2(n — 1), (n — число атомов в молекуле). Такие ЭОС образуют элементы подгруппы бериллия и бора. Кратные связи С=Э и Э=Э
12 Как и типичные элементы, переходные металлы (ПМ) образуют с углеродом ординарную двухэлектронную двухцентровую связь. Такая связь сильно поляризована, и устойчивыми являются далеко не все алкильные или арильные производные металлов. Органические группы в этих соединениях (s-комплексах) предоставляют для образования связи Э-С один электрон и относятся, таким образом, к типу одноэлектронных лигандов. Однако самая характерная особенность ПМ заключается в их способности образовывать координационные соединения с непредельными лигандами. Полное описание связи металла с олефином, впервые разработанное Чаттом, Дьюаром и Дункенсоном, предполагает образование s- и p- связывания металла с двойной углерод-углеродной связью лиганда: p- электроны связи С=С предоставляются для образования координационной s-связи; ПМ при этом использует свои вакантные р- или d-орбитали. Связь «углерод – переходный металл»
13 Вместе с тем осуществляется и обратная передача электронов с заполненной d- орбитали металла на разрыхляющую орбиталь олефина. По своей природе эта обратная связь (ее называют дативной) является p-связью. Наличие дативных связей обусловливает кратный характер связывания С-ПМ и отличает ЭОС ПМ от соединений углерода с типичными элементами и органогенами. Количество непредельных лигандов, которое может быть связано одновременно с атомом ПМ в его p-комплексах определяется правилом 18 электронов: атом ПМ стремится образовать электронную оболочку соответствующего инертного газа. В то же время непредельный лиганд способен тонировать атому ПМ различное число p- электронов — существуют двух-, трех-, четырех-, пяти- и шести электронные лиганды. Характером лигандов, окружающих центральный атом, определяется и структура соответствующего органического производного металла. Связь «углерод – переходный металл»
14 Борорганические соединения (БОС) содержат атом бора, связанный с органическим остатком. Включают: органобораны; нейтральные комплексы; органобораты; борониевые соли. К БОC также относят соединения содержащие бор в цикле (борацикланы), внутрикомплексные соединения и органокарбораны. Синтезированы диборные и полиборные соединения. Во всех этих веществах координационное число бора 3 или 4. Наиболее изучены алкил-, циклоалкил-, арил-, алкенил- и аллилбораны, а также борацикланы. Борорганические соединения БОС широко применяются в органическом синтезе. Органобораны алкилируют, арилируют и нивелируют гало формы, тиосоединения и α- галоген карбонильные соединения в присутствии оснований, генерирующих карбанион. Последний реагирует с органобораном с образованием α-галоген- или α-тиоалкилсодержащего БОС, претерпевающего 1,2-анионотропную перегруппировку. Эти реакции применяются в синтезе вторичных и третичных спиртов, альдегидов и кетонов.
15 Кремнийорганические соединения Основное применение мономерных КОС – синтез кремнийорганических полимеров. Моно- и дифункционалъные КОС используют в производстве кремнийорганических жидкостей, дифункционалъные – при получении кремнийорганических каучуков; ди-, три-, тетра- и полифункционые в производстве смол и лаков. КОС применяют также в качестве гидрофобизаторов, антиадгезивов, аппретов для стекловолокна, текстильных и строительных материалов, наполнителей пластмасс, для модифицирования поверхностей и др. материалов; получения покрытий для микроэлектронных устройств, специальной керамики; в качестве исходного сырья в синтезе катализаторов полимеризации олефинов, пестицидов, лекарственных средств и т.д. Кремнийорганические соединения (КОС) содержат связь Si–С. Иногда к КОC относят все органические вещества, содержащие Si, например, эфиры кремниевых кислот. КОC подразделяют на «мономерные», содержащие один или несколько атомов Si, и кремнийорганические полимеры. Часто за основу берут название органического соединения, добавляя названия соответствующего кремнийсодержащего заместителя, например С l2 (CH 3 )SiCH 2 Si(CH 3 )C l2 – бис-(метилдихлорсилил) метан.
16 Фосфорорганические соединения Фосфорорганические соединения (ФОС) содержат в молекулах атом Р, связанный с органическими радикалами непосредственно или через гетероатом (O, S, N и др.). Первые ФОС (смесь метилфосфинов) выделены в 1846 Л.Тенаром и Берцелиусом при метилировани фосфида Са. ФОС можно классифицировать по количеству заместителей у атома Р (координационному числу), которое может быть от 1 до 6. По другой классификации, охватывающей наиболее распространенные ФОС, выделяют фосфорсодержащие кислоты и их производные, а также фосфины и родственные соединения. Известны также полифосфины и их производные и металлокомплексы. ФОС широко используют в технике, сельском хозяйстве и медицине. Многие из них в качестве комплексонов и экстрагентов применяются при получении цветных и редких металлов, для борьбы с коррозией и отложением солей в технических водах и многого другого. Ph 3 P=CH 2 + RCHO –> CH 2 =CHR + Ph 3 PO Реакция Виттига CH 2 =CHR + Ph 3 PO Реакция Виттига»>
17 Металлоорганические соединения Металлоорганические соединения (МОС) содержат в молекуле связь металл- углерод (М–С). К МОС иногда относят органические соединения В, Al, Si и некоторых неметаллов. В связи с этим используют более общий термин – элементоорганические соединения. По характеру связи металл-углерод МОС разделяются на несколько типов: 1. Соединения со связями М–С, в которых органическая группа связана с металлом двухэлектронной двухцентровой ковалентной связью. Такие соединения образует большинство непереходных металлов. 2. МОС с ионной связью М–С. Xарактерны для щелочных и щелочно- земельных металлов (за исключением Li и Мg). 3. Электронодефицитные соединения с мостиковыми двухэлектронными многоцентровыми связями М–С–М. К ним относят соединения Li, Mg, Be, Al. 4.π-Комплексы – соединения содержащие π-связанные органические лиганды (алкены, алкины, ароматические соединения). МОС этого типа характерны для переходных металлов. Для непереходных металлов известны лишь отдельные примеры.
18 Заключение Сочетая черты органических и неорганических веществ, ЭОС не просто комбинируют их свойства: они представляют собой новый, качественно иной тип химических систем, характеризующихся специфическим типом химической структуры и зачастую особым, не имеющим аналогии в классической химической молекуле характером химической связи. Сама химия ЭОС, впитывая достижения, методы и понятия смежных ветвей химической науки, с первых же этапов своего развития стала оказывать на них заметное влияние. Все крупнейшие достижения химии последних десятилетий в основном связаны с химией элементоорганических соединений. Прикладные аспекты химии ЭОС направлены на создание новых веществ и материалов для медицины (лекарственные препараты, материалы для протезирования, шовные нити и др.), радиоэлектроники (фото- и светочувствительные материалы, полупроводники, ферромагнетики и др.), сельского хозяйства (стимуляторы роста растений, пестициды, гербициды и др.) и других отраслей промышленности (катализаторы, регуляторы горения моторных топлив и др.).
19 1. Реутов О.А., Курц А.Л., Бутин К.П. «Органическая химия», том 4, издательство «Бином», Москва, Б.В. Тимохин, Элементоорганическая химия – интернет- источник 3. Белецкая И.П. Металлоорганическая химия. Часть 3.// Соросовский образовательный журнал, 2000, 2, с – интернет- источник Белецкая И.П. Металлоорганическая химия. Часть 4.// Соросовский образовательный журнал, 2000, 2, с – интернет-источник Использованные источники
Источник








