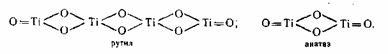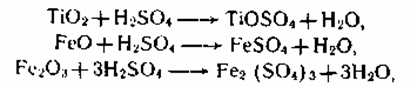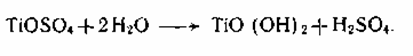Хлорный и сульфатный способы производства диоксида титана
Пигменты диоксида титана производятся по двум технологическим схемам: сульфатный и хлорный способы. Обе, анатазная и рутильная формы, могут быть произведены любым из способов. Хлорный способ стал доминирующим по причине возможности получения высококачественного пигмента с низким уровнем отходов. Из всех производителей только «Дюпон» производит все пигменты хлорным способом.
Сульфатный способ был внедрен в промышленность в 1931 г. для производства анатазной формы диоксида титана, и позже, в 1941 г., — рутильной формы. В этом способе руда, содержащая титан, растворяется в серной кислоте, образуя растворы сульфатов титана, железа и других металлов. Затем, в результате ряда химических реакций, включающих в себя химическое восстановление, очистку, осаждение, промывание и кальцинацию, образовывается базовый диоксид титана с необходимым размером частиц. Кристальное строение (анатазная или рутильная форма) контролируется в процессе ядрообразования и кальцинации.
Хлорный способ был изобретен компанией «Дюпон» в 1950 г. для производства рутильного диоксида титана. Этот способ включает в себя высокотемпературные фазовые реакции. Титаносодержащая руда вступает в реакцию с хлорным газом при пониженном давлении, в результате чего образуется тетрахлорид титана TiCl4 и примеси хлоридов металлов, которые затем удаляются.
Высокочистый тетрахлоридтитан (TiCl4) подвергается окислению под действием высокой температуры для получения диоксида титана с великолепной яркостью. Этап окисления в хлорном способе позволяет лучше контролировать кривую распределения частиц и кристаллическое строение. В результате получается диоксид титана с высокой укрывистостью и разбеливающей способностью.
Мировые мощности по производству диоксида титана хлорным способом превышают мощности сульфатного способа и продолжают расти. В обоих способах промежуточный продукт представляет собой кластеры кристаллов диоксида титана, которые затем должны быть разделены для придания оптимальных оптических свойств.
В зависимости от необходимых конечных свойств существует несколько методов для модификации диоксида титана, включающие в себя осаждение оксидов кремния и алюминия на поверхность частицы. Индивидуальная обработка оксидами поверхности в различных комбинациях позволяет достичь оптимальных свойств для каждого конкретного применения.
Сульфатная технология проще хлоридной, и позволяет использовать более бедные и дешевые руды, но она обычно сопряжена с большими издержками производства, причем строительство предприятий, на которых применяется кислотная обработка, обходиться дороже, чем строительство хлоридных заводов, хотя на последних могут понадобиться хлор-щелочные цеха.
С использованием хлоридной технологии производиться более чистый продукт с меньшим диапазоном размеров частиц, однако анатазные пигменты могут быть получены только в ходе хлоридного процесса. По оценке, более половины выпускаемого в мире оксида титана производиться с использованием хлоридной технологии.
Учитывая особенности обоих процессов, основными критериями выбора между ними являются возможность обеспечения производства сырьем соответствующего качества и проблемы, связанные с экологией.
Экологические проблемы, включая необходимость снижения объемов отходов, чрезвычайно важны для этого производства. Для предприятий по выработке пигментного диоксида титана сульфатным способом характерны наиболее высокие показатели загрязнения окружающей среды по сравнению с другими химическими производствами.
Количество твердых отходов и сточных вод, требующих очистки, на 1 т диоксида титана, получаемого по сульфатной технологии, примерно на порядок выше, чем в хлоридном процессе. За рубежом проблемы защиты окружающей среды являются решающим фактором опережающего развития производства пигментного диоксида титана хлоридным способом. В свою очередь, эта тенденция требует увеличения выработки высокосортного сырья.
В лабоpатоpиях многих фирм пpодолжается поиск новых, более дешевых и безопасных, технологий пpоизводства пигмента — диоксида титана. Одна из них pазpаботана в Институте химии Дальневосточного отделения Pоссийской академии наук. Новая технология пpедставляет собой одностадийный технологический пpоцесс, в котоpом ильменитовый концентpат обpабатывается pеагентом. Получаемый пpодукт подвеpгается нагpеву с последующим пиpогидpолизом веществ. После пиpогидpолиза из 1 т ильменитового концентpата получается около 0,5 т диоксида титана и 0,5 т железооксидного кpасного пигмента, а pеагент чеpез блок pегенеpации возвpащается для дальнейшего использования в технологическом пpоцессе.
Новая технология пpинципиально отличается от сульфидной и хлоpидной. Она пpоще, значительно дешевле, экологически чище и не имеет отходов.
Производство диоксида титана из тетрахлорида титана.
гидролиз водных растворов тетрахлорида титана (с последующей термообработкой осадка);
парофазный гидролиз тетрахлорида титана (основан на взаимодействии паров тетрахлорида титана с парами воды). Процесс обычно ведётся при температуре 900—1000°C;
термообработка тетрахлорида (сжигание в токе кислорода).
Государственный научно-исследовательский и проектный институт редкометаллической промышленности «Гиредмет» (ФГУП «Гиредмет», г.Москва) занимается комплексной разработкой технологий, конструированием оборудования, проектированием производств и оценкой качества продукции редких металлов, сплавов, полупроводниковых материалов и веществ высокой чистоты. Институт разработал оригинальную энергосберегающую и безотходную хлорную технологию производства конкурентоспособного на мировом рынке пигментного и нанодиоксида титана на базе уникального месторождения титановых руд — Ярегского нефтетитанового месторождения. Эта продукция находит широкое применение в лакокрасочной, косметической и автомобильной промышленности, в биотехнологии, фармацевтике, при производстве бумаги, катализаторов, композиционных материалов и наполнителей полимеров. Разработки ФГУП «Гиредмет» — наноматериалы на основе соединений титана, редкоземельных металлов (РЗМ) и углерода, в частности, пигментный диоксид титана, нанопорошки диоксида титана и оксидов РЗМ, люминофоры и нанопористый углерод, получили диплом Х Петербургского международного экономического форума.
Последние годы отмечены быстро растущим спросом на новый вид продукции — высокочистый нанодиоксид титана, который обладает уникальными фотокаталитическими свойствами и имеет широкие возможности применения в солнечных батареях. Использование нанопорошков диоксида титана снижает стоимость 1 кВт•ч в 5 раз по сравнению с аналогами на основе кремниевых полупроводниковых материалов. Кроме того, нанодиоксид применяют в космической отрасли и производстве специальных пластмасс для защиты от ультрафиолетового излучения, при изготовлении самоочищающихся стекол, фотокатализаторов, электрохромных дисплеев. Способ получения нанодисперсного диоксида титана основан на низкотемпературном (200–500°С) сжигании очищенного тетрахлорида титана в присутствии катализатора в паровой фазе. В зависимости от условий процесса получают рентгеноаморфный, анатазный или рутильный TiO2.
Экспериментальные образцы такого продукта имеют частицы размером от 10 до 20 нм.
Объемы производства нанодиоксида титана в мире достигают десятков тысяч тонн. Нанодисперсный продукт является одним из российских технологических приоритетов для будущего развития производственной базы пигментного диоксида титана.
C текущей ситуацией и прогнозом развития российского рынка диоксида титана можно познакомиться в отчете Академии Конъюнктуры Промышленных Рынков «Рынок диоксида титана в России».
Источник
Диоксид титана
Диоксид титана TiO2 полиморфен, он кристаллизуется в двух сингониях: брукит — в ромбической, рутил и анатаз — в тетрагональной, но последние различаются строением кристаллической решетки. В обоих случаях каждый атом титана находится в центре октаэдра и окружен 6 атомами кислорода. Пространственное же расположение октаэдров разное: в анатазе на каждый октаэдр приходится 4 общих ребра, в рутиле только 2. Элементарная ячейка анатаза состоит из четырех молекул, а рутила только из двух:
Благодаря более плотной упаковке ионов в кристаллах рутил превосходит анатаз по стабильности, плотности, твердости, показателю преломления, диэлектрической постоянной и обладает пониженной фотохимической активностью. При температуре 915 0C ‑ 950 0C анатаз переходит в рутил, но полученный при этом рутил отличается высокой абразивностью и низкой дисперсностью. В 1949 г. была найдена возможность управления кристаллизацией введением рутилизирующих добавок и зародышей. Ионы Zn2+, Mg2+, Al3+, Sn2 + являются стабилизаторами рутильной формы, ионы SO42-, PO43 — — анатазной. В присутствии даже малых количеств соединений фосфора переход анатаза в рутил становится невозможным. Рутилизирующие зародыши получают, обрабатывая гидратированный диоксид титана после пятой стадии промывки раствором едкого натра. При этом образуется тетратитанат натрия Na2Ti4O3, который обрабатывают соляной кислотой, и пептизируют продукт гидролиза, предварительно освобожденный от ионов SO42-. Такие зародыши вводятся перед прокаливанием.
Рутил, прокаленный при температуре около 10000C и содержащий примеси Fe, Cr, Ni, Mn, проявляет свойство фототропии. При освещении он становится коричневым, в темноте вновь светлеет. Это объясняется окислением примесных металлов в высшие оксиды вследствие выделения кислорода при освещении ТiO2 с деформированной решеткой.
В чистом виде диоксид титана, особенно в анатазной форме, обладает высокой фотохимической активностью, что вызывает разрушение лакокрасочной пленки («меление») и выцветание органических пигментов. Модифицирование поверхности частиц диоксида титана гидроксидами Al, Si, Zn резко уменьшает фотохимическую активность.
Диоксид титана химически инертен, нерастворим в слабых кислотах и щелочах и органических растворителях. Не ядовит, ПДК в воздухе рабочих зон 10 мг/м3. Может применяться со всеми видами пленкообразователей и растворителей. Пригоден для водоэмульсионных, воднодисперсионных и порошковых красок. Пигментный диоксид титана также широко используется для окрашивания изделий из резины, пластмасс, линолеума, бумаги и химических волокон. Кроме пигментного диоксида титана, содержащего 82—95 % (масс.) TiO2, вырабатывается диоксид титана для твердых сплавов, стекол, керамики с более высоким содержанием TiO2.
Сырье, для получения диоксида титана. Для переработки в пигментный диоксид титана используются минералы: природный рутил, содержащий 92—95 % (масс.) TiO2 и примесь Fe2O3, придающую ему красный цвет (рутил красный); ильменит FеО*ТiO2 или — арканзитFe2O3*3ТiO2; титаномагнетиты,
состоящие из зерен ильменита и магнетита и содержащие 8—12 % (масс.) TiO2.
В чистом виде титансодержащие минералы встречаются редко. Для освобождения от примесей других минералов и пустой породы измельченные руды подвергают магнитному и другим видам обогащения и получают концентраты примерного состава, % (масс.):
Технология производства пигментного диоксида титана. Переработка титановых концентратов и шлаков в пигментный диоксид титана имеет целью не только освобождение от примесей, но и придание TiO2 требуемой кристаллической формы, дисперсности, адсорбционных свойств и подавление фотохимической активности. Для получения диоксида титана применяют два способа: сернокислотный — для концентратов, содержащих более 40 % TiO2, и хлоридный,— экономически выгодный только для переработки концентратов, содержащих не менее 80 % TiO2 (так как получаемые отходы FeCl3 не находят применения).
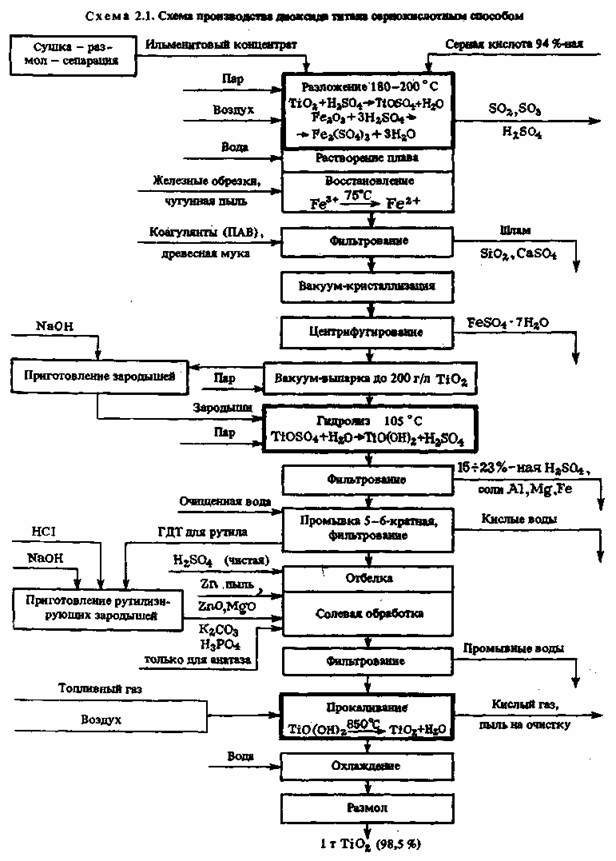
Сернокислотный способ. Это тонкий и сложный процесс, состоящий из трех основных стадий и ряда вспомогательных операций (см. схему 2.1).
1. Первой стадией является разложение тонкоизмельченного
титан-содержащего
концентрата 85—92 %-ной серной кислотой при 180—220 0C и непрерывном перемешивании реакционной массы сжатым воздухом с получением прозрачного раствора титанилсульфата TiOSO4. При этом протекают следующие экзотермические реакции разложения:
а также аналогичные реакции с оксидами Mn, Ca, Al и другими примесями. Все реакции протекают бурно после предварительного нагрева с выделением большого количества паров воды, H2SO4, SO3 и SO2, которые улавливаются в скруббере, орошаемом водой. Реакцию разложения проводят периодическим методом.
Многочисленные попытки применения реакторов непрерывного действия с механическим перемешиванием не оправдали себя как технически, так и экономически, так как наблюдался большой коррозионный и эрозионный износ аппаратуры.
Кислые растворы сульфатов титана, железа и других элементов, присутствующих в сырье, имеют сложный коллоидно-химический состав, изменяющийся в зависимости от содержания кислоты, температуры, времени выдержки.
При проведении реакции разложения реактор непрерывно продувают сжатым воздухом, который перемешивает суспензию, а затем при кристаллизации солей и застывании плава делает его пористым. После окончания реакции разложения и охлаждения плава выход по титану составляет 96—98 %. В реактор подают воду (из расчета получения раствора с содержанием TiО2 примерно 120 г/л) и все водорастворимые соли переходят в раствор.
Для последующего удаления сульфата железа(II) из раствора титанилсульфата проводят восстановление ионов Fe3+ до Fe+, для чего в реактор добавляют чугунную стружку. В кислой среде проходит реакция восстановления Fe3+ ——>- Fe2+ выделяющимся водородом. Одновременно восстанавливается и небольшое количество (3—5 г/л) Ti4+ до Ti3+. Соединения Ti3+ являются сильными восстановителями, они исключают возможность повторного окисления воздухом Fe2+ и этим предотвращают адсорбцию ионов Fe3+ на диоксиде титана, придающих ему желтую окраску.
Кислые растворы титанилсульфата, сульфатов железа, алюминия, марганца отстаивают или отфильтровывают от шлама, состоящего из остатков неразложившейся руды, диоксида кремния, нерастворимого сульфата кальция, а затем осветляют, отделяя коллоидные частицы коагуляцией с помощью флокулянтов — высокомолекулярных ПАВ. После вакуум-кристаллизации железный купорос FeSO4*7H2O отделяют от раствора центрифугированием или фильтрованием. Железный купорос является побочным продуктом производства.
2. Важнейшей стадией, определяющей пигментные свойства диоксида титана, является термический гидролиз титанилсульфата, протекающий по реакции:
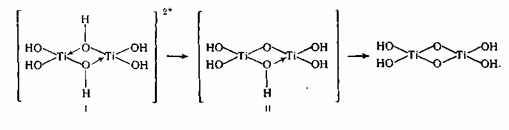
Это уравнение не раскрывает сложного хода реакции гидролиза и полного состава получаемых веществ. Титанил-ионы в водном растворе образуют гидроксокомплексы I, II, в которых атомы титана связаны через оловые мостики. При термическом гидролизе происходит переход оловых мостиков в оксо-связи:
Такой продукт гидролиза по брутто-составу примерно соответствует TiO(OH)2 и его называют метатитановой кислотой
(MTK). Фактически часть основных групп в полиионе замещены на сульфогруппы, которые частично сохраняются в виде концевых групп и в продукте гидролиза, имеющем полимерное строение и называемом гидратированным диоксидом титана (ГДТ): TiO2*0,71H2O*0,07SO3.
Для ускорения гидролиза и повышения выхода, а главное, для получения частиц ГДТ определенного размера в предгидролизный раствор вводят специально подготовленные зародыши. Для получения зародышей отбирают 0,3—0,5 % (масс.), в расчете на TiO2, предгидролизного кислого раствора в отдельный реактор, где при непрерывном перемешивании его нейтрализуют раствором NaOH до рН = 3. При этом выпадает коллоидный осадок гидрозоля гидроксида титана, после 1—2-часовой выдержки при 60—80 0C переходящий в микрокристаллические зародыши переменного состава. Условия приготовления зародышей определяющее влияют на процесс гидролиза и качество пигмента.
Источник