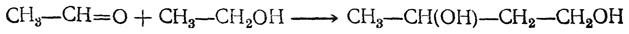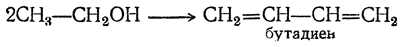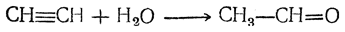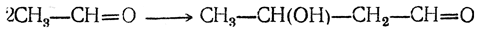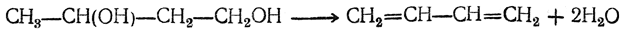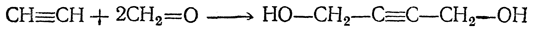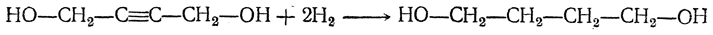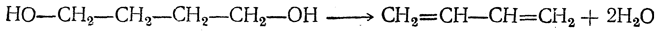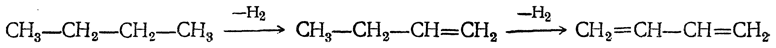Получение алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Получение алкадиенов
1. Дегидрирование алканов
Отщепление водорода от бутана — это промышленный способ получения дивинила. Реакция протекает при нагревании в присутствии оксида хрома (III):

Изопрен получают каталитическим дегидрированием изопентана (2-метилбутана):
2. Синтез Лебедева
Н агревание этанола в присутствии катализатора (смесь оксидов Al2O3, MgO, ZnO) – это промышленный способ получения дивинила из этанола (синтез Лебедева).
При этом образуются бутадиен-1,3, вода и водород:
3. Дегидратация двухатомных спиртов
Под действием серной кислоты вода отщепляется от бутандиола-1,3. При этом образуется дивинил и вода:
4. Дегидрогалогенирование дигалогеналканов
Под действием спиртовых растворов щелочей протекает отщепление атомов галогена и водорода и образуются вода, соль и алкадиен.
При этом атомы галогенов в дигалогеналкане должны располагаться не у одного и не у соседних атомов углерода.
1,3-Дихлорбутан реагирует со спиртовым раствором гидроксида калия с образованием бутадиена-1,3:
Источник
Бутадиен-1,3, или дивинил
Бутадиен-1,3, или дивинил, СН2=СН—СН=СН2 представляет собой газ, конденсирующийся при —4,5° С. Вследствие громадного технического значения бутадиена-1,3 как одного из важнейших исходных мономеров для производства синтетических каучуков было разработано много способов его получения, в том числе и промышленных.
Бутадиен образуется при термическом разложении различных органических веществ; в небольших количествах содержится в газах, получаемых пиролизом нефтепродуктов и каменного угля. Он может быть получен пиролизом циклогексана и других углеводородов нефти, пиролизом циклогексанола, дегидратацией 1,3-бутиленгликоля, а также конденсацией альдегида и спирта в присутствии глинозема как катализатора (И. И. Остромысленский). В последнем случае, вероятно, промежуточно образуется 1,3-бутиленгликоль
который сразу же дегидратируется. Другой способ получения бутадиена из спирта состоит в окислении этанола в ацегальдегид, который конденсируют в альдоль; восстановление альдоля дает 1,3-бутиленгликоль.
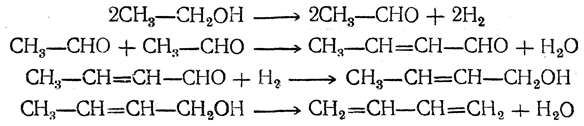
Первым технически целесообразным путем получения бутадиена из спирта является способ С. В. Лебедева, впервые осуществленный в промышленных масштабах в СССР в 1932 г. и в дальнейшем получивший широкое распространение. По С. В. Лебедеву спирт непосредственно превращается в бутадиен при пропускании его паров при 400—500° С над катализатором, обладающим одновременно дегидрирующим и дегидратирующим действием. Суммарно процесс выражается уравнением
Вероятно, механизм этой реакции (М. Я. Каган, Ю. Д. Горин) таков:
Можно получать дивинил, в том числе и в промышленном масштабе, на основе ацетилена. Более старый метод синтеза из ацетилена может быть представлен следующей схемой:
Позднее был предложен следующий путь: 1. Получение 1,4-бутиндиола конденсацией ацетилена и формальдегида (с Сu2Сl2 в качестве катализатора):
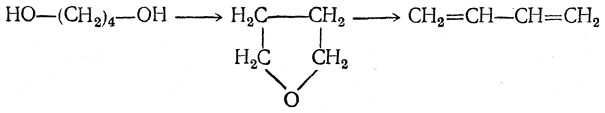
2. Гидрирование 1,4-бутиндиола в 1,4-бутандиол:
3. Дегидратация 1,4-бутандиола в дивинил либо непосредственно
либо с промежуточным выделением тетрагидрофурана
В настоящее время самым эффективным методом получения дивинила является каталитическое дегидрирование природного бутана, а также бутиленов, содержащихся в газах термической переработки нефти. Реакция проводится над различными алюмо-хромовыми катализаторами при 500—650° С. В зависимости от применяемых катализаторов бутан может быть превращен в бутадиен либо сразу, либо в две стадии
причем для каждой стадии требуются свои катализаторы и условия реакции. Эти методы, разрабатывавшиеся одновременно в СССР и в США, в настоящее время осуществляются как промышленные.
Хлорпроизводное дивинила — 2-хлорбутадиен-1,3, или хлоропрен, СН2—СН—ССl=СН2 может быть получен присоединением молекулы хлористого водорода к винилацетилену, получаемому при пропускании ацетилена через солянокислые растворы медных солей. Хлоропрен — жидкость с характерным эфирным запахом, несколько напоминающим запах бромистого этила; т. кип. 59,4°С, относительная плотность 0,9533 (при 20°С). Подобно дивинилу, но значительно легче, хлоропрен полимеризуется в каучукоподобные вещества — синтетические каучуки, выпускаемые в СССР под названием наирит, а в США — под названием неопрен.
Полихлоропреновые каучуки обладают рядом ценных физико-химических свойств — стойкостью к атмосферным воздействиям, к солнечному свету, к различным маслам и химическим агентам, а также негорючестью, благодаря чему они нашли очень широкое применение.
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |