8.10. Биохимический материал, его виды, методы получения.
Наиболее распространенным материалом для клинико-лабораторных исследований являются кровь и моча. В качестве биологического материала используют также другие жидкости организма: спинномозговую, слезную, лимфу. В качестве биологического материала используют биоптаты тканей и кал.
Получение биологического материала.
Кровь рекомендуется брать утром после 8-12 часового голодания. Если требуется получить плазму — в пробирку заранее вносят антикоагулянт для предохранения крови от свертывания. В зависимости от цели и задач применяют следующие антикоагулянты: аксалат натрия, ЭДТА, гепарин, тринатрий цитрат и др. Для получения сыворотки — антикоагулянт не добавляют, а пробирки с кровью закрывают ватной пробкой и помещают в термостат на 10-15 минут (t= 37°C). Сгусток фибрина отделяют от стенок пробирки стеклянной палочкой или стальной спицей, сыворотку переливают в центрифужную пробирку и центрифугируют 10 минут при 1500 об/мин. Считается, что объем выделяемой сыворотки составляет примерно 1/3 взятого объема крови.
В процессе выполнения экспериментов на животных (примеры кафедральных научных работ) с целью изучения метаболизма в тканях получают экстракты тканей и клеточные органеллы.
После декапитации крыс и взятия крови, изучаемые ткани немедленно помещают в жидкий азот для прекращения работы ферментных систем. Делают навеску ткани, которую растирают в кислотах (ТХУ или НClО4) – происходит кислотная денатурация ферментов. После центрифугирования полученный экстракт нейтрализуется КНСО3 или NaOH. Приготовленный таким образом образец может быть использован например для определения концентрации метаболитов ЦТК, ПФП, гликолиза. Часть образца, используемая для аналитического определения содержащихся в нем компонентов, обозначается как проба.
Применяя микроизмельчители тканей, получают тканевую «кашицу», которую затем гомогенезируют в гомогенезаторе Поттера. Приготовленные подобным образом гомогенаты подвергаются дифференциальному центрифугированию в градиенте сахарозы для выделения субклеточных структур.
Для этой цели используют рефрижераторные высокоскоростные центрифуги.
8.11. Метод дифференциального центрифугирования: причины, виды центрифуг, правила работ, получение фракций крови.
Субфракционирование гомогената путём дифференциального центрифугирования – это один из наиболее важных методов биохимии. В классическом случае используются три стадии центрифугирования при возрастающих скоростях. В ходе каждой из них образуются осадок и надосадочная жидкость (супернатант). Супернатант, полученный на каждой из стадий, подвергается центрифугированию на следующей стадии. В результате этой процедуры образуются три типа осадков, которые называются ядерной, митохондриальной и микросомной фракциями. Ни одна из этих фракций не представляет собой абсолютно чистые органеллы. Однако с помощью электронного микроскопа, а также путём идентификации соответствующих «маркерных» ферментов и химических компонентов (например, ДНК или РНК) было установлено, что главными компонентами этих трёх фракций являются ядра, митохондрии и микросомы соответственно. «Маркерный» фермент или химическое соединение – это тот компонент, который присутствует практически только в составе данного типа органелл; например, кислая фосфатаза находится в лизосомах, а ДНК – в ядре. Таким образом, маркер служит индикатором присутствия или отсутствия фракции тех органелл, в составе которых он находится. Микросомная фракция (микросомы) представляют собой в основном смесь фрагментов гладкого эндоплазматического ретикулума, шероховатого эндоплазматического ретикулума (т. е. эндоплазматического ретикулума с присоединёнными к нему рибосомами) и свободных рибосом. Содержимое супернатанта, полученного на конечной стадии, приблизительно соответствует составу клеточного сока (цитозоля). Модификации этого основного подхода, основанные на использовании различных сред для гомогенизации, разных условий или методов центрифугирования (например, использование непрерывного или ступенчатого градиента сахарозы), позволили выделить в более или менее чистом виде все органеллы. Описанная выше схема применима к большинству органов и клеток, однако в каждом случае для стандартизации процедуры субклеточного фракционирования необходимо провести серию анализов на содержание маркерных ферментов или других химических компонентов, а также выполнить электронно-микроскопические наблюдения.

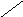


x 10 мин x 5 мин x 60 мин
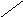

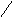
Схема разделения субклеточных фракций с помощью дифференциального центрифугирования. Гомогенизированную ткань (например, печень) сначала центрифугируют при малой скорости, что приводит к осаждению ядерной фракции (содержащей ядро и неразрушенные клетки) и отделению супернатанта (1). Супернатант осторожно сливают (декантируют) и проводят центрифугирование при более высокой скорости, в результате чего разделяются митохондриальная фракция (содержащая митохондрии, лизосомы и пероксисомы) и супернатант (2). Последний декантируют и центрифугируют при более высокой скорости, в результате чего формируется микросомная фракция (содержащая смесь свободных рибосом и фрагментов гладкого и шероховатого ЭПР) и отделяется чистый прозрачный раствор – конечный супернатант (3). Последний представляет собой цитозоль, или клеточный сок. Используя различные модификации представленного здесь подхода, обычно выделяют каждую из клеточных органелл в относительно чистом виде.
Источник
Биологический материал для биохимических исследований
Красноярский медико-фармацевтический колледж
Перфильева Г. В. , Черемнова С. И.
Методическое пособие
К практическим занятиям
По биохимии
для студентов специальности 0407 «Лабораторная диагностика».
Красноярск 2005
Красноярский медико-фармацевтический колледж
Перфильева Г. В., Черемнова С. И.
Методическое пособие
К практическим занятиям
По биохимии
для студентов специальности 0407 «Лабораторная диагностика».
Красноярск 2005
Перфильева Г. В., Черемнова С.И.
«Методическое пособие к практическим занятиям по биохимии» —
Красноярск: Издательство КМФК, 2005 г. — с.
Аннотация:
Методическое пособие к практическим занятиям по биохимии составлено в соответствии с требованиями ГОС СПО, квалификационной характеристикой специалиста и рабочей программой для студентов специальности 0407 «Лабораторная диагностика». Каждая глава содержит вопросы для самоподготовки по теме, описание практических работ, перечень основных терминов. Для каждой практической работы дан перечень оборудования, реактивов, описаны принцип, методика, расчеты и способы оформления, предложены вопросы для защиты работы.
Методическое пособие к практическим занятиям по биохимии предназначено для студентов медицинского колледжа по специальности 0407 «Лабораторная диагностика». Оно составлено таким образом, что может быть использовано студентами для работы на практических занятиях и для самостоятельной внеаудиторной подготовки.
Заведующая отделением «Лабораторная диагностика»
Предисловие.
Методическое пособие к практическим занятиям по биохимии составлено в соответствии с требованиями ГОС СПО, квалификационной характеристикой специалиста и рабочей программой для студентов специальности 0407 «Лабораторная диагностика».
Целью настоящего пособия является освещение основных практических работ по курсу «Основы биохимии с методами клинических исследований», что должно облегчить изучение данного предмета для студентов и помочь в работе преподавателей.
Пособие состоит из 9 разделов. Каждый раздел начинается с освещения вопроса значения изучаемой темы в курсе подготовки лабораторного техника. В первом разделе освещены вопросы: ТБ при работе в лаборатории, подготовки и хранения биологического материала, принципы, тактика и методы биохимических исследований, этапы лабораторных исследований, единицы измерения в лабораторной диагностике. В разделе 2 рассмотрены практические работы, отражающие химию биоорганических соединений. В разделах 3 — 9 описаны методы исследования, преаналитический этап исследований, даны методики для определения основных компонентов крови, отражающих те или иные обменные процессы в организме. Для каждой практической работы дан перечень оборудования, реактивов, описаны принцип, методика, расчеты и способы оформления, предложены вопросы для защиты работы. Вопросы, предложенные после каждой практической работы дифференцированны, звездочкой * отмечены вопросы повышенной сложности.
Практикум по дисциплине «Основы биохимии с методами клинических исследований» позволяет более рационально организовать работу студентов и преподавателей на занятии и дома, повышает качество труда и в конечном итоге влияет на качество подготовки специалистов.
Раздел 1. Введение в биохимию.
Значение изучаемой темы:
На современном этапе развития медицины резко повысилось значение биохимических анализов. Применение новых лекарственных средств и новых методов лечения требует постоянного биохимического контроля. Биохимические анализы применяются для диагностики, контроля за состоянием пациентов (мониторинг), скрининга различных заболеваний и прогнозирования. Таким образом, главная задача биохимической лаборатории состоит в том, чтобы обеспечить врача биохимической информацией, необходимой для лечения больного. Такая информация представляет ценность только если она точна, соответствует клинической ситуации и правильно используется врачем в процессе принятия решений.
Биологический материал для биохимических исследований.
Материалом для биохимических исследований в КДЛ могут быть:
· Биологические жидкости внутренних сред организма — цельная кровь, сыворотка и плазма крови, спино-мозговая жидкость, лимфаи др.
· Биологические выделения (экстракты) – моча, желчь, слюна, желудочный и кишечный соки, кал, пот и др.
Для того, что бы получить данный биологический материал используют следующие методы забора:
1. Безинструментальный – так собирают мочу, кал, мокроту, слюну и т.д.
2. Пункционный – материал берут с помощью игл из вены, артерий, спинного мозга.
3. Прокол иглой – кровь из пальца.
4. Пункционная биопсия – пункция из внутренних органов.
5. Зондовый метод – берут желудочный сок, мочу и т.д.
6. Промывание легких, мочевого пузыря и т.д.
7.Мазки и соскобы из носовой полости, зева, слизистой матки.
8. Отпечатки с ран, свищей, эрозий.
Биологический материал имеет разный срок и условия хранения, например, моча храниться 4-6 часов при комнатной температуре, а сыворотка несколько дней.
Весь биологический материал является условно потогенными (инфицированными), поэтому при работе с ним следует соблюдать правила ТБ при работе с инфицированным материалом.
В основном в биохимической лаборатории работают с цельной кровью, сывороткой и плазмой крови. Их получение и способы хранения отражены в таблице.
| Характеристика биоматериала. | Цельная кровь. | Плазма. | Сыворотка. |
| 1.Подготовка посуды. | Обрабатывают антикоагулянтом. | Должна быть сухая, чистая. | Должна быть сухая, чистая. |
| 2.Использование специальных веществ. | Антикоагулянты. | Физиологичес кий раствор, антикоагулянты. | Нет. |
| 3. Отстаивание. | Нет. | 30 минут. | 30-60 минут. |
| 4.Центрифугирование. | Не используют. | 5 минут при 2000 об/мин. | 15 минут при 2000 об/мин. |
| 5.Условия хранения. | Не хранят. | t 0-4°C –3-7 суток; t -20°С –1-3 месяца. | t 0-4°C – 3-7 суток; t -20°С –1-3 месяца. |
| 6. Исследование. | В течение суток. | В зависимости от исслед-го вещества и условий хранения — до 3 месяцев. | В зависимости от исследуемого вещества и условий хранения — до 3 месяцев. |
| 7.Отличительные особенности. | Можно исследовать все компоненты крови. | Отсутствуют форменные элементы крови. | Отсутствуют форменные элементы и факторы свертывания крови (фибриноген и др.). |
В качестве антикоагулянтовмогут быть использованы следующие вещества:
1. Этилендиаминтетраацетат (ЭДТА) – связывает и эффективно удаляет ионы кальция, защищает клетки крови от разрушения. Добавляют в кровь для выполнения гематологических исследований.
2. Гепарин (в виде натрий гепарина или калий гепарина) — ингибирует превращение протромбина в тромбин. Используют для получения плазмы крови для биохимических исследований.
3. Цитрат натрия– связывает и эффективно удаляет ионы кальция. Добавляют для получения плазмы необходимой для исследования процессов свертывания крови.
4. Оксалат натрия или оксалат аммония – связывает и эффективно удаляет ионы кальция. Добавляют (вместе с фторидом натрия) для получения крови и исследования в ней уровня глюкозы.
5. Фторид натрия – ферментный яд, который прекращает метаболизацию глюкозы в крови после её сбора, т.е. сохраняет её концентрацию.
Источник