Бертолетова соль
Что такое хлорат калия?
Калиевую соль хлорноватой кислоты (одна из четырех кислородсодержащих кислот, образованных хлором: хлорноватистая — HClO, хлористая — HClO2, хлорноватая — HClO3 и хлорная — HClO4) принято называть хлорат калия, его формула — KClO3. Эта соль по внешнему виду представляет собой кристаллы (бесцветные), которые слабо растворяются в воде (при 20 ºС в 100 см3 воды растворяется всего 7,3 г соли), но с повышением температуры растворимость растет. Другое ее известное название — бертолетова соль. Молекулярная масса вещества составляет 122,55 атомных единиц массы, плотность — 2,32 г/см3. Соль плавится при 356 ºС, разлагается примерно при 400 ºС.
Открытие бертолетовой соли
Впервые (в 1786 году) хлорат калия получил французский химик Клод Бертолле. Он пропускал хлор через концентрированный горячий раствор гидроокиси калия. Уравнение реакции, по которому была получена соль, выглядит следующим образом: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O. В результате этой реакции хлорат калия выпадает в виде белого осадка. Так как он слабо растворяется в холодной воде, то легко отделяется от остальных солей при охлаждении раствора. С момента своего открытия бертолетова соль являлся наиболее распространенным и полезным продуктом из всех хлоратов. В настоящее время KClO3 выпускается в промышленных масштабах.
Химические свойства
Бертолетова соль — сильный окислитель. При взаимодействии ее с концентрированной соляной кислотой (HCl) выделяется свободный хлор. Этот процесс описывается уравнением химической реакции: 6HCl + KClO3 → 3Cl↑ + KCl + 3 H2O. Как и все хлораты, это вещество сильно ядовито. В расплавленном виде KClO3 энергично поддерживает горение. В смеси с легко окисляющимися веществами (восстановителями), такими как сера, фосфор, сахар и другие органические вещества хлорат калия взрывается от удара или трения. Чувствительность к этим воздействиям усиливается в присутствии солей аммония и броматов. При осторожном (нагревание до 60 ºС) окислении калия хлората с кислотой щавелевой получают двуокись хлора, процесс протекает по уравнению реакции: 2KClO3 + H2C2O4 → K2CO3 + CO2 + H2O + 2ClO2. Окись хлора находит применение при отбеливании и стерилизации различных материалов (бумажной массы, муки и прочее), а также может быть использована для обесфеноливания сточных вод химических заводов.
Применение калия хлората
Из всех хлоратов бертолетова соль находит самое широкое применение. Она используется в производстве красителей, спичек (делают горючее вещество спичечной головки, сырьем является увлажненный хлорат калия по ТУ 6-18-24-84), фейерверков, дезинфицирующих средств, диоксида хлора. Из-за высокой опасности составов с хлоратом калия они практически не применяются в производстве взрывчатых веществ для промышленных и военных целей. Очень редко хлорат калия применяется в качестве инициирующего взрывчатого вещества. Иногда используется в пиротехнике, в результате получают цветнопламенные составы. Раньше соль применяли в медицине: слабые растворы этого вещества (KClO3) некоторое время применялись как антисептик для наружного полоскания горла. Соль в начале 20 века использовали для получения кислорода в лабораторных условиях, но из-за опасности экспериментов они были прекращены.
Получение калия хлората
Одним из следующих способов: хлорированием гидроокиси калия, в результате обменной реакции хлоратов с другими солями, электрохимическим окислением в водных растворах хлоридов металлов — может быть получена бертолетова соль. Получение ее в промышленных масштабах чаще осуществляют по реакции диспропорционирования гипохлоритов (солей хлорноватистой кислоты). Технологически процесс оформляют по-разному. Чаще в его основе лежит реакция между хлоратом кальция и хлоридом калия: Ca(ClO3)2 + 2KCl → 2KClO3 + CaCl2. Затем образовавшаяся бертолетова соль из маточного раствора выделяется методом кристаллизации. Также хлорат калия получают по модифицированному методу Бертолле при электролизе хлорида калия: образующийся при электролизе хлор взаимодействует с калия гидроксидом, образовавшийся гипохлорит калия KClO диспропорционирует затем на калия хлорат KClO3 и исходный калия хлорид KCl.
Разложение хлората калия
При температуре примерно 400 ºС происходит разложение бертолетовой соли. В результате выделяется кислород и перхлорат калия: 4KClO3 → KCl + 3KClO4. Следующая стадия разложения протекает при температуре от 550 до 620 ºС: KClO4 → 2O2↑ + KCl. На катализаторах (ими могут быть оксид меди CuO, оксид железа (III) Fe2O3 или оксид марганца (IV) MnO2) разложение протекает при более низкой температуре (от 150 до 300 ºС) и в одну стадию: 2KClO3 → 2KCl + 3O2.
Меры безопасности
Бертолетова соль является неустойчивым взрывоопасным химическим веществом, которое может взорваться при перемешивании, хранении (например, рядом с восстановителями на одной полке в лаборатории или в одном складском помещении), измельчении или других операциях. В результате взрыва может наступить увечье или даже последовать летальный исход. Поэтому при получении, использовании, хранении или транспортировке хлората калия должны соблюдаться требования ФЗ 116. Объекты, на которых организованы эти процессы, относятся к опасным производственным объектам.
Источник
Бертолетова соль: химические свойства, получение и применение
Изучая по химии кислород, вы дошли до раздела «Получение кислорода в лаборатории путем разложения неорганических веществ». «Разложение воды, марганцовки, перекиси водорода, оксидов тяжелых и нитратов активных металлов. так, вроде бы все понятно. Получение кислорода из бертолетовой соли? Это еще что за зверь?!» — стандартный ход мыслей каждого учащегося, просматривающего этот параграф в учебнике. В школе бертолетову соль не учат, так что приходится наводить справки о ней самостоятельно. Сегодня в этой статье я попытаюсь как можно подробнее ответить на вопрос о том, что такое бертолетова соль.
Происхождение названия
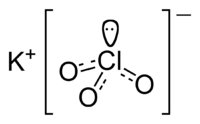
Сначала поговорим о ее названии. Соль — это отдельный класс неорганических веществ, в химической формуле которых такая схема расположения элементов: Ме-n- кисл.ост., где Ме — металл, кисл.ост — кислотный остаток, n — число атомов (может не присутствовать, если валентность металла и кислотного остатка одинакова). Кислотный остаток берут из какой-либо неорганической кислоты. Химическая формула этой соли — KClO3. Металл, который в ней присутствует, — калий, значит, она является калиевой. Источник остатка ClO3 — хлорноватая кислота HClO3. Итого, бертолетова соль является калиевой солью хлорноватой кислоты. Также ее еще называют хлоратом калия, а прилагательное «бертолетова» к ней приписывают из-за имени ее первооткрывателя.
История открытия
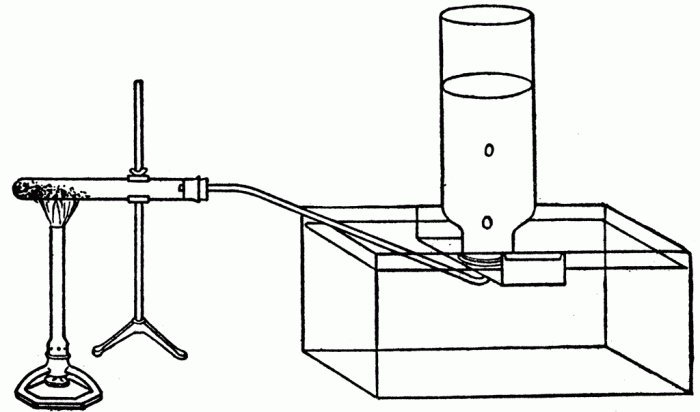
Впервые была получена в 1786 году французским химиком Клодом Бертолле. Он пропустил хлор сквозь горячий концентрированный раствор гидроксида калия (фото).
Бертолетова соль: получение
Получение хлоратов промышленным способом (в том числе и бертолетовой соли) основывается на реакции диспропорционирования гипохлоритов, которые получаются при взаимодействии хлора с растворами щелочей. Оформление процесса может быть разным: из-за того что самый многотоннажный продукт — гипохлорит кальция, из которого состоит хлорная известь, наиболее распространенным процессом является осуществление реакции обмена между хлоратом кальция (он получается при нагревании гипохлорита кальция) и хлоридом калия (он кристаллизуется из маточного раствора). Еще хлорат калия можно получить благодаря модифицированному методу Бертолле бездиафрагменным электролизом хлорида калия. Образующиеся хлор и гидроксид калия тут же взаимодействуют. Продутом их реакции является гипохлорит калия, который далее диспропорционирует на исходный хлорид калия и хлорат калия.
Химические свойства
Если температура нагревания достигает 400 о С, происходит разложение бертолетовой соли, при котором выделяется кислород и промежуточно образуется перхлорат калия. С катализаторами (оксид марганца (4), оксид железа (3), оксид меди и т.п.) температура, при которой происходит этот процесс, становится гораздо меньшей. Бертолетова соль и сульфат аммония могут реагировать в водно-спиртовом растворе и образовывать при этом хлорат аммония.
Применение
Смеси восстановителей (фосфора, серы, органических соединений) и хлората калия являются взрывчатыми и чувствительными к ударам и трению (фото выше). Чувствительность увеличивается, если присутствуют броматы и соли аммония. Из-за высокой чувствительности составы, в которых присутствует бертолетова соль, почти не применяются в производстве военных и промышленных взрывчатых веществ. Иногда ее используют в пиротехнике в качестве источника хлора для составов с цветным пламенем.
Заключение
Теперь вы знаете про бертолетову соль всё. Она может быть как полезной, так и чрезвычайно опасной для человека. Если вы имеете дома спички, то каждый день наблюдаете одну из отраслей применения бертолетовой соли в быту.
Источник
Бертолетова соль
Бертолетова соль
| Хлорат калия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорат калия |
| Химическая формула | KClO3 |
| Отн. молек. масса | 122.55 а. е. м. |
| Молярная масса | 122.55 г/моль |
| Физические свойства | |
| Плотность вещества | 2,344 г/см³ |
| Состояние (ст. усл.) | Бесцветные кристаллы |
| Термические свойства | |
| Температура плавления | 356 °C |
| Температура разложения | |
| Химические свойства | |
| Растворимость в воде | 7.3 (20°C) г/100 мл |
| Классификация | |
| номер CAS | [3811-04-9] |
400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до
2KClO3 = 2KCl + 3O2 (150—300 °C, кат. MnO2).




 ClO — + Cl — + H2O 3ClO —
ClO — + Cl — + H2O 3ClO — 


