Азот (N)
Соединения азота:
Однозначано назвать ученого, который первым открыл азот не представляется возможным по той простой причине, что это практически одновременно сделали в 1772 году сразу трое — Генри Кавендиш, Джозеф Пристли и Даниэль Резерфорд (еще к этому списку можно причислить и Карла Шееле). Однако, ни один из ученых в свое время так и не понял до конца своего открытия. Многие «пальму первенства» отдают шотландцу Даниэлю Резерфорду, поскольку он первым опубликовал магистерскую диссертацию, в которой описал основные свойства «испорченного воздуха».
Собственно название «азот» было предложено в 1787 году А. Лавуазье.
Азот является четвертым самым распространенным химическим элементом Солнечной системы (после водорода, гелия и кислорода). Азот является одним из самых распространенных элементов на Земле:
- в земной атмосфере азота содержится 3,87·10 18 кг — 75,6% (по массе) или 78,08% (по объему);
- в земной коре азота содержится (0,7—1,5)·10 18 кг;
- в земной мантии азота содержится 1,3·10 19 кг;
- в гидросфере азота содержится 2·10 16 кг (7·10 14 кг в виде соединений).
Азот играет важнейшую роль в жизнедеятельности организмов — он присутствует в белках, аминокислотах, аминах, нуклеиновых кислотах.
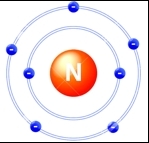
Природный азот состоит из двух стабильных изотопов 14 N — 99,635% и 15 N — 0,365%.
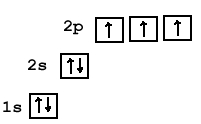
Атом азота содержит 7 электронов, которые располагаются на двух орбиталях (s и p) (см. Электронная структура атомов). На внутренней орбитали расположены 2 электрона; на внешней — 5 (одна свободная электронная пара + три неспаренных электрона, которые могут образовывать три ковалентные связи; см. Ковалентная связь).
Вступая в реакции с другими химическими элементами, атом азота может проявлять степень окисления от +5 до -3 (кроме трех валентных электронов еще одна связь может образовываться по донорно-акцепторному механизму за счет свободной электронной пары с атомом, имеющим свободную орбиталь).
Степени окисления азота:
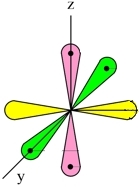
Три неспаренных р-электрона атома азота, лежащие на его внешнем энергетическом уровне, имеют форму равноплечей восьмерки, располагаясь перпендикулярно друг к другу:
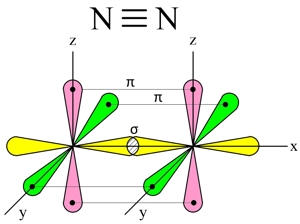
При образовании молекулы азота (N2) p-орбиталь, расположенная по оси X, одного атома, перекрывается с аналогичной px-орбиталью другого атома — в месте пересечения орбиталей образуется повышенная электронная плотность с формирование ковалентной связи (σ-связь).
Две другие орбитали одного атома, расположенные по осям Y и Z, перекрываются боковыми поверхностями со своими «собратьями» другого атома, образуя еще две ковалентные связи (π-связи).
В итоге, в молекуле азота (N2) образуются 3 ковалентные связи (две π-связи + одна σ-связь), т. е., возникает очень прочная тройная связь (см. Множественные связи).
Молекула азота очень прочная (энергия диссоциации 940 кДж/моль), обладает низкой реакционной способностью.
Свойства молекулярного азота
В нормальных условиях азот является малоактивным веществом, что объясняется достаточно прочными межатомарными связями в его молекуле, поскольку образованы они аж тремя парами электронов. По этой причине, обычно азот вступает в реакции при высоких температурах.
- газ без запаха и цвета;
- плохо растворим в воде;
- растворим в органических растворителях;
- может реагировать с металлами и неметаллами при нагревании в присутствии катализатора (под воздействием ионизирующего облучения);
- азот вступает в реакции как окислитель (исключение составляют кислород и фтор):
- при нормальных условиях азот реагирует только с литием:
6Li + N2 = 2Li3N; - при нагревании азот реагирует с металлами:
2Al + N2 = 2AlN; - при температуре 500°C и при высоком давлении в присутствии железа азот реагирует с водородом:
N2 + 3H2 ↔ 2NH3; - при температуре 1000°C азот реагирует с кислородом, бором, кремнием:
N2 + O2 ↔ 2NO.
- при нормальных условиях азот реагирует только с литием:
- азот взаимодействует, как восстановитель:
- с кислородом:
N2 0 +O2 0 ↔ 2N +2 O -2 (оксид азота II) - с фтором:
N2 0 +3F2 0 = 2N+3F3 -1 (фторид азота III)
- с кислородом:
Получение и применение азота
Получение азота:
- промышленным способом азот получают сжижением воздуха с последующим отделением азота путем испарения;
- лабораторные способы получения азота:
- разложением нитрита аммония:
NH4NO2 = N2 + 2H2O; - восстановлением азотной кислоты активными металлами:
36HNO3 + 10Fe = 10Fe(NO3)3 + 3N2 + 18H2O; - разложением азидов металлов (чистый азот):
2NaN3 → (t) 2Na + 3N2; - атмосферный азот получают реагированием воздуха с раскаленным коксом:
O2 + 4N2 + 2C → 2CO + 4N2; - пропусканием аммиака над оксидом меди (II) при t=700°C:
2NH3 + 3CuO → N2 + 3H2O + 3Cu.
- разложением нитрита аммония:
Применение азота:
- создание инертных сред в металлургии;
- синтез аммиака и азотной кислоты;
- производство взрывчатых веществ;
- для создания низких температур;
- производство минеральных удобрений: калийная селитра (KNO3); натриевая селитра (NaNO3); аммонийная селитра (NH4NO3); известковая селитра (Ca(NO3)2).
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Способы получения азота кратко
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 3 :
- N — 2s 2 2p 3
- P — 3s 2 3p 3
- As — 4s 2 4p 3
- Sb — 5s 2 5p 3
- Bi — 6s 2 6p 3
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Реакция с неметаллами
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.
Соли аммония
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
Реакции с щелочами
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
Реакции с солями
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры — 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2 — ). Реагирует с водой, основаниями.
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
Реакции с водой и щелочами
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник