1.3.1. Химические способы получения азота
В лабораторных условиях, азот можно получить многими химическими способами, например:
Реакцией монооксида азота с озоном:
NO + O3 → NO2 + N2 + световое излучение
Разложением, путем нагревания или детонацией азида натрия:
2NaN3 → 2Na + 3N2
Высокотемпературным разложением аммиачной селитры:
2NH4NO3 → 2N2 + O2 + 4H2O. Другие селитры тоже при нагревании разлагаются с выделением газообразного азота.
Медленным нагреванием массовой смеси 4:5 хлорида аммония и нитрита натрия, с добавлением небольшого количества воды:
NH4Cl + NaNO2 → NaCl + NH4NO2. Присутствие воды требуется для предотвращения возгонки хлорида аммония при нагревании. Полученный нитрит аммония затем разлагается на водяной пар и химически чистый газообразный азот:
NH4NO2 → 2H2O↑ + N2
Азот можно получить химическим путем из воздуха. Сначала воздух очищают от углекислого газа путем пропускания воздуха через раствор едкого натра:
2NaОН + CO2 → Na2CO3 + H2O. Затем воздух, очищенный от углекислого газа, пропускается через нагреваемые медные решетки, со связыванием кислорода в оксид меди:
2Cu + O2 → 2CuO2
Однако, все перечисленные, а также и многие не перечисленные, химические способы получения азота имеют малое практическое применение, кроме случаев, когда требуется абсолютно химически чистый азот, очищенный даже от благородных газов (причем для этого пригодны не все химические способы). Пожалуй, относительным исключением является процесс разложения азида натрия, который раньше использовался в некоторых автомобильных подушках безопасности (выделявшийся свободный натрий поглощался другими наполнителями подушки); для справки заметим, что в современных подушках безопасности этот принцип уже не используется.
Источник
Способы получения азота химия
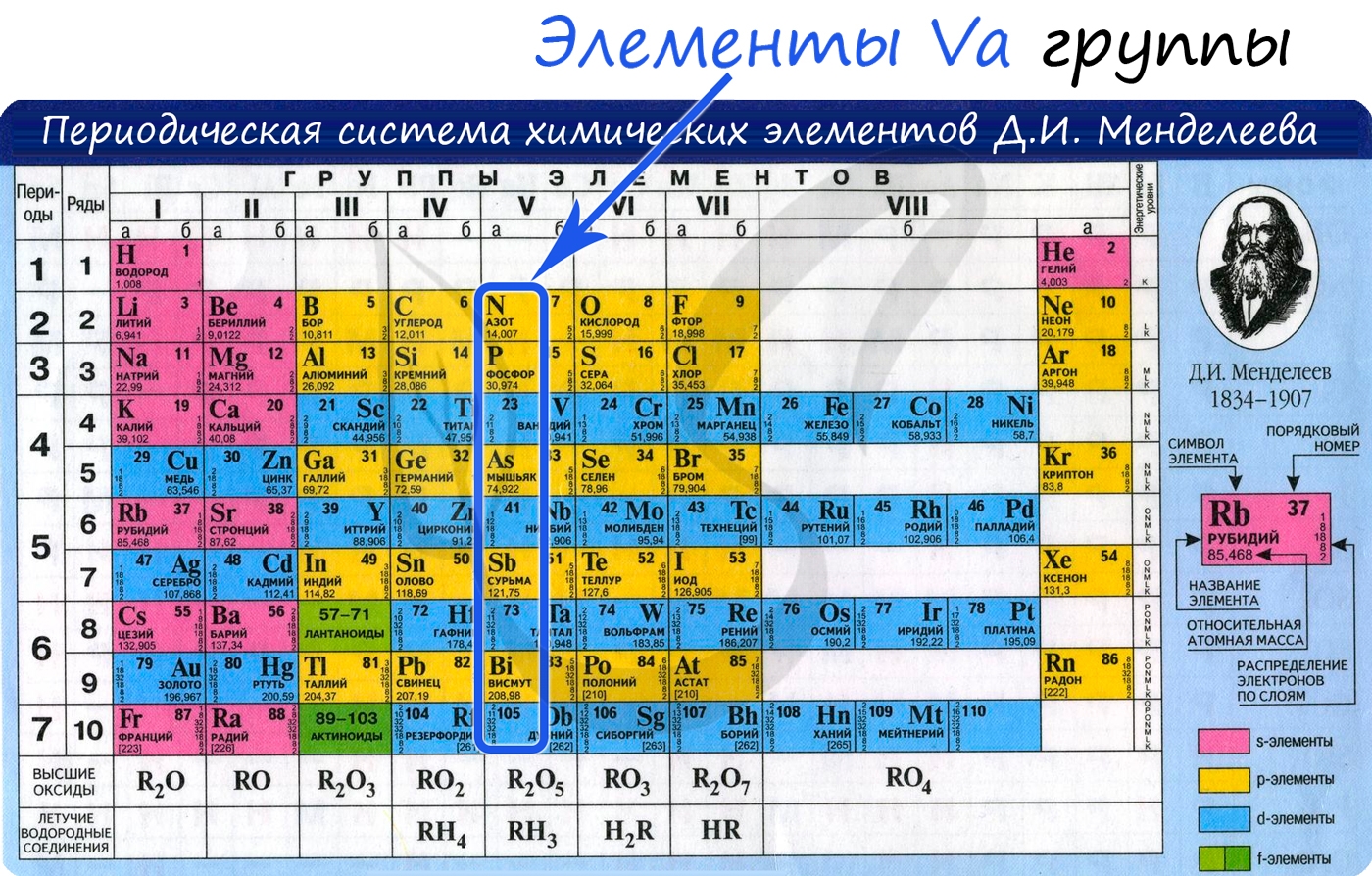
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
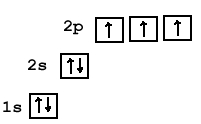
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 3 :
- N — 2s 2 2p 3
- P — 3s 2 3p 3
- As — 4s 2 4p 3
- Sb — 5s 2 5p 3
- Bi — 6s 2 6p 3
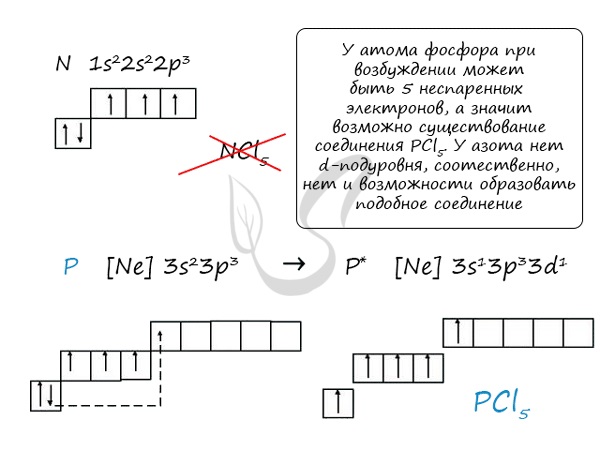
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Реакция с неметаллами
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
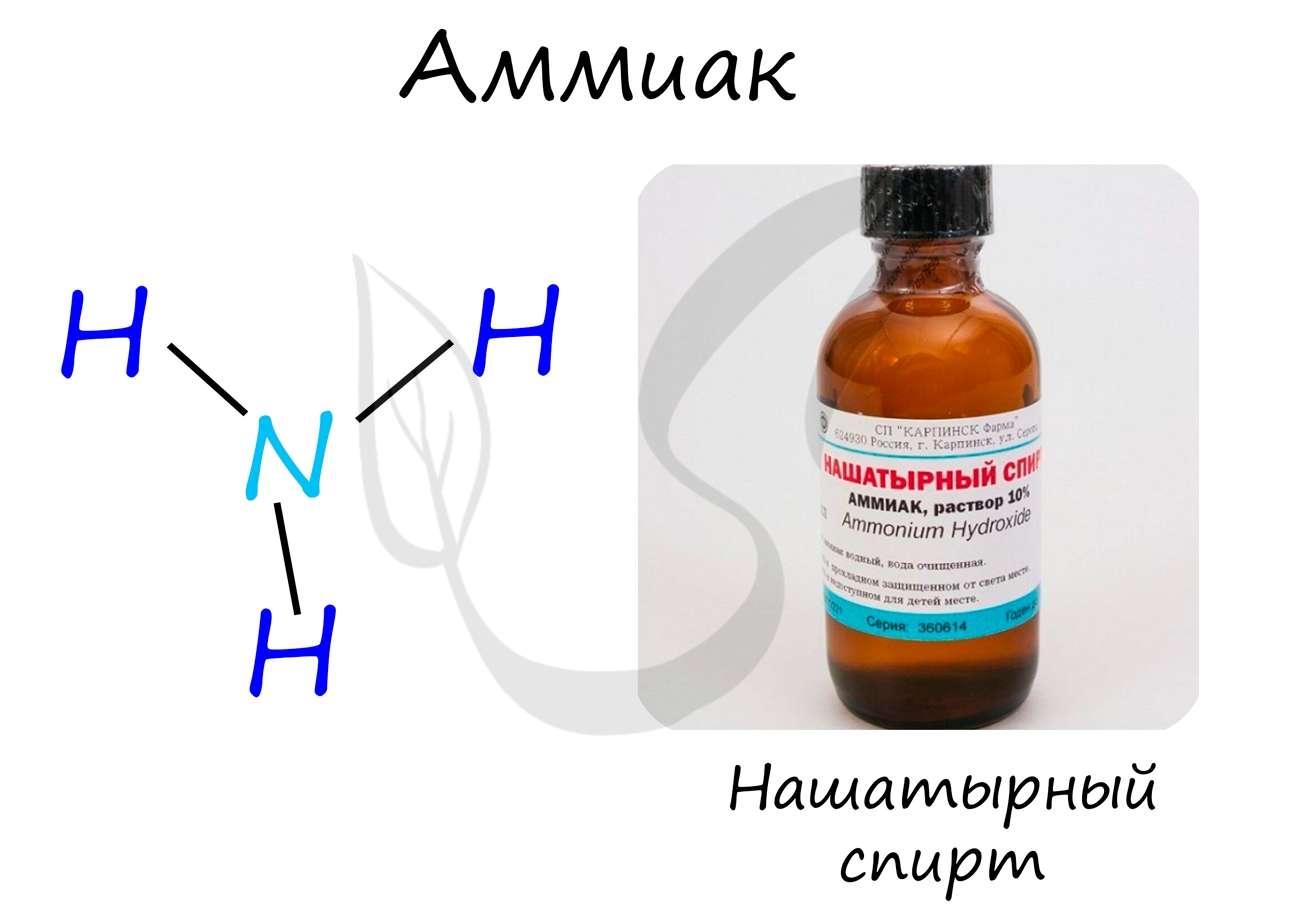
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.
Соли аммония
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
Реакции с щелочами
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
Реакции с солями
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры — 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2 — ). Реагирует с водой, основаниями.
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
Реакции с водой и щелочами
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Получение азота в промышленности
Все способы получения азота в промышленности основаны на разделении атмосферного воздуха, который является самым доступным сырьем и содержит около 75% целевого продукта. Другие методы отличаются высокими удельными затратами и используются преимущественно в исследовательских лабораториях. В промышленности азот получают как для собственных нужд, так и для продажи. С воздухоразделительных установок готовый газ поступает непосредственно к потребителям или закачивается в баллоны для хранения и транспортировки.
Производство азота в промышленности ведется по трем технологиям:
Генераторы
и модульные
азотные станции
Криогенное производство
Способ заключается в пофракционном испарении сжиженного воздуха и основан на разнице температур кипения его компонентов. Процесс протекает несколько этапов:
- Воздух сжимается в компрессорной установке с одновременным отбором тепла, выделяющегося при компримировании.
- Перед тем как получить азот, из сжиженного воздуха удаляют воду и углекислоту, которые становятся твердыми и выпадают в осадок.
- После снижения давления смесь начинает кипеть, а ее температура падает до -196 °C. Происходит последовательное испарение азота, кислорода и благородных газов.
Криогенное получение азота в промышленности оправдано при значительном расходе, а также при высоких требованиях к его составу. Чистота конечного продукта достигает 99,9999%. Энергоемкое и габаритное оборудование отличается высокой сложностью, требует профессиональной подготовки обслуживающего и технологического персонала.
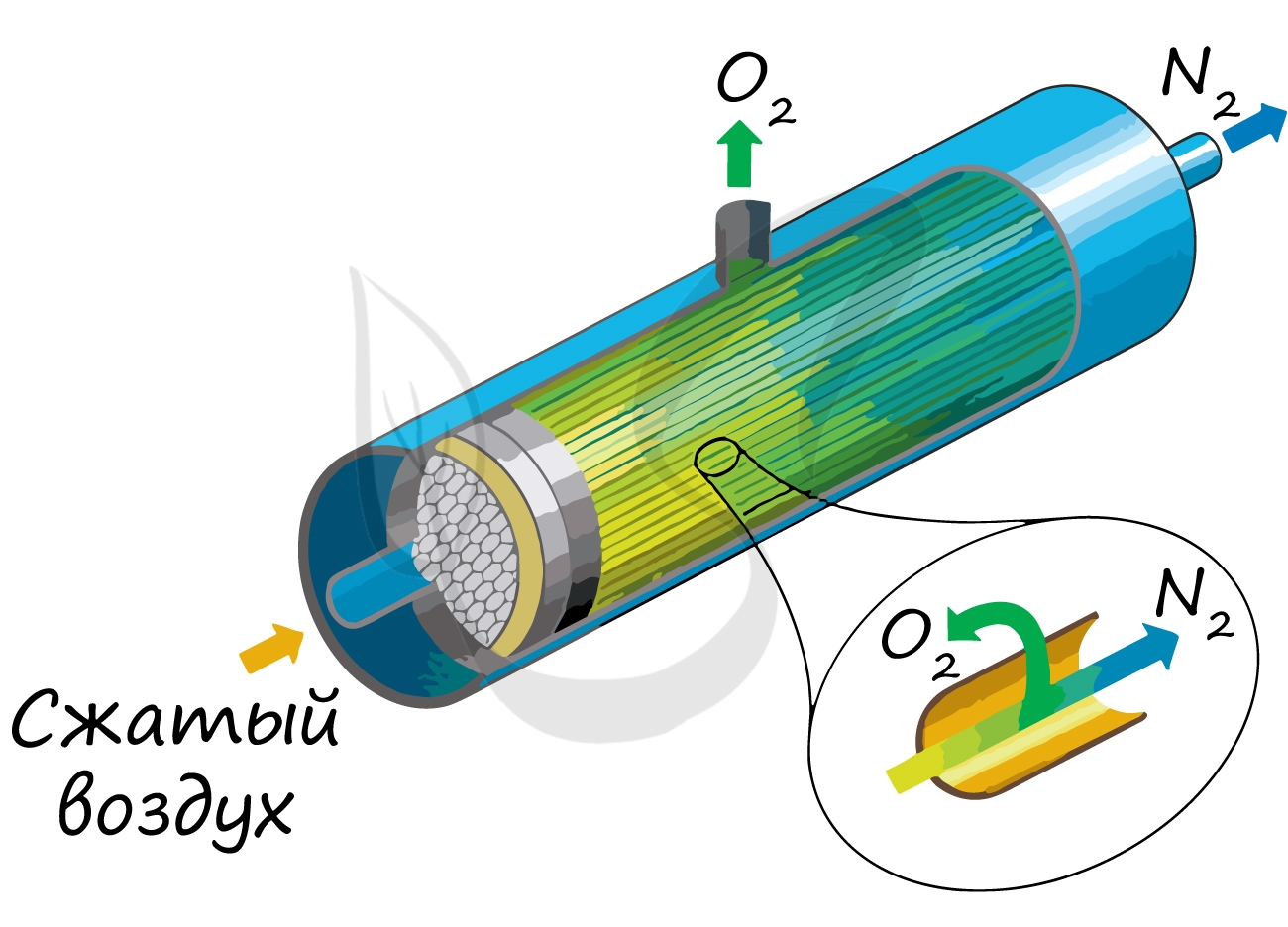
Мембранное отделение азота
Чтобы понять, как добывают азот в промышленности методом мембранного разделения, нужно разобраться в структуре используемых для этого модулей. Они представляют собой цилиндры, в которых размещены ориентированные вдоль стенок волокна — макаронины. Сжатый воздух подается на торцы полимерных трубок, которые пропускают молекулы азота. Другие вещества удаляются через стенки волокон. Модули имеют низкую фильтрующую способность, поэтому вторичный продукт — это обогащенный кислородом воздух.
Недостатком такого способа считается чувствительность мембран к загрязнениям. Перед тем как получить азот, сжатый воздух очищают от конденсата и масла. Максимальная чистота целевого продукта составляет 95% и падает с повышением производительности установки.
Источник
Азот (N)
Соединения азота:
Однозначано назвать ученого, который первым открыл азот не представляется возможным по той простой причине, что это практически одновременно сделали в 1772 году сразу трое — Генри Кавендиш, Джозеф Пристли и Даниэль Резерфорд (еще к этому списку можно причислить и Карла Шееле). Однако, ни один из ученых в свое время так и не понял до конца своего открытия. Многие «пальму первенства» отдают шотландцу Даниэлю Резерфорду, поскольку он первым опубликовал магистерскую диссертацию, в которой описал основные свойства «испорченного воздуха».
Собственно название «азот» было предложено в 1787 году А. Лавуазье.
Азот является четвертым самым распространенным химическим элементом Солнечной системы (после водорода, гелия и кислорода). Азот является одним из самых распространенных элементов на Земле:
- в земной атмосфере азота содержится 3,87·10 18 кг — 75,6% (по массе) или 78,08% (по объему);
- в земной коре азота содержится (0,7—1,5)·10 18 кг;
- в земной мантии азота содержится 1,3·10 19 кг;
- в гидросфере азота содержится 2·10 16 кг (7·10 14 кг в виде соединений).
Азот играет важнейшую роль в жизнедеятельности организмов — он присутствует в белках, аминокислотах, аминах, нуклеиновых кислотах.
Природный азот состоит из двух стабильных изотопов 14 N — 99,635% и 15 N — 0,365%.
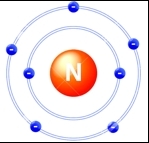
Атом азота содержит 7 электронов, которые располагаются на двух орбиталях (s и p) (см. Электронная структура атомов). На внутренней орбитали расположены 2 электрона; на внешней — 5 (одна свободная электронная пара + три неспаренных электрона, которые могут образовывать три ковалентные связи; см. Ковалентная связь).
Вступая в реакции с другими химическими элементами, атом азота может проявлять степень окисления от +5 до -3 (кроме трех валентных электронов еще одна связь может образовываться по донорно-акцепторному механизму за счет свободной электронной пары с атомом, имеющим свободную орбиталь).
Степени окисления азота:
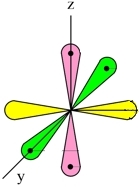
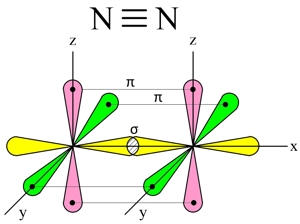
Три неспаренных р-электрона атома азота, лежащие на его внешнем энергетическом уровне, имеют форму равноплечей восьмерки, располагаясь перпендикулярно друг к другу:
При образовании молекулы азота (N2) p-орбиталь, расположенная по оси X, одного атома, перекрывается с аналогичной px-орбиталью другого атома — в месте пересечения орбиталей образуется повышенная электронная плотность с формирование ковалентной связи (σ-связь).
Две другие орбитали одного атома, расположенные по осям Y и Z, перекрываются боковыми поверхностями со своими «собратьями» другого атома, образуя еще две ковалентные связи (π-связи).
В итоге, в молекуле азота (N2) образуются 3 ковалентные связи (две π-связи + одна σ-связь), т. е., возникает очень прочная тройная связь (см. Множественные связи).
Молекула азота очень прочная (энергия диссоциации 940 кДж/моль), обладает низкой реакционной способностью.
Свойства молекулярного азота
В нормальных условиях азот является малоактивным веществом, что объясняется достаточно прочными межатомарными связями в его молекуле, поскольку образованы они аж тремя парами электронов. По этой причине, обычно азот вступает в реакции при высоких температурах.
- газ без запаха и цвета;
- плохо растворим в воде;
- растворим в органических растворителях;
- может реагировать с металлами и неметаллами при нагревании в присутствии катализатора (под воздействием ионизирующего облучения);
- азот вступает в реакции как окислитель (исключение составляют кислород и фтор):
- при нормальных условиях азот реагирует только с литием:
6Li + N2 = 2Li3N; - при нагревании азот реагирует с металлами:
2Al + N2 = 2AlN; - при температуре 500°C и при высоком давлении в присутствии железа азот реагирует с водородом:
N2 + 3H2 ↔ 2NH3; - при температуре 1000°C азот реагирует с кислородом, бором, кремнием:
N2 + O2 ↔ 2NO.
- при нормальных условиях азот реагирует только с литием:
- азот взаимодействует, как восстановитель:
- с кислородом:
N2 0 +O2 0 ↔ 2N +2 O -2 (оксид азота II) - с фтором:
N2 0 +3F2 0 = 2N+3F3 -1 (фторид азота III)
- с кислородом:
Получение и применение азота
Получение азота:
- промышленным способом азот получают сжижением воздуха с последующим отделением азота путем испарения;
- лабораторные способы получения азота:
- разложением нитрита аммония:
NH4NO2 = N2 + 2H2O; - восстановлением азотной кислоты активными металлами:
36HNO3 + 10Fe = 10Fe(NO3)3 + 3N2 + 18H2O; - разложением азидов металлов (чистый азот):
2NaN3 → (t) 2Na + 3N2; - атмосферный азот получают реагированием воздуха с раскаленным коксом:
O2 + 4N2 + 2C → 2CO + 4N2; - пропусканием аммиака над оксидом меди (II) при t=700°C:
2NH3 + 3CuO → N2 + 3H2O + 3Cu.
- разложением нитрита аммония:
Применение азота:
- создание инертных сред в металлургии;
- синтез аммиака и азотной кислоты;
- производство взрывчатых веществ;
- для создания низких температур;
- производство минеральных удобрений: калийная селитра (KNO3); натриевая селитра (NaNO3); аммонийная селитра (NH4NO3); известковая селитра (Ca(NO3)2).
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник