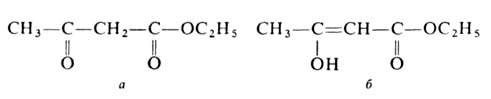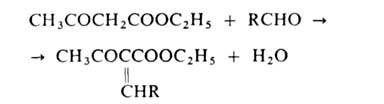АЦЕТОУКСУСНЫЙ ЭФИР
АЦЕТОУКСУСНЫЙ ЭФИР (этиловый эфир ацетоуксусной к-ты, этилацетоацетат), мол. м. 130,1418; бесцв. жидкость; т. пл. -45°С, т. кип. 180,8°С (с разл.), 100°С/80 мм рт. ст., 71°С/12,5мм рт.ст.; d4 20 1,0284, nD 20 1,4198; раств. в воде (14,3% при 16,5°С), этаноле, эфире. Существует в двух таутомерных формах — кетонной (а)и енольной (б):
Енольная форма стабилизируется за счет сопряжения двойной углерод-углеродной связи с карбонильной группой и образования внутримолекулярной водородной связи между гидроксилом и карбонилом. Кетонную форму можно выделить вымораживанием, енольную — фракционной перегонкой в кварцевой посуде в вакууме; для них т. пл. соотв. -39 и -44°С, d4 20 1,0368 и 1,0119, nD 20 1,4425 и 1,4480. Соотношение таутомеров зависит от природы р-рителя, материала сосуда, т-ры, напр. в ацетоуксусном эфире при комнатной т-ре содержится 7,5% енола, при 18°С в р-рах ацетоуксусног эфира в воде, этаноле, эфире и циклогексане — соотв. 0,4, 12, 27,1 и 46,4%. Чистые таутомерные формы сохраняются в кварцевой посуде при -80°С.
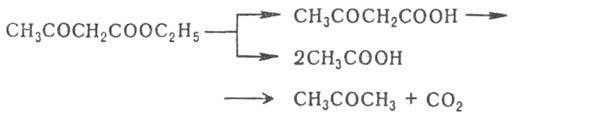
Под действием разб. р-ров к-т или щелочей ацетоуксусный эфир подвергается расщеплению с образованием ацетона (т. н. кетонное расщепление), под действием конц. р-ров щелочей — с образованием уксусной к-ты (кислотное расщепление):
Как кетон ацетоуксусный эфир восстанавливается Н2 in situ до этил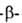
Как енол ацетоуксусный эфир мгновенно обесцвечивает р-р Вг2 (р-ция служит для количеств. определения енола), с Fed, образует комплекс красно-фиолетового цвета, с РС15—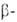
При действии на ацетоуксусный эфир металлич. Na или алкоголятов Na в спиртовом р-ре получается натрийацетоуксусный эфир CH3C(ONa)—СНСООС2Н5, широко используемый в р-циях с алкилгалогенидами, приводящих к образованию алкил- и диалкилацетоуксусных эфиров-соответственно CH3COCH(R)COOC2H5 и CH3COC(RR’)COOC2H5. Кетонное и кислотное расщепление последних происходит так же, как и ацетоуксусного эфира. Напр., при кетонном расщеплении метилацетоуксусного эфира получается метилэтилкетон, при кислотном — уксусная и пропионовая к-ты. В зависимости от характера реагента, природы р-рителя и условий из натрийацетоуксусного эфира могут получаться как С-, так и О-производные ацетоуксусного эфира.
Атомы Н метиленовой группы ацетоуксусного эфира очень подвижны, благодаря чему он реагирует, напр., с альдегидами:
вступает в р-цию Михаэля и др. В пром-сти и лаборатории ацетоуксусный эфир получают действием металлич. Na на этилацетат (см. Клайзена конденсация]. Образующийся натрийацетоуксусный эфир действием разб. минер. к-т переводят в ацетоуксусный эфир. Применяют ацетоуксусный эфир в синтезе лек. ср-в (напр., амидопирина, антипирина, акрихина), витамина В1, красителей, содержащих пиразолоновый цикл; как ароматизирующее в-во для пищ. продуктов. Ацетоуксусный эфир раздражает кожу. Т. всп. 85 о С.
===
Исп. литература для статьи «АЦЕТОУКСУСНЫЙ ЭФИР» : Ингольд К., Теоретические основы органической химии, пер. с англ., 2 изд., М., 1973, с. 657-736; Несмея но в А. Н., Несмеянов Н. А., Начала органической химии, кн. 1, М., 1974; Роберте Д. Д., Кассерио М. К., Основы органической химии, пер. с англ., т. 1, М., 1978. Ф.А. Чернышкова.
Страница «АЦЕТОУКСУСНЫЙ ЭФИР» подготовлена по материалам химической энциклопедии.
Источник
Способы получения ацетоуксусного эфира
Функциональные производные карбоновых кислот
Реакции натрийацетоуксусного эфира
Анион ацетоуксусного эфира проявляет свойства сильного нуклеофила и весьма легко взаимодействует с алкилирующими и ацилирующими реагентами.
Соли ацетоуксусного эфира относятся к так называемым амбидентным нуклеофилам: в зависимости от условий реакция ацилирования может протекать как по атому углерода, так и по карбонильному кислороду. Атом кислорода сложноэфирной группы практически никогда не затрагивается, т.к. на нем локализован меньший отрицательный заряд. Соотношение продуктов С- и О-ацилирования зависит от характера растворителя: в полярных протонных растворителях (спирт) реакция идет преимущественно по атому углерода, а полярных апротонных (ацетон, диметилформамид, диметилсульфоксид) увеличивается выход продуктов ацилирования по атому кислорода.
Кроме того, особенной склонностью к реакции по кислороду обладают тетраалкиламмониевые соли ацетоуксусного эфира, объемный катион которых . не способен координироваться с атомом кислорода и блокировать его нуклеофильные свойства. Синтез О-ациленолов ацетоуксусного эфира нередко проводят в пиридине, где ацилирующим реагентом является N-ацилпиридиниевая соль. Реакция протекает через промежуточное образование аддукта по α-положению гетероцикла.
Реакции расщепления β-кетоэфиров
Ацилирование и алкилирование ацетоуксусного эфира само по себе значительного синтетического значения не имеет. Однако полученные этими способами производные применяются для дальнейшего превращения в несимметрично замещенные кетоны, эфиры и кислоты сложного строения. В основе этих синтезов лежат реакции кислотного, сложноэфирного и кетонного расщепления замещенных кетоэфиров.
Сложноэфирное расщепление заключается в разрыве С-С связи при карбонильном атоме углерода под действием сильных оснований, например, этилата натрия. Эта реакция является процессом, обратным конденсации Кляйзена.
Расщепление начинается с нуклеофильной атаки нейтральной молекулы кетоэфира, поэтому реакция идет тем легче, чем ниже его СН-кислотность: легче всего расщепляются дизамещенные эфиры, которые вообще не могут образовать енолята.
Если реакцию проводить под действием водной щелочи при нагревании, то возникающие сложные эфиры омыляются до соответствующих карбоксилатов. Из последних подкислением выделяют замещенные карбоновые кислоты (кислотное расщепление).
Кетонное расщепление замещенных ацетоуксусных эфиров позволяет синтезировать кетоны и дикетоны сложного строения в зависимости от природы заместителя: из алкилированных производных получают кетоны, а из ацилированных – дикетоны. Реакция включает в себя стадию декарбоксилирования β-кетокислот, образующихся при гидролизе кетоэфиров и проводится путем нагревания замещенного ацетоуксусного эфира в разбавленных кислоте или щелочи.
Источник
Привет студент
Синтез ацетоуксусного эфира
Химико – биологический факультет
КУРСОВАЯ РАБОТА
по дисциплине «Органическая химия»
Синтез ацетоуксусного эфира
Аннотация
В данной работе осуществлен синтез ацетоуксусного эфира методом фракционной перегонки. Проведена очистка ацетоуксусного эфира методом экстракции, также проведена качественная реакция с хлоридом железа(III). Осуществлено определение выхода, что составляет 84,7 %. По итогам работы осуществлен анализ и подведены итоги.
Annotation
In this paper, the synthesis of ethyl acetoacetate by fractional distillation. Cleaning of acetoacetic ester extraction method, also conducted qualitative reaction with iron chloride (III). Implemented definition output that is 84,7%. The outcome of the analysis carried out and summarized.
Содержание
Список использованных источников……………………………………………. 16
Введение
Ацетоуксусный эфир (этиловый эфир ацетоуксусной кислоты,) — бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде, смешивается с этанолом и диэтиловым эфиром.
Ацетоуксусный эфир широко применяется в органическом синтезе:
алкилирование натрий ацетоуксусного эфира с последующим кетонным либо кислотным расщеплением моно- и дизамещенных ацетоуксусныых эфиров , используется как препаративный метод синтеза метилкетонов и замещенных уксусных кислот.
Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), а также красителей для цветной фотографии, ряда органических веществ.
Обладает кожнораздражающим действием, всасывается через кожу. ПДК составляет 1 мг/м³
Целью данной работы является синтез ацетоуксусного эфира.
Для выполнения поставленной цели необходимо решить следующие задачи:
- Провести информационный поиск по проблеме исследования
- Работа с методикой по синтезу
- Провести очистку и идентификацию ацетоуксусного эфира
- Осуществить определение выхода вещества
- Литературный обзор
- Основные свойства и методы получения
- Химические свойства ацетоуксусного эфира
- Основные свойства и методы получения
Ацетоуксусный эфир вступает в следующие реакции:
- Алкилирование ацетоуксусного эфира
Анионы сложных эфиров типа ацетоуксусного могут быть проалкилированы алкилгалогенидами. Сложный эфир превращается при действии сильного основания в енолят-анион, и последний далее алкилируется по SN2 реакции алкилгалогенидом. Обычно преобладает С — алкилирование.
Ацетоуксусный эфир может быть гидролизован в кислых условиях до соответствующих кислот, которые при нагревании легко декарбоксилируются. Из алкилацетоуксусных эфиров при этом образуются метилалкилкетоны:
- Ацилирование ацетоуксусного эфира
Анионы сложных эфиров взаимодействуют с ацилгалогенидами, образуя продукты ацилирования. Эти реакции осуществляются с наибольшим успехом, если использовать для получения соли енола, а гидрид натрия, так как в этом случае не происходит образования спирта, способного реагировать с ацилгалогенидом:
- Бромирование ацетоуксусного эфира
С бромом взаимодействует только его енольная форма. Это позволило разработать химический метод определения содержание енола в равновесной смеси[1], который до создания спектроскопических методов очень широко применяли для определения положения кето — енольного равновесия в различных дикарбонильных соединений. Суть метода заключается в том, что енольную форму возможно быстрее( чтобы равновесие не успело сдвинуться) оттитровывают бромом на холоду :
АУЭ широко используется в органическом синтезе. С его помощью можно синтезировать кетоны, модифицировать эфир с образованием различных производных. Целый ряд дополнительных возможностей для синтеза обеспечивают еноляты АУЭ, которые способны подвергаться алкилированию и ацилированию с образованием разнообразных замещенных ацетоуксусного эфира. В отличае от натриймалонового эфира эти реакции могут протекать как по атому гидроксильного кислорода, так и по соседнему углеродному атому. Механзм реакций SN2 в качестве нуклеофила выступает енолят – ион.
Направление замещения определяется несколькими факторами. Наиболее важным является природа реагента R – X. Чем более мягкой кислотой будет уходящая группа «Х», тем легче будет идти реакция по мягкому реакционному центру – атому углерода. Это и происходит при алкилировании енолята – аниона алкил – йодидами и – бромидами.
Возможности применения АУЭ в синтезах разнообразных продуктов расширяются благодаря его способности подвергаться расщеплению в двух направлениях. При нагревании с разбавленными растворами щелочей или кислот происходит распад образующейся после гидролиза ацетоуксусной кислоты с образованием кетонов. Обработка концентрированными растворами щелочей приводит к образованию из АУЭ двух молекул уксусной кислоты (кислотное расщепление):
Механизм кислотного расщепления состоит в нуклеофильной атаке гидроксил-ионом карбонильного углерода, несущего частичный положительный заряд. После присоединения гидроксида неустойчивый продукт распадается:
- Кето- енольная таутомерия АУЭ
Ацетоуксусная кислота и ее эфир(ацетоуксусный эфир) существует в виде двух таутомерных форм – кетонной и енольной. Таутомерные формы находятся в состоянии динамического равновесия, одна из таутомерных форм способна самопроизвольно переходить в другую. При комнатной теппературе равновесие устанавливается при содержании 92,5% кетонной(а) и 7,5 енольной(б) формы.
В различных растворителях содержание енольной формы различно: чем более полярен растворитель, тем больше содержание кетонной формы.
- Сложноэфирные конденсации
Сложные эфиры в присутствии металлического натрия способны енолизироваться; образующиеся енолы дают с натрием соответствующие еноляты, например:
Двойная связь в таких енолятах исключительно реакционно способна, обуславливая их склонность к разнообразным реакциям присоединения; в частности, легко происходит присоединение другой молекулы сложного эфира:
Из полученного продукта присоединения путем отщепления алкоголята натрия образуется ацетоуксусный эфир:
Эта реакция имеет большое значение и позволяет получать конденсацией двух молекул сложного эфира соответствующие эфиры b-кетокислот. Аналогичным образом при конденсации эфиров дикарбоновых кислот получаются циклические кетонокислоты, а при конденсации эфиров с енолятами кетонов образуются b-дикетоны.
Ацетоуксусный эфир имеет большое применение при различных синтезах, так как его натриевое соединение легко взаимодействует с галоидными алкилами, образуя продукты замещения водорода в группе CH2 на соответствующие радикалы, например:
Полученный продукт может подвергаться так называемому кетонному и кислотному разложению. При нагревании с минеральными кислотами имеет место кетонное разложение с образованием метилпропилкетона:
При нагревании с концентрированным раствором щелочи происходит кислотное разложение и получаются уксусная и масляная кислоты:
- Экспериментальная часть
Методика эксперимента
В круглодонную колбу емкостью 250 мл. помещают 25,2 г этилацетата и быстро вносят в колбу 2,5 г мелконарезанного металлического натрия. Затем колбу соединяют с обратным холодильником, верхний конец которой закрыт хлоркальциевой трубкой. Вначале водород выделяется очень медленно, но через некоторое время реакция начинает идти бурно. После того, как реакция замедлится колбу осторожно нагревают до слабого кипения реакционной смеси в течение 3-х часов до почти полного растворения натрия. Жидкость в колбе охлаждают и осторожно при помешивании добавляют 30 мл 50%-ной уксусной кислоты, затем еще 70мл, так как среда должна быть кислой. Потом добавляют равный объем раствора поваренной соли (для лучшего отделения эфирного слоя) и отделяют верхний слой, состоящий из смеси ацетоуксусного и уксусноэтилового эфиров, от водного слоя. Для лучшего отделения верхнего слоя добавляют петролейный эфир -15 мл. Провели экстракцию 3 раза( вытравливание газа).Затем провели фракционную перегонку. Очистку проводили при
Рисунок 1 – прибор для фракционной перегонки
- Баня, 2- кипелки; 3- перегонная колба; 4- дефлегматор; 5- насадка Вюрца;
6- термометр; 7- холодильник Либиха; 8- аллонж с отводом; 9- хлоркальциевая трубка; 10- колба-приемник.
Основная реакция и расчет необходимых количеств исходных веществ:
- Находим количество вещества этилацетата по следующей формуле:
Экспериментально соотношение между этилацетатом и натрием
0,1212:0,1078. Согласно уравнению реакции стехиометрическое соотношение этилацетата и натрия составляет 2:1.
Получаем, что натрий находится в недостатке. По уравнению:
- Находим теоретическую массу АУЭ
Переводя массу в мл получаем :
- В результате можем определить выход продукта реакции:
- Определили показатель преломления АУЭ:
Идентификация
После окончания синтеза провели идентификацию полученного вещества: прилили несколько миллилитров хлорного железа, через некоторое время появилась сине-фиолетовая окраска комплексной железной соли енольной формы.При добавлении бромной воды бром присоединяется к енольной форме и раствор обесцвечивается. Через несколько секунд окраска появляется снова, так как равновесие смещается и вновь появляется енольная форма. При дальнейшем добавлении бромной воды окраска исчезает.
Заключение
В результате проделанной работы были сделаны следующие выводы:
проведя обзор научной литературы провели синтез ацетоуксусного эфира методом фракционной перегонки. Провели идентификацию полученного вещества, что свидетельствует о его наличие. Выход ацетоуксусного эфира составил 84,7 %, что свидетельствует о качестве выполненной работы.
Список использованных источников
- Нейланд О.Я.Органическая химия : учебник / Нейланд О.Я.- Москва,1989 г.
- Дерябина Г.И., Потапова И.А., О.Н. Нечаева. Практикум по органической химии. Часть I. Методы очистки и идентификации органических соединений. Учебное пособие. − Самара: «Универс-Групп», 2005. − 84 с.
- Ким Д.Г. Органические реакции / Д.Г. Ким. – Челябинск , 1999. – 40 с.
- http://c-books.narod.ru/pryanishnikov1_2_21.html#enol_form
- http://revolution.allbest.ru/chemistry/00381559_0.html
[1] Следует иметь в виду, что определения содержания какой-либо из таутомерных форм в равновесной смеси химическими методами возможно только в том случае, когда используемый реагент взаимодействует с определяемой формой существенно быстрее, чем происходит переход одной формы в другую.
[2] АУЭ – ацетоуксусный эфир
Скачать: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ
Источник