Тема 24. Ароматические амины. Ароматические амины
| Название | Ароматические амины |
| Анкор | Тема 24. Ароматические амины.doc |
| Дата | 16.01.2018 |
| Размер | 0.53 Mb. |
| Формат файла |  |
| Имя файла | Тема 24. Ароматические амины.doc |
| Тип | Документы #14193 |
| Подборка по базе: 10 вопросо тема 4.docx, 1 тема.pdf, Практическое задание 2. Тема 3-4.docx, ОМИСД 1 тема 1.pptx, ОМИСД 1 тема 2.ppt, Реферат, бух. фин. учет, тема 11.docx, ФЛ УПП ТЕМА 14-1.pdf, 1 Подготовка ГДЗС тема № 12 №3.doc, Задания для самостоятельной работы. Тема 4.docx, Задания для самостоятельной работы Тема 3.docx АРОМАТИЧЕСКИЕ АМИНЫ Ароматические амины можно также рассматривать как производные аммиака, в молекуле которого один или несколько атомов водорода замещены ароматическими радикалами. Как и в алифатическом (жирном) ряду, ароматические амины могут быть первичными, вторичными и третичными. В зависимости от того, какие радикалы (только ароматические или ароматические и алифатические) связаны с атомом азота, различают чисто ароматические и жирноароматические. Аминогруппа может быть непосредственно связана с ядром или находиться в боковой цепи. Анилин является родоначальником класса ароматических аминов, в которых аминогруппа непосредственно связана с бензольным кольцом: анилин (фениламин, аминобензол) Номенклатура ароматических аминов Например, анилин, толуидин. По систематической (заместительной) номенклатуре названия аминов образуют из названий радикалов с добавлением окончания –амин или приставки амино- и названия соответствующего углеводорода: Заместительная: орто-толиламин мета-толиламин пара-толиламин орто-аминотолуол мета-аминотолуол пара-аминотоуол (2-аминотоуол) (3-аминотолуол) ( 4-аминотолуол) В ароматическом кольце может быть две и более аминогрупп. Названия соединений с двумя аминогруппами (диамины) образуют из названия двухвалентного углеродного остатка и окончания –диамин или приставки диамино- и названия соответствующего углеводорода: о-фенилендиамин м-фенилендиамин п-фенилендиамин о-диаминобензол м-диаминобензод п-диаминобензол (1,2-диаминобензол) (1,3-диаминобензол) (1,4-диаминобензол) Названия вторичных и третичных аминов чаще всего образуют по принципам рациональной номенклатуры, перечисляя имеющиеся в соединении радикалы и добавляя окончание –амин:
трифениламин (третичный амин) В случае жирноароматических аминов за основу названия берется слово «анилин» и, чтобы показать, что радикал расположен у атома азота, а не в бензольном кольце, перед названием радикала ставится буква N: Рациональная: метилфениламин диметилфениламин Заместительная: N-метиламинобензол N,N-диметиламинобензол α-аминотолуол 2) изомерия по положению аминогруппы: Способы получения ароматических аминов Прямое аминирование бензольного кольца аммиаком протекает в крайне жестких условиях на сложных катализаторах (соли молибдена, вольфрама или хрома и оксиды никеля или меди) при температуре 400 0 С: Восстановление нитробензола – основной способ получения анилина. В качестве восстановителей могут быть использованы железо и соляная или серная кислоты, олово и соляная кислота, сероводород и сульфиды щелочных металлов, гидросульфиты и, наконец, восстановление можно вести каталитическими или электрохимическими методами. В зависимости от условий реакции (рН-среды и типа восстановителя) восстановление приводит к получению различных промежуточных продуктов, которые могут быть использованы в органическом синтезе. Более подробно восстановление нитробензола было рассмотрено при обсуждении химических свойств ароматических нитросоединений. 3. Аммонолиз арилгалогенидов В последнее время ароматические амины получают из галогенопроизводных ароматического ряда и аммиака: Вследствие малой подвижности атома галогена, связанного с ароматическим ядром, реакцию замещения проводят или в очень жестких условиях, или усиливают подвижность галогена введением в бензольное кольцо электроноакцепторных заместителей. При очень жестких условиях (высокие температуры и давление и в присутствии катализаторов – меди и ее соединений) атом галогена может замещаться на амино-группу по механизму отщепления-присоединения (кине-механизм): 4. Реакция Гофмана Способы получения вторичных аминов Вторичные жирноароматические амины получают алкилированием первичных ароматических аминов спиртами или алкилгалогенидами: Способы получения третичных аминов 1) Алкилирование первичных ароматических аминов
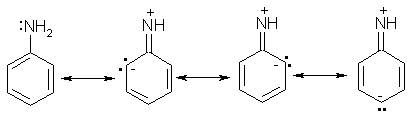
Физические свойства ароматических аминов Низшие ароматические амины плохо растворимы в воде. Накопление алкильных и фенильных радикалов делает эти соединения нерастворимыми в воде. С увеличением числа аминогрупп растворимость в воде повышается. Ароматические амины хорошо растворяются в спиртах и эфирах. Ароматические амины очень легко окисляются кислородом воздуха и поэтому, являясь в чистом виде бесцветными веществами, часто окрашены продуктами окисления. Электронное строение ароматических аминов Свободная электронная пара атома азота в молекуле анилина находится в сопряжении с π-электронами бензольного кольца, т.е. имеет место +М-эффект (р-π-сопряжение). При этом +М-эффект довольно большой, что связано с близкими значениями атомных радиусов атомов азота и углерода и эффективным перекрыванием электронных облаков этих атомов. Таким образом, положительный мезомерный эффект будет в значительной степени преобладать над отрицательным индуктивным эффектом: +М > -I Электронное строение анилина можно представить в виде следующих граничных (или резонансных) структур: Эти структурные формулы показывают, что: 1) электронная пара азота втягивается в бензолное кольцо, при этом на атоме азота появляется частичный положительный заряд (δ + ) и основные свойства аминогруппы уменьшаются. 2) в бензольном кольце, напротив, электронная плотность увеличивается, причем наиболее сильно в орто- и пара-положениях по отношению к аминогруппе. Поэтому атака электрофильных реагентов происходит в орто- и пара-положения. Аминогруппа является ориентантом 1 рода. Химические свойства ароматических аминов Ароматические амины, обладая основными свойствами, реагируют с сильными кислотами, образуя соли аминов: Соли аминов называют заменяя слово –амин на –аммоний, и перед названием указывают название аниона (хлорид, сульфат, нитрат). Под действием более сильных оснований ароматические амины вытесняются из их солей: Ароматические амины имеют менее выраженный основный характер, чем алифатические. Уменьшение основности анилина по сравнению с алифатическими аминами объясняется взаимодействием неподеленной пары электронов азота с электронами ароматического ядра — их сопряжением. Сопряжение уменьшает способность неподеленной электронной пары присоединять протон. Расположив амины по мере снижения основности, получим следующий ряд: Таким образом, алкилирование аминогруппы в ароматических аминах увеличивает основность, а введение в молекулу второго или третьего ароматического кольца приводит к ослаблению основных свойств (трифениламин почти совсем не обладает основными свойствами). Введение в ароматическое кольцо различных заместителей оказывает значительное влияние на основные свойства ароматических аминов. Электронодонорные заместители (Alk, —OCH3) приводят к увеличению электронной плотности на атоме азота и, следовательно, к усилению основных свойств. Кислотные свойства у ароматических аминов выражены сильнее, чем у алифатических. Это связано со снижением электронной плотности на атоме азота за счет р,π-сопряжения, приводящего к увеличению поляризации связи N-H. Однако, кислотные свойства ароматических аминов очень слабы, и водород может замещаться лишь при действии щелочных металлов и амидов: 2. Реакции аминов как нуклеофильных реагентов Хотя нуклеофильные свойства у ароматических аминов выражена слабее, чем у алифатических (за счет сопряжения свободной электронной пары с бензольным кольцом), для них характерны реакции алкилирования и ацилирования, взаимодействие с альдегидами и кетонами, реакции с азотистой кислотой. 1. Алкилирование ароматических аминов Атомы водорода в аминогруппе ароматических аминов могут быть замещены на алкильные радикалы. В качестве алкилирующих агентов используют галогеналканы, спирты, диалкилсульфаты. Реакция алкилирования приводит к получению вторичных и третичных аминов. Реакция протекает по механизму нуклеофильного замещения (SN). В качестве нуклеофила выступает молекула ароматического амина, которая за счет свободной электронной пары атома азота атакует атом углерода с частичным положительным зарядом (δ + ). В зависимости от строения галогеналкана (спирта) может реализовываться SN1 или SN2 механизм: 2. Ацилирование ароматических аминов Атомы водорода в аминогруппе первичных и вторичных аминов могут быть замещены на ацильные радикалы (RCO-). Ароматические амины ацилируются не только ангидридами и хлорангидридами карбоновых кислот, но и карбоновыми кислотами. В результате реакции ароматические амины превращаются в амиды соответствующих карбоновых кислот. Ацильные производные анилина называют анилидами. Реакция протекает по механизму нуклеофильного замещения (SN). Нуклеофилом является ароматический амин, который атакует карбонильный атом углерода с частичным положительным зарядом (δ + ). Реакция ацилирования имеет большое значение. Она используется для защиты аминогруппы от нежелательных воздействий, для уменьшения ориентирующего влияния аминогруппы при проведении некоторых реакций. Амиды карбоновых кислот могут легко гидролизоваться как в кислой, так и в щелочной среде, поэтому после проведения необходимых реакций ацильная «защита» легко снимается и образуется свободная аминогруппа. 3. Реакции с альдегидами и кетонами Первичные ароматические амины легко вступают в реакции с ароматическими альдегидами и кетонами с образованием азометинов (основания Шиффа). При их образовании в качестве нуклеофила выступает ароматический амин. Первая стадия – реакция нуклеофильного присоединения по карбонильной группе (АN), на второй стадии следует отщепление молекулы воды:
Простейшие шиффовы основания бесцветны, более сложные окрашены и относятся к классу азометиновых красителей. Для крашения тканей эти красителе не нашли широкого применения в связи с легкостью гидролиза связи C=N в кислой среде. Однако они широко используются в цветной фотографии, для крашения пластмасс и в полиграфии. Первичные ароматические амины с азотистой кислотой при 0 – 5°С образуют соли диазония: Вторичные амины при взаимодействии с азотистой кислотой образуют N-нитрозо-N-метиланилины: Третичные амины с азотистой кислотой вступают в реакцию электрофильного замещения: 5. Окисление ароматических аминов Ароматические амины в отличие от аминов алифатического ряда легко окисляются, вследствие чего при хранении они обычно приобретают окраску. Первичные ароматические амины окисляются пероксисерной кислотой (H2SO5) до нитрозосоединений, в то время как окисление перманганатом калия (KMnO4) или пероксидом водородом (Н2О2) приводит к нитропроизводным аренов: Окисление анилина хромовой кислотой, диоксидом марганца (1У) и серной кислотой приводит к образованию бензохинона-1,4: 3. Реакции электрофильного замещения в бензольном кольце 1. Реакция галогенирования В ароматических аминах аминогруппа облегчает замещение в орто- и пара-положениях бензольного кольца. Поэтому галогенирование анилина происходит быстро и в отсутствие катализаторов, причем замещаются сразу три атома водорода бензольного кольца, и выпадает белый осадок 2,4,6-триброманилина: Эта реакция бромной водой используется как качественная реакция на анилин. Взаимодействие серной кислоты с анилином на холоду приводит к гидросульфату анилиния. Реакция в кольцо не происходит из-за образования сильно акцепторной дезактивирующей аммонийной группы. Незначительное нагревание гидросульфата анилиния приводит к фенилсульфаминовой кислоте, которая при длительном нагревании при 200 о превращается в пара-аминобензолсульфониевую (сульфаниловую) кислоту. Источник |