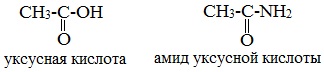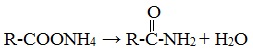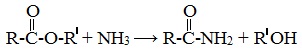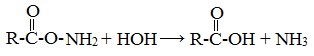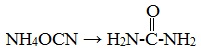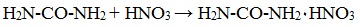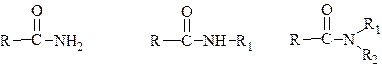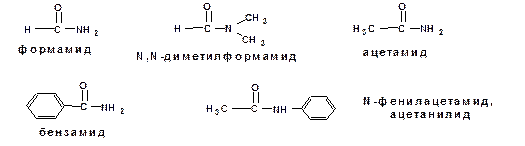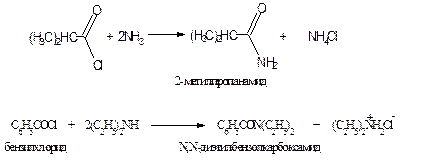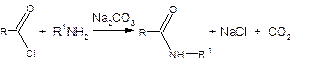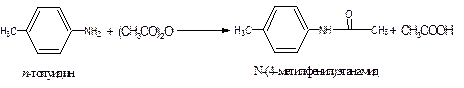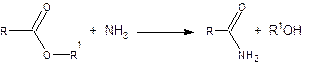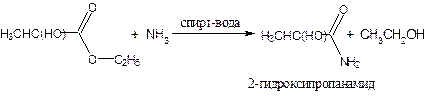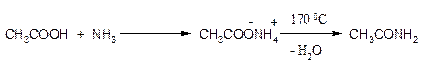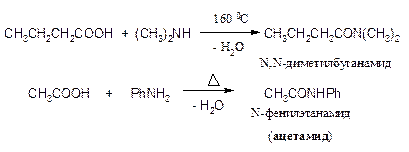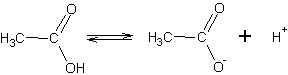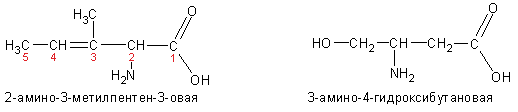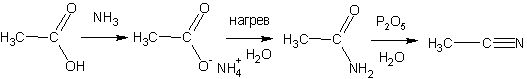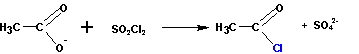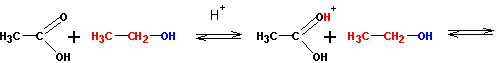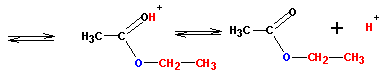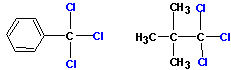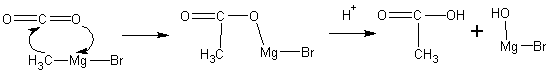Способы получения амидов карбоновых кислот
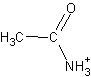
Амидами карбоновых кислот называются производные этих кислот, в которых гидроксильная группа замещена на аминогруппу.
Общая формула амидов – R— CO— NH2.
Функциональная группа 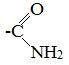
Названия амидов производят от названия кислот, из которых они образовались, с добавлением слова амид.
Амиды получают нагреванием аммонийных солей карбоновых кислот:
или действием аммиака на сложные эфиры:
Амид муравьиной кислоты – жидкость.
Амиды всех других кислот – белые кристаллические вещества. Низшие амиды хорошо растворимы в воде. Водные растворы амидов дают нейтральную реакцию на лакмус.
Важнейшее свойство амидов – способность их к гидролизу в присутствии кислот и щелочей. При этом образуются кислота и аммиак:
К амидам кислот относится мочевина.
Мочевина (карбамид)
Мочевина — это конечный продукт азотистого обмена в организме человека и животных. Она образуется при распаде белков и выделяется вместе с мочой. Мочевину можно рассматривать как полный амид угольной кислоты:
Мочевина, или карбамид – белое кристаллическое вещество, хорошо растворимое в воде. Впервые была получена немецким ученым Велером в 1828 г. из цианата аммония:
Это первое органическое соединение, полученное синтетическим путем.
В промышленности мочевину получают из оксида углерода (IV) и аммиака при нагревании (150 °C) и высоком давлении:
С сильными минеральными кислотами мочевина образует соли:
Применение мочевины
Мочевина – это ценное высококонцентрированное азотное удобрение (46,6 % азота), широко используется на всех почвах и под все культуры.
Как источник азота мочевину добавляют в корм скоту в качестве заменителя протеина.
Источник
Получение амидов
Амиды карбоновых кислот
Производные карбоновых кислот, в которых гидроксигруппа у ацильного атома углерода замещена на аминогруппу называются амидамикарбоновых кислот:
Аминогруппа в амидах может иметь один или два заместителя.
В названиях амидов суффикс названия кислоты «-овая» заменяется на суффикс «-амид». Причем если атом азота имеет заместителей, то указывается положение и количество заместителей. Например:
1. Ацилирование аммиака и аминов галогенангидридами.
Реакция ацилирования аммиака и аминов галогенангидридами экзотермична и проводится при охлаждении.
С целью уменьшения расхода амина, используют методику Шоттена-Баумана, в которой для связывания выделяющегося галогеноводорода добавляют водный раствор щелочи или карбоната.
Реакцию Шоттена-Баумана используют для лабораторного и промышленного получения различных сложных амидов.
2. Ацилирование аммиака и аминов ангидридами
Для ацилирования аминов чаще всего используется самый доступный из ангидридов – уксусный ангидрид.
3. Аммонолиз сложных эфиров.
При взаимодействии сложных эфиров карбоновых кислот с аммиаком, а также первичными или вторичными аминами образуются соответствующие амиды.
Эта реакция протекает в мягких условиях и особенно полезна, когда ацилгалогениды и ангидриды трудно доступны.
4. Взаимодействие карбоновых кислот с аммиаком и аминами.
При нагревании аммониевых солей карбоновых кислот, образующихся при взаимодействии карбоновых кислот с аммиаком, первичными и вторичными аминами, получаются амиды.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Способы получения амидов карбоновых кислот
ГОУ ВПО томский государственный университет
кафедра органической химии
Строение и классификация
Соединения, содержащие группировку –С ООН (карбоксильная группа), называют карбоновыми кислотами.
Карбоновые кислоты подразделяют:
— по числу карбоксильных групп- на монокарбоновые, дикарбоновые, трикарбоновые и т.д.;
— по строению радикала- на алифатические карбоновые и ароматические (бензолкарбоновые ) кислоты;
Строение и свойства карбоксильной группы
Карбоксильная группа поляризована электроноакцепторными свойствами атомов кислорода и способна к ионизации в растворах:
Карбоновые кислоты, начиная с метановой- жидкости. Карбоновые кислоты в жидком состоянии ассоциированы за счет водородных связей, поэтому их температуры кипения выше, чем у спиртов с таким же числом атомов углерода:
Низшие карбоновые кислоты отличаются резким неприятным и раздражающим запахом, смешиваются с водой во всех соотношениях. Однако уже масляная кислота с водой смешивается неполностью, образуя на ее поверхности масло, откуда и получила свое название.
Производные карбоновых кислот
Производными карбоновых кислот называются соединения, которые в результате гидролиза в воде приводят к карбоновым кислотам. К производным карбоновых кислот относят: галогенангидриды, ангидриды, сложные эфиры, амиды и нитрилы, а также эфиры ортокислот:
Реакционная способность соединений к гидролизу падает в указанном направлении.
При наименованиях карбоновых кислот выделяют самую длинную цепь углерода, включающую карбоксил. Атому углерода карбоксильной группы присваивается номер 1 и от него начинается нумерация цепи. Название формируется перечислением номеров и наименований заместителей и названия углеводорода, соответствующего общему числу атомов углерода в цепи с добавлением окончания – овая кислота.
По заместительной номенклатуре кислоты могут называться как производные кислот с меньшим числом атомов углерода. Например, триметилуксусная или триметилэтановая (2,2-диметилпропановая) кислота.
Широко распространены также и тривиальные , исторически сложившиеся наименования:
Гомологический ряд дикарбоновых (диовых) кислот:
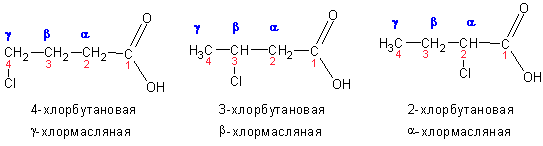
Нередко встречается способ наименования с использованием обозначения положения заместителей буквами греческого алфавита. Обратите внимание на то, что обозначение начинается с атома углерода, соседнего с карбоксильной группой:
Номенклатура длинноцепочечных карбоновых кислот, распространенных в растениях и живых организмах. Длинноцепочечные карбоновые кислоты с числом атомов углерода 16-20 очень широко распространены в живой природе. Их номенклатура имеет свои особенности. Насыщенные кислоты кроме наименований по номенклатуре IUPAC могут обозначать и тривиальными названиями. У ненасыщенных кислот также имеются тривиальные наименования. Кроме того, оба типа кислот имеют сокращенные наименования, указывающие на количество атомов углерода в молекуле и количество ненасыщенных связей. Эти данные объединены в таблице:
Число атомов углерода
С16:0, пальмитиновая (гексадекановая )
С16:1 пальмитолеиновая (9-гексадеценовая)
С18:0 стеариновая (октадекановая)
С18:1 олеиновая (9-октадеценовая
С18:2 линолевая (9,12-октадекадиеновая)
С18:3 линоленовая (9,12,15-октадекатриеновая)
С20:0 арахиновая (эйкозановая )
С20:4 арахидоновая (5,8,11,14-эйкозантетраеновая)
Конфигурации кратных связей всех природных ненасыщенных кислот находятся в конформации цис — .
Химические свойства карбоновых кислот
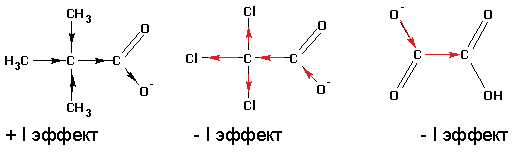
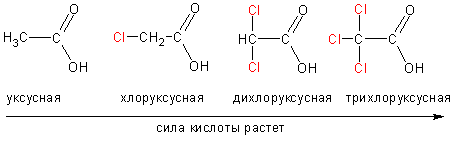
В отличие от спиртов и фенолов, карбоновые кислоты обладают заметной кислотностью, хотя и значительно уступают по силе минеральным кислотам, таким, как фосфорная или соляная. Поскольку кислотность напрямую связана с легкостью отщепления протона, сила кислоты увеличивается, если отрицательный заряд аниона лучше компенсируется отрицательными индуктивными или мезомерными эффектами:
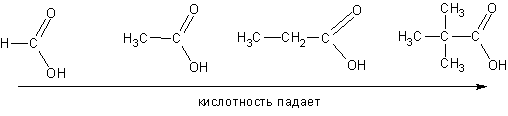
И наоборот, кислотность падает, если анион дестабилизирован электронодонорными эффектами алкильных групп:
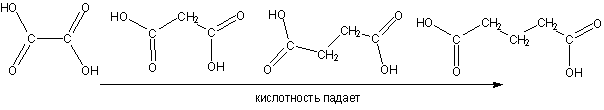
Дикарбоновые кислоты сильнее монокарбоновых (влияние соседней карбоксильной группы с ее –I эффектом), но в ряду гомологов кислотность падает с удалением карбоксильных групп по цепи:
Тем не менее, сила большинства карбоновых кислот достаточна, чтобы вытеснить угольную кислоту из ее солей:
Карбоновые кислоты не реагируют с солями более сильных кислот- фосфорной, соляной серной и т.д.
Значения рКа карбоновых кислот, соответствующие процессу:
находятся в пределах 4,7-4,9. Исключения составляют муравьиная кислота (рКа=3,75), а также оксо-, окси-, амино- и галогензамещенные кислоты, у которых рКа заметно ниже (сила кислоты, соответственно, больше).
Кальциевые соли практически всех карбоновых кислот в воде нерастворимы, хорошо растворимы натриевые, аммониевые и калиевые соли.
Реакции карбоновых кислот
— реакции карбоксильной группы;
— реакции углеродного скелета.
1. Образование амидов и нитрилов
Амиды практически лишены основных свойств азота и водном растворе нейтральны. Сопряженная кислота ацетамида, например:
-1,5 (это означает, что протон на ней практически не удерживается, то есть ацетамид лишен оснОвных свойств). Единственный жидкий при нормальной температуре- формамид, остальные амиды- кристаллические вещества.
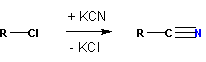
Кроме дегидратации амидов, нитрилы можно получать также обменными реакциями алкилгалогенидов и цианидов калия или натрия:
Амиды называют по названию алкана , соответствующего числу атомов углерода в самой длинной цепи, содержащей амидогруппу, с перечислением заместителей и добавлением окончания – амид , например:
Нитрилы называют по имени алкана , соответствующего числу атомов углерода в цепи (включая углерод цианогруппы ) с добавлением окончания – нитрил , например:
2. Получение ангидридов кислот
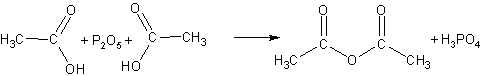
Ангидриды кислот можно рассматривать как продукты дегидратации двух молекул кислоты. При отнятии воды от карбоновых кислот (которое удается осуществить только при помощи фосфорного ангидрида Р2О5) можно получать смешанные и моноангидриды :
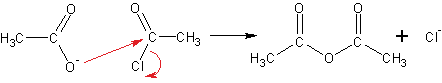
Другой способ получения ангидридов- реакция солей карбоновых кислот с галогенангидридами кислот:
Уксусный ангидрид- жидкость, кипящая при 140 о С , обладающая неприятным резким запахом. Ангидрида муравьиной кислоты не существует.
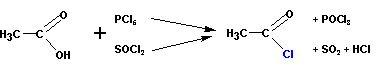
3. Получение галогенангидридов кислот
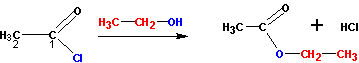
Хлорангидриды кислот получают классическими реакциями замены гидроксильной группы на галоген (так же, как и в случае со спиртами):
Или при реакции соли карбоновой кислоты с хлористым сульфурилом :
На рисунке показано получение хлорангидрида уксусной кислоты. Фторангидриды кислот получают из хлорангидридов при реакции с KHF2.
Галогенангидриды называют по названию алкана , соответствующего числу атомов углерода в самой длинной цепи, содержащей галоид, с перечислением заместителей и добавлением окончания – оил и наименования галогенида, например:
4. Получение сложных эфиров
Этерификация кислот спиртами приводит к сложным эфирам с переменным успехом.
Реакция протекает в кислой среде и обратима. Роль кислоты заключается в активации (усилении реакционной способности) карбоновой кислоты (но не спирта!) путем протонирования:
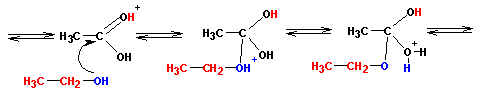
Протонированная по атому кислорода карбонильной группы кислота атакуется атомом кислорода спирта (на нем имеются две неподеленные пары электронов):
Реакция завершается переносом протона, отщеплением воды и, наконец, отщеплением самого протона (регенерация катализатора):
Поскольку все стадии этерификации обратимы, для увеличения выхода приходится отгонять из реакционной смеси продукт (эфир) или связывать воду. Обратите внимание, что в составе сложного эфира присутствует атом кислорода от спирта, а не от кислоты. Успех реакции в значительной степени зависит от строения спирта и кислоты. Так, наиболее успешно реакция протекает с короткими молекулами спиртов и кислот. Важное значение имеет то, чтобы ни спирт, ни кислота не были стерически затруднены у реакционных центров (гидроксильной и карбоксильной групп). Скорость реакции этерификации кислот спиртами растет с понижением значения рН до определенной величины, а с дальнейшим снижением рН опять падает. Связано это со все возрастающей степенью протонирования (по атому кислорода) молекулы спирта и, соответственно, потерей ей реакционной способности (атаковать карбонильный углерод).
Другим удобным способом получения сложных эфиров является реакция солей карбоновых кислот с галоидными алкилами :
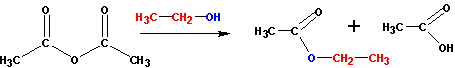
При наличии ангидридов и галогенангидридов кислот наиболее удобно получать эфиры из них, так как эти реакции идут практически полностью (и необратимо). С галогенангидридами спирты реагируют по схеме:
С ангидридами реакции идут немного менее активно, но гораздо лучше, чем с самими кислотами. В реакцию берут спирт и ангидрид кислоты:
Номенклатура сложных эфиров
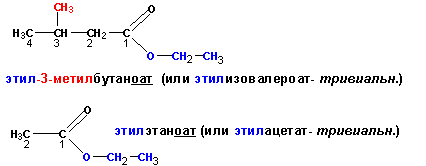
Сложные эфиры называют по названию радикала спирта, от которого образован сложный эфир, добавлением названия алкана , соответствующего числу атомов углерода в самой длинной цепи, содержащей карбонильную группу, с перечислением заместителей и добавлением окончания – оат , например:
Сложные эфиры низкомолекулярных карбоновых кислот и спиртов – жидкости, с приятными фруктовыми запахами (банан, вишня, груша, яблоки и т.д.). Сложные эфиры длинноцепочечных карбоновых кислот и таких же спиртов- твердые вещества, смесь которых составляет растительные и животные воски, а также и пчелиный воск. Воски защищают фрукты от неблагоприятных атмосферных воздействий, а шерсть и перья животных и птиц- от влаги и грязи. Миристилпальмитат, локализованный в углублениях костей черепа кашалота, является проводником звуков при эхолокации.
Натриевые соли длинноцепочечных карбоновых кислот используются в качестве основы для производства мыла , поскольку обладая двойственной природой, их молекулы способны эмульгировать жир и грязь, унося их с водой. Калиевые соли жирных кислот являются компонентом жидкого мыла.
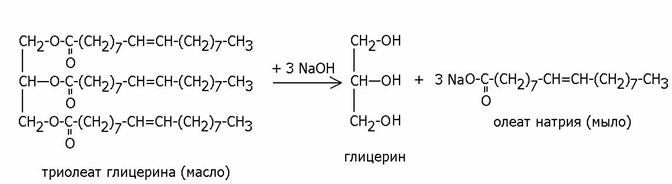
Эфиры карбоновых кислот с глицерином представляют собой жиры и масла . Если в состав сложного эфира с глицерином входят остатки насыщенных карбоновых кислот (пальмитиновой С16:0, стеариновой С18:0, арахиновой С20:0), то эфиры представляют собой твердые при нормальной температуре жиры (животные жиры и сало). Если в состав эфиров входит 2 и более остатка непредельных карбоновых кислот (пальмитолеиновой С16:1, олеиновой С18:1, линолевой С18:2, линоленовой С18:3 или арахидоновой С20:4), то такие эфиры являются жидкими при нормальной температуре маслами (например, растительные масла).
Жиры и масла с водой не смешиваются и не эмульгируют , но при обработке щелочами при нагревании омыляются, гидролизуясь до глицерина и солей карбоновых кислот, называемых мылами:
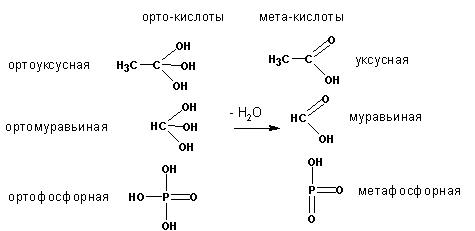
5. Получение эфиров ортокислот
Карбоновые ортокислоты в свободном виде (в отличие от фосфорной кислоты), не существуют:
Однако их орто-эфиры вполне устойчивы и могут быть получены, например, из тригалоидных алкилов и алкоголятов:
Из хлороформа, таким образом, получаются ортомуравьиные эфиры.
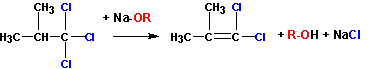
Условие- галоидные алкилы не должны иметь на соседнем атоме углерода ни одного атома водорода, например:
Если у a — углерода найдется атом водорода, то произойдет отщепление HCl :
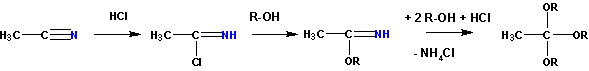
Ортоэфиры можно также получить действием на нитрилы хлористым водородом в присутствии избытка спирта:
Эфиры гидролизуются по стадиям, до образования вначале сложного эфира, а уже затем он гидролизуется до кислоты и спирта.
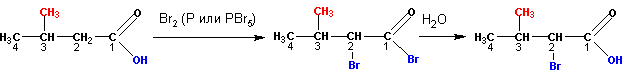
6. Получение a — галогензамещенных кислот
При реакциях карбоновых кислот с галогеном (бром) в присутствии красного фосфора получаются a — галогензамещенные кислоты:
7. Другие реакции карбоновых кислот и их производных
Пиролиз солей карбоновых кислот приводит к алканам с тем же числом атомов углерода, что и в радикале соли (см. получение алканов).
Электролиз растворов солей карбоновых кислот приводит к образованию алканов с удвоенным числом атомов углерода по сравнению с радикалом соли.
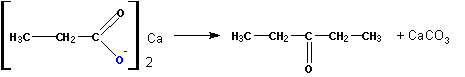
Пиролиз кальциевых солей карбоновых кислот приводит к образованию кетонов с частичным декарбоксилированием :
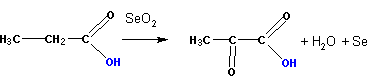
Кислоты окисляются двуокисью селена SeO 2 в a — кетокислоты:
Аналогичные реакции характерны и для карбонильных соединений- альдегидов и кетонов. Окисление протекает всегда по соседнему с карбонильной группой углероду.
Получение карбоновых кислот
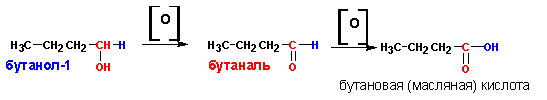
1. Окисление первичных спиртов последовательно приводит к карбоновым кислотам:
2. Окисление кетонов
Кетоны получаются в результате окисления вторичных спиртов и после жесткого окисления дают смеси кислот:
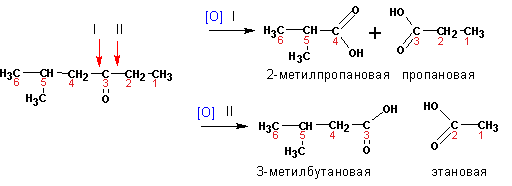
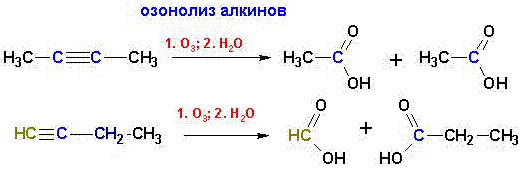
3. Окисление непредельных углеводородов
Синтетического применения не имеет, используется только для установления места положения тройной связи. Кислоты получаются в качестве «побочных» продуктов. Однако, в некоторых случаях может являться единственным способом «мягкого» введения карбоксильной группы.
Окисление алкенов и алкинов горячим раствором К MnO 4 дает аналогичный результат (см. свойства непредельных соединений).
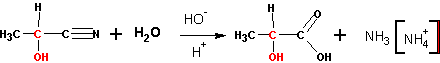
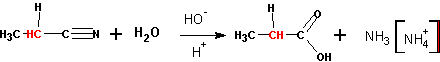
4. Омыление оксинитрилов (циангидринов )
Приводит к получению a — оксикислот :
5. Омыление нитрилов
Сами нитрилы можно получать обменными реакциями цианистого калия или натрия с галоидными алкилами (см. выше также другие способы):
6. Реакции с магнийорганическими реагентами (реактивами Гриньяра )
Магнийорганические соединения перемешивают с тонкоизмельченным «сухим льдом» (твердой двуокисью углерода СО2 ), после чего смесь выливается в разбавленный раствор уксусной или соляной кислоты:
Если карбоксильная группа стоит при бензольном кольце, такие кислоты называют бензолкарбоновыми . Тривиальное название простейшей такой кислоты- бензойная. Бензойная кислота немного сильнее уксусной по причине отрицательного индуктивного эффекта атома углерода кольца, находящегося в состоянии sp2- гибридизации.
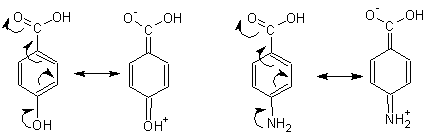
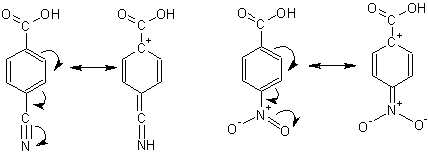
Сила бензолкарбоновых кислот сильно варьирует в зависимости от наличия и положения в кольце заместителей. Расположенные в орто- или пара- положении к карбоксильной группе заместители влияют на состояние атома углерода, с которым связана карбоксильная группа, и уже через него- на степень стабилизации или дестабилизации образующегося в результате отщепления протона аниона кислоты, увеличивая или уменьшая кислотность.
Заместители I рода (электронодонорные ) уменьшают кислотность:
а заместители II рода кислотность увеличивают:
Напомним, что стягивание электронной плотности с карбоксильной группы облегчает отщепление протона, следовательно, увеличивает силу кислоты. Напротив, подача электронной плотности в карбоксильную группу дестабилизирует образующийся анион и он образуется труднее (протон не отсоединяется).
Большое значение имеет положение заместителя. Находясь в орто-положении к карбоксильной группе, заместители 1 рода влияют также на кислотность отрицательными индуктивными эффектами (группировки –ОН, -NH2, галогены –Х). Влияние индуктивными эффектами из пара- положения затруднено потому, что индуктивный эффект быстро затухает с увеличением расстояния.
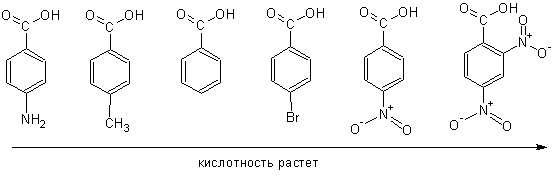
Увеличение числа заместителей усиливает «эффект». Например, кислотность соединений меняется в показанном направлении:
В таблице приведены значения рКа для ряда замещенных бензойных кислот
Источник