- Алюминий. Получение алюминия.
- Этапы получения алюминия.
- Схема установки для получения алюминия.
- Алюминий (Al)
- Соединения алюминия
- Al2O3 (глинозем)
- Al(OH)3
- Получение и применение алюминия
- Алюминий: свойства, производство и применение
- Природные соединения алюминия
- Производство алюминия
- Добыча бокситов
- Производство глинозёма
- Дробление
- Выщелачивание
- Декомпозиция
- Электролиз
- Литейное производство
- Литейные сплавы
- Прокат
- Экструзия
- Переработка алюминия
- Сфера применения
- В качестве восстановителя
- В чёрной металлургии
- Сплавы на основе алюминия
- Алюминий, как добавка в другие сплавы
- Ювелирные изделия
- Столовые приборы
- Стекловарение
- Пищевая промышленность
- Военная промышленность
- В ракетной технике
- Алюмоэнергетика
- Месторождения в России и мире
- Мировые запасы
- Страны, добывающие алюминий.
Алюминий. Получение алюминия.
Самым первым получил металлический алюминий немецкий химик Ф. Велер в 1821 году, с помощью восстановления AlCl3 металлическим калием. В 1854 году французский ученый Сент-Клер Девиль восстановил натрием двойной AlCl3 с помощью электролиза.
Наиболее удобный и более распространенный метод получения алюминия предложил американец Ч. Холл, чей метод предлагал электролиз оксида алюминия в растворенном в расплавленном криолите Na3AlF6.
Сырьем служат: бокситы, нефелины, алуниты и т.д.
В промышленности алюминий получают электролизом раствора чистого оксида алюминия в расплавленном криолите с добавлением CaF2 при температуре 950 °С. Криолит является растворителем, а добавка служит для поддержания оптимальной температуры плавления в ванне (около 1000°С). Электролиз водных растворы нецелесообразен, т.к. алюминий более активный элемент, чем водород. Поэтому на катоде будет выделяться водород, а не металл.
Этапы получения алюминия.
1.Очищение от примесей минеральной руды.
- проводят в стальных ваннах с теплоизоляцией и внутренней футеровкой из огнеупорного кирпича (фторид кальция расплавляется).
Катод: графитовые блоки, которыми выложено дно ванны.
Анод: угольные стержни.
Схема установки для получения алюминия.
Сначала засыпают криолит и CaF2, которые расплавляются от тепла от действия электрического тока. Затем добавляют оксид алюминия. Электрической энергии надо много, ток должен быть постоянным более 100 кА. Поэтому с экономической стороны должна быть дешевая гидростанция.
Источник
Алюминий (Al)
Алюминий (квасцы) впервые был полуен в 1825 году датчанином Г. К. Эрстедом. Изначально, до открытия промышленного способа получения, алюминий был дорооже золота.
Алюминий является самым распространенным металлом в земной коре (массовая доля составляет 7-8%), и третьим по распространенности среди всех элементов после кислорода и кремния. В свободном виде в проироде алюминий не встречается.
Важнейшие природные соединения алюминия:
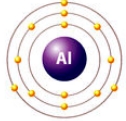
Рис. Строение атома алюминия.
Алюминий химически активный металл — на его внешнем электронном уровне находятся три электрона, которые участвуют в образовании ковалентных связей при взаимодействии алюминия с другими химическими элементами (см. Ковалентная связь). Алюминий — сильный восстановитель, во всех соединениях проявляет степень окисления +3.
При комнатной температуре алюминий вступает в реакцию с кислородом, содержащимся в атмосферном воздухе, с образованием прочной оксидной пленки, которая надежно препятствует процессу дальнейшего окисления (корродирования) металла, в результате чего химическая активность алюминия снижается.
Благодаря оксидной пленке алюминий не вступает в реакцию с азотной кислотой при комнатной температуре, поэтому, алюминиевая посуда является надежной тарой для хранения и трансопртирования азотной кислоты.
Физические свойства алюминия:
- металл серебристо-белого цвета;
- твердый;
- прочный;
- легкий;
- пластичный (протягивается в тонкую проволоку и фольгу);
- обладает высокой электро- и теплопроводностью;
- температура плавления 660°C
- природный алюминий состоит из одного изотопа 27 13Al
Химические свойства алюминия:
- при снятии оксидной пленки алюминий реагирует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2; - при комнатной температуре вступает в реакции с бромом и хлором с образованием солей:
2Al + 3Br2 = 2AlCl3; - при высокой температуре алюминий реагирует с кислородом и серой (реакция сопровождается выделением большого кол-ва тепла):
4Al + 3O2 = 2Al2O3 + Q;
2Al + 3S = Al2S3 + Q; - при t=800°C реагирует с азотом:
2Al + N2 = 2AlN; - при t=2000°C реагирует с углеродом:
2Al + 3C = Al4C3; - восстанавливает многие металлы из их оксидов — алюмотермией (при t до 3000°C) получают промышленным способом вольфрам, ванадий, титан, кальций, хром, железо, марганец:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe; - с соляной и разбавленной серной кислотой реагирует с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2; - с концентрированной серной кислотой реагирует при высокой температуре:
2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O; - со щелочами реагирует с выделением водорода и образованием комплексных солей — реакция идет в несколько этапов: при погружении алюминия в раствор щелочи происходит растворение прочной защитной оксидной пленки, которая находится на поверхности металла; после растворения пленки, алюминий, как активиный металл, реагирует с водой с образованием гидроксида алюминия, который взаимодействует со щелочью, как амфотерный гидроксид:
- Al2O3+2NaOH = 2NaAlO2+H2O — растворение оксидной пленки;
- 2Al+6H2O = 2Al(OH)3+3H2↑ — взаимодействие алюминия с водой с образованием гидроксида алюминия;
- NaOH+Al(OH)3 = NaAlO2+2H2O — взаимодействие гидроксида алюминия со щелочью
- 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑ — суммарное уравнение реакции алюминия со щелочью.
Соединения алюминия
Al2O3 (глинозем)
Оксид алюминия Al2O3 является белым, очень тугоплавким и твердым веществом (в природе тверже только алмаз, карборунд и боразон).
Свойства глинозема:
- не растворяется в воде и вступает с ней в реакцию;
- является амфотерным веществом, реагируя с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]; - как амфотерный оксид реагирует при сплавлении с оксидами металлов и солями, образуя алюминаты:
Al2O3 + K2O = 2KAlO2.
В промышленности глинозем получают из бокситов. В лабораторных условиях глинозем можно получить сжигая алюминий в кислороде:
4Al + 3O2 = 2Al2O3.
Применение глинозема:
- для получения алюминия и электротехнической керамики;
- в качестве абразивного и огнеупорного материала;
- в качестве катализатора в реакциях органического синтеза.
Al(OH)3
Гидроксид алюминия Al(OH)3 является белым твердым кристаллическим веществом, которое получается в результате обменной реакции из раствора гидроксида алюминия — выпадает в виде белого студенистого осадка, кристаллизующегося со временем. Это амфотерное соединение почти не растворимое в воде:
Al(OH)3 + 3NaOH = Na3[Al(OH)6];
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Гидроксид алюминия получают путем действия щелочей на растворы солей алюминия:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl.
Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде — кислород:
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C — проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник
Алюминий: свойства, производство и применение
Алюминий – металл серебристо-белого цвета, обладающий достаточно низким удельным весом и хорошо поддающийся плавке и механическим воздействиям. По уровню распространённости в природе он занимает третье место, среди всех химических элементов периодической системы Д. И. Менделеева; среди металлов – первое.
- Высокая тепло- и электропроводность.
- Стойкость к понижению температуры.
- Плотность – 2712 кг/м 3 .
- Температура плавления: 658 0 C– технический металл; 660 0 C– чистый металл.
- Пластичен. Из него можно получать тонкий лист и фольгу.
- Хорошо поддаётся сварке.
- Обладает хорошей светоотражающей способностью.
- Алюминий – высоко активен.
- На воздухе образует оксидную плёнку, которая в дальнейшем обеспечивает защиту от коррозии, и не даёт возможности вступать в реакцию с рядом окислителей.
- При нормальных условиях вступает в реакции с бромом и хлором.
- При повышении температуры образует соединения с азотом, йодом, кислородом, серой, фосфором, углеродом.
- Хорошо взаимодействует со щелочами.
- Образует множество сплавов с металлами.
Природные соединения алюминия
В чистом виде алюминий почти никогда не встречается (исключение могут составлять лишь особые восстановительные условия, образующиеся, к примеру, при выходе магмы из жерл вулканов). Гораздо чаще в земной коре присутствуют его соединения:
- Корунд (минеральные разновидности: рубин, сапфир, падпараджа, звёздчатый рубин, лейкосапфир, обыкновенный корунд и наждак)
- Бёмит.
- Диаспор.
- Хризоберилл (александрит).
- Гиббсит.
- Кианит.
- Каолинит.
- Мусковит.
- Алуниты.
- Анортит.
- Андалузит.
- Нефелины.
- Сподумен.
- Силлиманит.
- Криолит.
- Альбит.
- Отроклаз.
- Берилл.
- Шпинель.
- Полевые шпаты.
- Слюды.
- Бокситы.
- Глинозёмы.
В водоёмах содержание алюминия колеблется в пределах:
- От 0,001 до 10 мг/л – пресноводные бассейны рек и озёр.
- 0,01 мг/л – морская вода.
Производство алюминия
Алюминий является одним из самых востребованных металлов современной индустрии. Однако для его производства необходимо пройти несколько этапов, затратить значительное количество энергетических, транспортных и сырьевых ресурсов, использовать много персонала.
Добыча бокситов
Основным видом руды для получения алюминия служат бокситы, причём они являются качественными при содержании искомого минерала в 50% и более. В природе бокситы представлены в глиноподобном виде, массой красно-коричневого кирпичного цвета. Промышленное использование определяется морфологией, составом пород, условиями залегания рудных тел месторождений.
Добычу этого полезного ископаемого осуществляют как открытым (наиболее распространённым), так и закрытым способом (применяемым при значительных глубинах залегания, порядка 500 м и ниже). Проводя при этом бурильные, взрывные работы, используя селективные методы и применяя фрезерные технологии.
Производство глинозёма
Дальнейшим этапом производства алюминия является метод Байера, с помощью которого осуществляется выпуск 90% объёма мирового глинозёма – оксида алюминия Al2O3, представляющего собой порошок белого цвета. Способ достаточно прост и экономичен, но применим лишь для бокситов, отличающихся высоким качеством и малым содержанием примесей (лучше всего для этих целей подходит кремнезём).
Дробление
Прежде всего, добытые бокситы подвергают дроблению, то есть – раздавливания, раскалыванию и ударам с целью получения материала необходимой крупности и затем уже размалываемого с помощью истирания. Это даёт возможность довести материал до раскрытия зёрен искомого компонента, чтобы в дальнейшем сырьё полностью могло отдать находящийся в нём алюминий.
Выщелачивание
После чего раздробленный оксид алюминия растворяют в концентрированной щёлочи. Для достижения максимального эффекта в раствор добавляют известь. В результате данного технологического процесса получается пульпа, содержащая в себе алюминат натрия и посторонние примеси, первоначально входящие в состав боксита – красный шлам. Балласт удаляют, а полезный состав подвергают декомпозиции.
Декомпозиция
Процесс «выкручивания» – выделения кристаллического алюмината натрия в осадок носит название декомпозиции. Достаточно сложная и длительная процедура, включающая в себя разбавление водой с последующим охлаждением раствора в трубчатых теплообменниках, подразделяется на два этапа:
- Гидролиз раствора с получением гидроокиси алюминия.
- Кристаллизация, ускоряемая с помощью затравки и перемешивания.
Электролиз
Следующим этапом производства является электролиз, выполняемый при температуре 950 0 C в ваннах с расплавом криолита. Пропускаемый через раствор электрический ток, величиной более 400кА, освобождает алюминий от кислорода. Жидкий металл собирается на дне ванны для дальнейшего использования или – в качестве отправляемых потребителям слитков, или – для изготовления сплавов.
Литейное производство
Использования алюминия в чистом виде затруднено в связи с недостаточной прочностью, поэтому для её увеличения используют примеси. Химические соединения этого металла, полученные в металлургических процессах, подразделяются на два вида сплавов:
- Литейные.
- Конструкционные – полученные в результате деформации, которые в дальнейшем могут подвергаться или не подвергаться термическому воздействию.
Литейные сплавы
Основными добавками (легирующими элементами) при производстве литейных алюминиевых сплавов выступают:
- Магний, марганец, медь, кремний, цинк.
- В меньшей степени используются бериллий, литий, цирконий, титан.
Высокие показатели полученного литья определяются:
- Возможностью заполнения расплавом сложных форм, что является проявлением хороших литейных свойств.
- Незначительной массой изготавливаемой продукции, вследствие малого удельного веса самого алюминия.
- Стойкостью к коррозионному воздействию.
- Повышенной механической прочностью и твердостью, по сравнению с исходным материалом.
- Податливостью к обрабатываемым воздействиям.
По получаемым качествам, алюминиевые сплавы можно классифицировать на три вида:
- Конструкционные герметичные. Обладают хорошими антикоррозийными и литейными свойствами.
- Коррозионностойкие. Устойчивы к воздействиям агрессивных химических сред и воды. Достаточно легко обрабатываются в процессе резания и легко поддаются сварке.
- Жаропрочные. Сохраняют свои свойства при повышенных температурах и механических воздействиях.
Прокат
С помощью горячей или холодной прокатки на прокатных станах, алюминию придают форму, удобную для дальнейшего использования. Это может быть фольга, листы различной толщины, шины. В дальнейшем из этих изделий могут быть изготовлены прутки, трубы, разнообразные профили, находящие широкое применение в различных отраслях экономики.
Экструзия
Экструзия – это продавливание размягчённого в результате расплава металла через формирующий профиль. Наиболее наглядно данный процесс демонстрирует обычная бытовая мясорубка. Процесс позволяет уплотнить и повысить прочность материала экструдированного профильного изделия по сравнению с исходным сырьём.
Переработка алюминия
Современные экономические условия и экологические нормы сформировали ряд требований, выполнение которых как нельзя лучше обеспечивает технология переработка отходов алюминия. Дело в том, что металл сохраняется достаточно долгое время, не подвергаясь коррозии, при необходимости – в спрессованном состоянии. Также процесс переработки не требует большого расхода электроэнергии.
Рынок вторичного алюминиевого сырья представлен отходами изделий:
- Электротехнического профиля. Как правило, этот материал содержит в себе минимальное количество примесей.
- Пищевого направления – посуды и ёмкостей.
- Профильного формата, этот материал часто возникает при разделке мебели и стройдеталей.
- Моторного – обычно силумина.
- Средств авиационного и водного транспорта – самолётов, вертолётов, лодок.
Собранный алюминиевый лом подвергается сортировке, прессованию, высушиванию, плавлению. После чего направляется потребителям.
Сфера применения
В качестве восстановителя
В силу своих химических свойств, алюминий является сильным восстановителем, так как хорошо вступает в реакцию соединения с кислородом. Данное свойство находит применение для восстановления галогенидов и редких металлов.
В чёрной металлургии
Сталелитейное производство использует алюминий и его сплавы в качестве раскислителей, позволяющих не только избавиться от кислорода, но и исключить возможную пористость готовых изделий под воздействием пузырьков окиси углерода. Также в этой отрасли он применяется в качестве легирующих добавок и модификаторов в виде гранул, порошка и пудры.
Сплавы на основе алюминия
Существуют целые серии сплавов на основе алюминия, пользующихся огромным спросом в качестве конструкционных материалов. В основном это – соединения с магнием, марганцем, медью, легируемые в свою очередь магнием, марганцем, железом и кремнием. Алюминиевые сплавы обладают пластичностью, прочностью, технологичностью, устойчивостью к вибрационным воздействиям и коррозийной стойкостью.
Алюминий, как добавка в другие сплавы
Находит применение алюминий и в сплавах других металлов:
Ювелирные изделия
В последнее время серебристо-белый металл вновь, как полтора столетия назад, стал привлекать внимание ювелиров, желающих внести некоторое разнообразие в стандартный набор используемых материалов. Причём не только в качестве дешёвой бижутерии, но и основы драгоценных изделий, а также и самостоятельных изысканных изделий.
Столовые приборы
Алюминиевые столовые приборы в настоящее время не пользуются такой популярностью, как ранее, по причинам вредности для человеческого здоровья и потери своего внешнего вида в процессе эксплуатации. Хотя некоторое количество их присутствует в общепите. Также некоторая утварь, типа ложек, вилок котелков, фляжек используется в качестве армейской посуды и туристского снаряжения.
Стекловарение
В индустрии производства стекла и стеклянных изделий алюминий и его соединения находят широкое применение:
- Глинозём (окись алюминия) повышает прочность, твёрдость и стойкость к температурным и химическим воздействиям.
- Алюминиевые соли необходимы для производства особых видов стекла.
Пищевая промышленность
Помимо пищевой добавки в продуктах питания E173, алюминий входит в состав антацидных средств, предназначенных для обволакивания органов желудочно-кишечного тракта с целью их обезболивания в ряде заболеваний.
Военная промышленность
Благодаря своим свойствам: лёгкости и податливости, алюминий находит широкое применение в конструкциях разнообразного вида вооружений: от пистолетов и автоматов – до танков, ракет и самолётов. Даже такие экзотические для нашего времени изделия, как арбалеты, шпаги, рапиры, сабли не обходятся без данного минерала.
В ракетной технике
Помимо использования алюминия в качестве материала для изготовления ракет, спутников и иных космических летательных аппаратов; порошок из этого металла, а также окислитель на его основе являются важными компонентами твёрдого топлива – горючего для запуска челноков и ракет.
Алюмоэнергетика
Промежуточная роль алюминия для активизации выработки первичных энергоносителей или непосредственно тепловой и электрической энергии проявляет себя в сравнительно новой отрасли – алюмоэнергетике. Именно здесь, в процессе окисления этого уникального минерала производится:
- Водород из воды.
- Электроэнергия – за счёт воздействия кислородом воздуха в электрохимических генераторах.
Месторождения в России и мире
50 месторождений алюминиевых руд расположено на территории России. Крупнейшие из них расположены в Архангельской, Белгородской, Ленинградской и Свердловской областях, а также в республике Коми.
Мировые бокситные месторождения располагаются в 7 регионах мира:
- Африка – Гвинея и ряд стран в центре и на западе континента.
- Южная Америка – Бразилия, Венесуэла, Гайана и Суринам.
- Карибские острова – Ямайка.
- Европа – Греция и ряд регионов России.
- Азия – Индия, Китай, Турция.
- Австралия.
Мировые запасы
Доказанные запасы алюминиевых руд оцениваются в 30 млрд. тонн, ресурсные оценки Геологической службы США доводят эту цифру до 75 млрд. тонн.
Страны, добывающие алюминий.
В 2018 году общемировая выплавка алюминия достигла 60 миллионов тонн, распределившись по странам следующим образом:
- Китай – 33 млн. тонн.
- Россия – 3,71 млн. тонн.
- Индия – 3,68 млн. тонн.
- Канада – 2,9 млн. тонн.
- ОАЭ – 2,6 млн. тонн.
- Австралия – 1,6 млн. тонн.
- Норвегия – 1,35 млн. тонн.
- Бахрейн – 0,995 млн. тонн.
- Саудовская Аравия – 0,916 млн. тонн.
- США – 0,89 млн. тонн.
Алюминий занимает лидирующее положение среди производимых на планете цветных металлов, уступая в общем металлургическом списке лишь стали.
Источник








