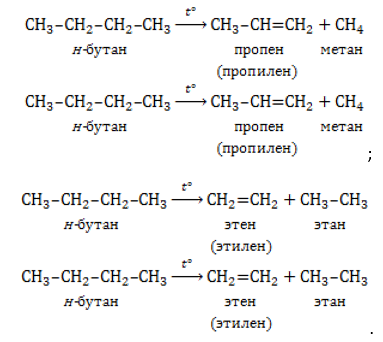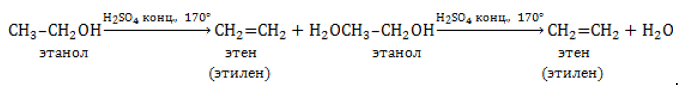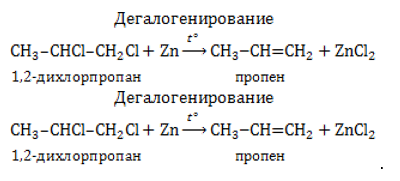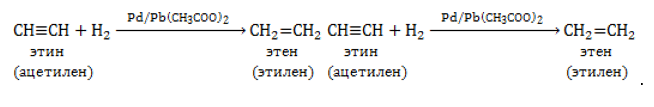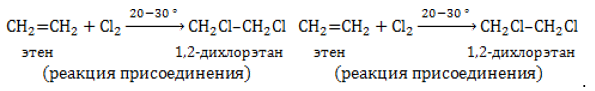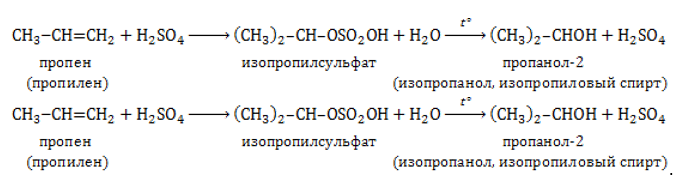- Получение алкинов
- Получение алкинов
- 1. Дегидрирование алканов
- 2. Пиролиз метана
- 3. Гидролиз карбида кальция
- 4. Дегидрогалогенирование дигалогеналканов
- 5. Алкилирование соединений алкинов с металлами
- Добавить комментарий Отменить ответ
- Применение алкенов
- Получение алкеновых углеводородов
- Основные способы получения алкенов в промышленности
- Лабораторный синтез алкенов
- Области применения алкенов
- Заключение
- Алкены. Получение, химические свойства и применение алкенов
Получение алкинов
Алкины – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна тройная связь между атомами углерода С≡С.
Остановимся на свойствах, способах получения и особенностях строения алкинов.
Получение алкинов
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи.
| Например, при дегидрировании этана может образоваться этилен или ацетилен: |
2. Пиролиз метана
Пиролиз метана – это промышленный способ получения ацетилена.
Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500 о С.
Если процесс проводить дольше, то метан разлагается на углерод и водород:
3. Гидролиз карбида кальция
Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2.
В кислой среде образуется ацетилен и соответствующая соль:
Карбид кальция можно получить, нагревая оксид кальция с углеродом:
СаО + 3С (изб) → СаС2 + СО
4. Дегидрогалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода, реагируют с избытком спиртового раствора щелочей с образованием алкинов.
| Например, 1,2-дихлорпропан реагирует со спиртовым раствором гидроксида натрия |
1,1-дихлорпропан реагирует со спиртовым раствором щелочи с образованием пропина.
5. Алкилирование соединений алкинов с металлами
Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина.
| Например, пропинид натрия реагирует с бромэтаном с образованием пентина-2 |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник
Применение алкенов
К углеводородным соединениям класса алкенов относятся вещества, обладающие высокой реакционной способностью. Это свойство дает возможность получать из алкенов важные продукты, в которых нуждаются различные отрасли от транспорта до фармацевтической промышленности. Широкое и массовое применение алкенов является причиной постоянного роста их производства.
Получение алкеновых углеводородов
Главный источник сырья для алкенов – предельные углеводороды, выделяемые из нефти, нефтяных попутных газов и природного газа, а также их производные.
Основные способы получения алкенов в промышленности
- Высокотемпературная переработка горючих полезных ископаемых.
- Пиролиз.
Процесс пиролиза (термического разложения) высокомолекулярных алканов и циклоалканов проводится при 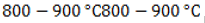
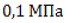
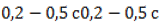
Пиролиз – распространенный способ получения наиболее востребованных алкенов – этилена и пропилена.
Отличие крекинга от пиролиза состоит в более низкой рабочей температуре процесса (450 — 550℃ 450 — 550℃) и в большей длительности, однако при этом требуется повышенное давление 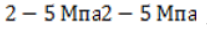
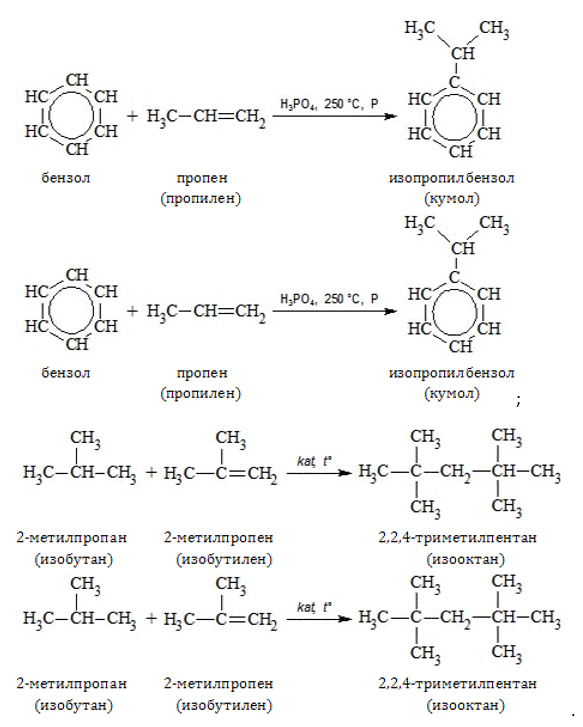
Крекингом нефти и газойля получают значительную часть бутилена, изобутилена и более высокомолекулярных алкенов.
При термической обработке каменного угля образуется коксовый газ, содержащий этилен. В ряде случаев его выделение оказывается экономически выгодным и производится в промышленных масштабах.
Нагревание алканов до 
Лабораторный синтез алкенов
Алкены получают в лаборатории с помощью таких методов, как:
Отщепление гидроксогруппы OHOH и водорода HH от молекулы спирта протекает при 150℃ и выше в присутствии сильного водопоглощающего агента, например, концентрированной серной или фосфорной кислоты:
Данный способ может применяться и для промышленного синтеза в том случае, если стоимость этанола, получаемого из сельскохозяйственного сырья, оказывается ниже, чем у нефтепродуктов.
- Дегалогенирование и дегидрогалогенирование галогенпроизводных алканов.
Если в дигалогеналкане галогенизированы атомы углерода, расположенные в молекулярной цепочке рядом, они могут быть отщеплены с образованием алкена цинком либо другим активным металлом – магнием:
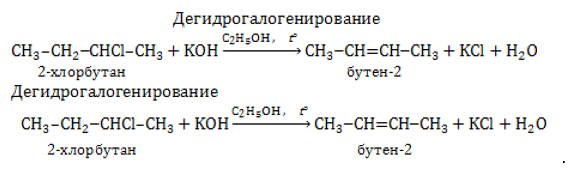
От молекулы моногалогеналкана возможно отнятие водорода и галогена щелочью, растворенной в спирте. В результате отщепления в молекуле возникает двойная связь:
Водород отщепляется от наименее гидрированного углеродного атома в молекуле галогеналкана (правило Зайцева).
В присутствии специального катализатора Линдлара алкины гидрируются до алкенов:
Полное гидрирование приводит к образованию алканов.
Области применения алкенов
В качестве химического сырья или конечного продукта алкены широко востребованы в промышленности.
Синтез полимеров
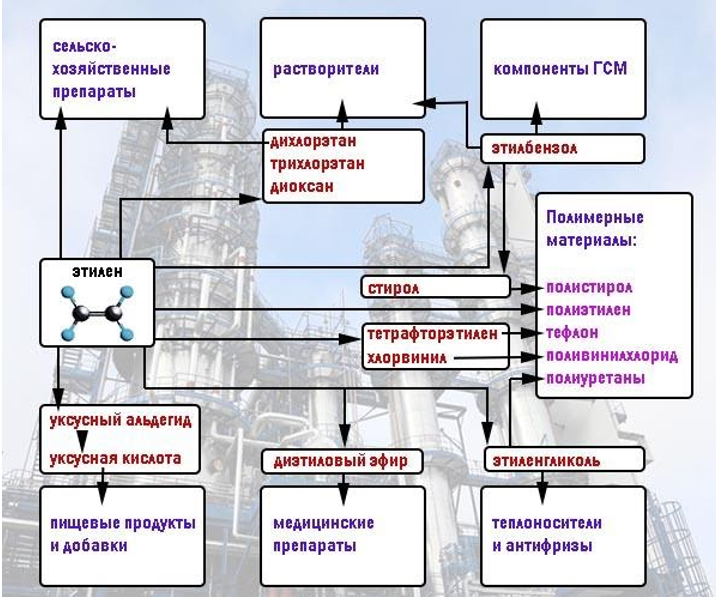
Из этилена и его производных получают полиэтилен, тефлон (политетрафторэтилен), полистирол, поливинилхлорид; из пропилена – полипропилен. Этилен и пропиленгликоли, получаемые окислением соответствующих алкенов, используются в производстве полиуретанов.
Из этилен-пропиленовых эластомеров изготавливают резины и изоляционные материалы. Бутен (бутилен) представляет собой сырье для получения изопрена, бутадиена, изобутилена, продуктами полимеризации которых являются каучуки.
Производство горюче-смазочных материалов и антифризов
В качестве добавок к бензинам применяются:
- этилбензол;
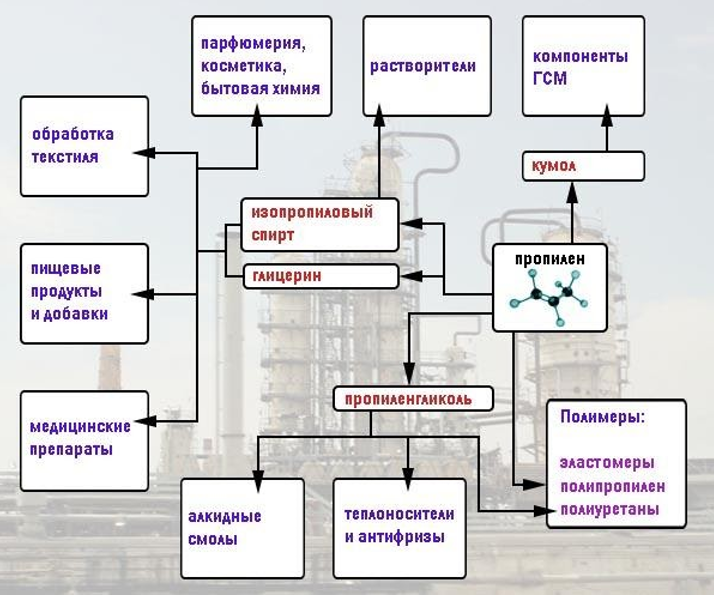
- изопропилбензол, или кумол (получают на основе пропена);
- изооктан (синтезируют с использованием бутена).
Производные этилена и изобутилена входят в состав машинных масел. Многоатомные спирты этиленгликоль и пропиленгликоль используются как основа для антифризов.
Бутилен содержится в газовых смесях для сварки и резки металлов.
Производство растворителей
Этилен служит сырьем для синтеза диоксана, дихлорэтана и трихлорэтилена – органических растворителей широкого назначения.
Другой распространенный растворитель – бутанон, или метилэтилкетон – получают из бутена.
Сельское хозяйство
Дихлорэтан применяют также для обеззараживания семян и помещений сельскохозяйственного назначения. В сельском хозяйстве используется и непосредственно этилен как растительный гормон, особенно в качестве стимулятора роста и созревания плодов.
Фармацевтическое производство
Широкое применение в медицине находят производные пропена – изопропанол и глицерин как эффективные антисептики, компоненты препаратов для лечения кожных заболеваний и растворители. Глицерин также предотвращает высыхание вязких препаратов – мазей, паст – и способствует увеличению срока их годности. Он входит в состав противоожоговых и противокашлевых средств.
Получаемый из этилена диэтиловый эфир применяется в медицинской практике как препарат для общего наркоза и местной анестезии.
Пищевая и легкая промышленность
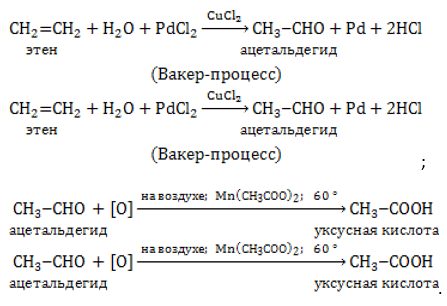
Путем окисления этилена на катализаторе получают уксусный альдегид, являющийся сырьем для производства уксусной кислоты.
Глицерин зарегистрирован в качестве эмульгатора, защитного пленкообразователя и загустителя как пищевая добавка E422. Наряду с изопропиловым спиртом входит в состав косметической и парфюмерной продукции и бытовой химии.
Текстильная промышленность также использует глицерин для обработки волокон и тканей.
Алкены состава 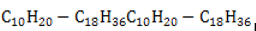
Разнообразие сфер применения алкенов и их производных можно представить в схематическом виде:
Заключение
Алкены вследствие высокой реакционной способности относятся к веществам, мало распространенным в природе. Исключение – этилен, вырабатываемый в растительных тканях. Однако большие объемы производства алкенов для удовлетворения потребностей разных отраслей превращают алкены в широко распространённый вид химического сырья.
Источник
Алкены. Получение, химические свойства и применение алкенов
Разделы: Химия
Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
- рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
- углубить и конкретизировать понятия о ?-связи, о механизмах химических реакций;
- дать первоначальные представления о реакциях полимеризации и строении полимеров;
- разобрать лабораторные и общие промышленные способы получения алкенов;
- продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO4, этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
- Какие углеводороды называются алкенами?
- Каковы особенности их строения?
- В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C8H18 ––> C4H8 + C4H10; (термический крекинг при 400-700 o С)
октан бутен бутан
– дегидрирование алканов C4H10 ––> C4H8 + H2; (t, Ni)
бутан бутен водород
– дегидрогалогенирование галогеналканов C4H9Cl + KOH ––> C4H8 + KCl + H2O;
хлорбутан гидроксид бутен хлорид вода
калия калия
– дегидрогалогенирование дигалогеналканов 
– дегидратация спиртов С2Н5ОН ––> С2Н4 + Н2О (при нагревании в присутствии концентрированной серной кислоты)
Запомните! При реакиях дегидрирования, дегидратации, дегидрогалогенирования и дегалогенирования нужно помнить, что водород преимущественно отрывается от менее гидрогенизированных атомов углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи определяет тип химических реакций, в которые вступают органические вещества. Наличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения олефинов;
– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной 

Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.
Запомни! Возможны следующие механизмы разрыва 
а) если алкены и реагент – неполярные соединения, то 
б) если алкен и реагент – полярные соединения, то разрыв 
в) при соединении по месту разрыва 
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства ( инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной серной кислоты, 1 мл спирта и небольшое количество песка.
2. Закройте пробирку пробкой с газоотводной трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с перманганатом калия. Обратите внимание на изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки. Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C2H4 + 3O2 ––> 2CO2 + 2H2O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
Запомните главное!
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что 
3. В результате присоединения происходит переход атомов углерода из sp 2 – в sp 3 — гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала
Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Источник