§ 10. Алканы
Напомним, что углеводородами называются органические вещества, молекулы которых состоят из атомов двух химических элементов — углерода и водорода. Вы уже знаете, что все углеводороды можно разделить на две группы — предельные (насыщенные, не содержат кратных связей) и непредельные (ненасыщенные, содержат кратные связи).
Важнейшим классом предельных углеводородов являются алканы.
Строение алканов
Алканы называют также парафиновыми углеводородами или парафинами (от лат. parum affinis — не обладающие сродством). Это название отражает низкую химическую активность алканов при комнатной температуре. Причина невысокой реакционной способности кроется в специфике строения молекул парафиновых углеводородов.
В молекулах алканов орбитали всех атомов углерода находятся в состоянии sр 3 -гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в вершины равносторонней треугольной пирамиды — тетраэдра. Углы между орбиталями равны 109°28′ (рис. 8).
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму. Молекулы имеют зигзагообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109°28′), например в молекуле н -пентана (рис. 9).
Все связи в молекулах алканов одинарные. Перекрывание происходит по линии, соединяющей ядра атомов, т. е. это σ -связи. Связи углерод—углерод являются неполярными и мало поляризуемыми. Длина С—С-связи в алканах равна 0,154 нм (1,54 • 10 — 10 м). Связи С—Н несколько короче. Электронная плотность лишь немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С—Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся по составу на одну или более групп СН2.
Предельные углеводороды составляют гомологический ряд метана. Названия и молекулярные формулы первых десяти гомологов приведены в таблице 3 (см. § 6).
Изомерия и номенклатура алканов
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан.
Основы номенклатуры ИЮПАК уже обсуждались. В этой части параграфа она будет более подробно рассмотрена для алканов.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является основой названия вещества.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б).
Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший заместитель (структура Г). Старшинство углеводородных заместителей определяется числом углеродных атомов. Падение старшинства, а также порядок перечисления заместителей в главной цепи соответствует ряду:
Обратите внимание, что название алкильных заместителей образуются от названия соответствующего алкана с заменой суффикса -ан на суффикс -ил .
При формировании названия вначале указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находится несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей ( ди — два, три — три, тетра — четыре, пента — пять) и название заместителя ( метил, этил, пропил ), затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана, например пропан, бутан, пентан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
структура А: 2- метил бутан;
структура Б: З- метил гексан;
структура В: 2,2,4-три метил пентан;
структура Г: 3- метил -5- этил гептан.
Получение алканов
Выделение углеводородов из природного сырья. Источниками предельных углеводородов, как вы уже знаете, являются нефть и природный газ.
Основной компонент природного газа — простейший углеводород метан, который используется непосредственно или подвергается переработке.
Нефть, извлечённая из земных недр, также подвергается переработке: ректификации, крекингу.
Природным источникам углеводородов посвящён §16 этого учебника.
Алканы можно получать и синтетическими способами как в промышленности, так и в лабораторных условиях.
Изомеризация. Линейные углеводороды при нагревании изомеризуются в углеводороды с разветвлённым скелетом. Изомеризация ускоряется при добавлении катализатора, например хлорида алюминия:
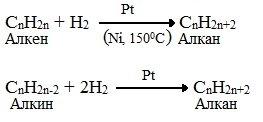
Гидрирование (присоединение водорода) алкенов. Как уже было сказано, в результате крекинга образуется большое количество непредельных углеводородов с двойной связью — алкенов. Уменьшить их количество можно, добавив в систему водород и катализаторы гидрирования — металлы (платина, палладий, никель):
Крекинг в присутствии катализаторов гидрирования с добавлением водорода называется восстановительным крекингом. Основными его продуктами являются предельные углеводороды.
В заключение добавим, что повышение давления при крекинге (крекинг высокого давления) позволяет уменьшить количество газообразных 
Получение синтетического бензина. Смесь предельных углеводородов с числом углеродных атомов от 6 до 12 можно получить пропусканием смеси оксида углерода (II) и водорода над нагретым катализатором. Эту реакцию в 1926 г. впервые осуществили немецкие учёные Ф. Фишер и Г. Тропш:
Смесь оксида углерода (II) и водорода, получившую название «синтез-газ», довольно легко можно получить пропусканием перегретого водяного пара над углем (газификация угля) или конверсией природного газа водяным паром:
Мы рассмотрели несколько промышленных способов получения алканов, которые являются основой промышленной переработки основного углеводородного сырья — нефти и природного газа.
Теперь обсудим несколько лабораторных способов получения алканов.
Источник
Получение алканов

Просмотр содержимого документа
«Получение алканов»
Тема 2. Углеводороды
Цель: изучение методы синтеза алканов и применения алканов.
Изучение нового материала.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают:
Лабораторные спосoбы получения алканов.
1. По реакции Вюрца – действием металлического натрия на галоидные алкилы:
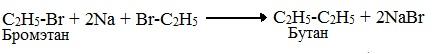
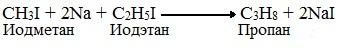
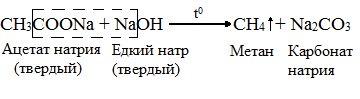
2. Сплавлением натриевых солей карбоновых кислот с едкими щелочами(Реакция Дюма):
3. Гидролиз карбида алюминия, получается метан:
АI4С3 + 12Н2О → 3СН4 + 4АI(ОН)3.
4. Гидрирование непредельных углеводородов в присутствии катализаторов.
Источник
Конструкт урока «Алканы» (по ФГОС) 10 класс
Класс: 10 (общеобразовательный)
Тема урока: «Алканы»
Место урока в системе планирования: 8 урок в I четверти, 2 урок в теме « Углеводороды »
Время проведения : 4-я неделя октября
Продолжительность урока: 40 минут
Образовательные (обучающие) технологии: использование элементов технологий ИКТ, проблемно-диалогического обучения.
Форма организации учебной деятельности: индивидуальная, фронтальная .
Тип урока: урок введения новых знаний
— Габриелян О. С., Химия 10 класс, Учебник для общеобразовательных учреждений, М. Дрофа, 2018.
— Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа, 2019.
— Контрольные и проверочные работы. Химия 10 класс к учебнику О.С.Габриеляна. М. Дрофа, 2018.
— Габриелян О.С., Остроумов И.Г. Общая химия в тестах, задачах, упражнениях. 10 класс. Учебное пособие для общеобразовательных учреждений. М. Дрофа, 2018.
Цель урока: создание условий для обеспечения результата обучения требованиям ФГОС в части развития представления о предельных углеводородах как классе органических соединений.
Обучающая: создать условия для освоения элементов содержания курса органической химии по теме «Алканы».
создать условия для развития умений устанавливать причинно-следственные связи между строением, составом и свойствами алканов;
развивать умение работать с текстом учебника, с дополнительными источниками информации, анализировать, отбирать и представлять необходимую информацию;
развивать предметную культуру речи, творческое и логическое мышление.
Воспитательная: продолжать совершенствовать экологическую культуру – безопасное обращение с углеводородами в быту; воспитывать информационную компетентность.
Интеллектуально-преобразовательная деятельность (саморазвитие и самосовершенствование личности обучающегося посредством универсальных учебных действий — УУД):
Умение оценивать экологические последствия добычи природного газа и попутных нефтяных газов.
целеполагание — ставить учебные задачи на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё не известно;
планирование — определять последовательность промежуточных целей с учётом конечного результата; составлять план и последовательность действий;
оценка – уметь оценивать результаты своей деятельности;
общеучебные — формулировать познавательные цели; применять методы информационного поиска; работать с текстами различных видов;
логические — устанавливать причинно-следственные связи ;
постановка вопросов (инициативное сотрудничество в поиске и сборе информации) – уметь формулировать вопросы;
уметь выражать свои мысли;
развивать навыки коммуникативной культуры и сотрудничества при работе в группах.
уметь давать определения понятий гомолог, гомологический ряд; находить изомеры и гомологи из числа предложенных;
описывать строение метана и его гомологов;
сотавлять структурные формулы изомеров алканов;
называть алканы по систематической номенклатуре;
применять знания о физических и химических свойствах метана;
называть способы получение алканов, химические свойства, применение алканов и их производных.
Дидактическое и техническое обеспечение урока:
Раздаточный материал к уроку:
— теоретическая часть: Слайд-лекция «Алканы». Шаростержневые модели.
ИКТ-средства обучения: мультимедийное сопровождение урока. Авторская учебная презентация «Алканы», карточки для обратной связи.
Задачи этапов урока
Учебная деятельность учащихся
Позитивный психологический настрой на урок. Соблюдение требований техники безопасности на случай ЧС.
Мотивация учащихся к учебной деятельности посредством спокойной, уверенной манеры поведения, приветливого и доброжелательного тона.
Взаимные приветствия учителя и учащихся. Отметка в классном журнале отсутствующих. Проверка подготовленности к уроку (рабочее место, рабочая поза, внешний вид), организация внимания.
(Карточки для домашней самостоятельной работы и рабочие карты урока раздаёт до начала урока).
Приготовление учащихся к работе на уроке. Концентрация внимания и мобилизация на предстоящую деятельность
Созданы условия для позитивного настроя учащихся на урок. Организовано внимание всех учащихся.
Ученики готовы к адекватному поведению на случай ЧС. Заботятся о своём здоровье.
Актуализация субъектного опыта учащихся
Готовность и осознание потребности к построению нового способа действий.
Повторение основных понятий, которые потребуются при изучении нового материала
Работа с учебной презентацией: создание условий для повторения необходимых понятий с привлечением субъектного опыта учащихся.
Обсуждает проблемную ситуацию и подводит учащихся к теме урока.
— Перед вами формулы веществ: СН 4 , С 2 Н 6 , С 3 Н 8 , С 10 Н 22 , С 12 Н 26 . Сравните их. Какие критерии для сравнения вы выберете? (Должны ответить: качественный и количественный состав).
— Если обозначить число атомов углерода буквой « n » (любое натуральное число), то чему равно количество атомов водорода Н?
После получения ответа учитель помогает учащимся сформулировать тему урока.
Учащиеся отвечают на «Контрольные вопросы» из учебной презентации. Ведут с/о своей деятельности в рабочей карте.
Сравнивают эмпирические (брутто) формулы УВ и приходят к выводу, что предложенные вещества – углеводороды (УВ) и отвечают составу С n H 2 n +2 .
Будут проявлены имеющиеся у обучающихся предметные и межпредметные (математика) учебные знания (умения), известные способы деятельности. Ученики смотивированы на изучение нового материала.
Совместное целеполагание (постановка учебной проблемы)
Выявление места и причины затруднения и постановка цели урока. Доведение её до сознания учащихся. Показ практической значимости темы урока.
Ставит перед учащимися учебные проблемы: «Почему УВ бывают в разных агрегатных состояниях? Чем это обусловлено? Можно ли, опираясь на свойства алканов, доказать их практическую значимость? » Предлагает учащимися составить план изучения класса алканов.
Учащиеся вместе с учителем формулируют учебные цели данного урока, делают вывод о практической значимости изучаемой темы. Намечают план изучения нового материала.
Созданы условия для активной познавательной деятельности учащихся на последующих этапах урока, эффективности восприятия и осмысления нового материала, понимания учащимися практической значимости изучаемого материала. Ученики научатся ставить цели урока и планировать основные этапы изучения темы.
Открытие нового знания
Организация работы с учебной презентацией, раздаточным материалом (карточки)
Концентрирует внимание учащихся на пунктах плана изучения темы и составления конспекта урока, необходимости ответить на вопросы в конце урока после изучения темы.
Проводит демонстрационный эксперимент.
Совершенствуют навыки умственной деятельности при работе с учебной презентацией. Развивают учебно-познавательную мотивацию.
Ученики получат возможность усвоить новые знания посредством созданных учителем условий (использование компьютерной техники, раздаточных материалов). Готовы давать правильные ответы на последующих этапах урока.
Первичное закрепление знаний
Организация работы учащихся по закреплению знаний.
Учитель организует фронтальный опрос по ключевым вопросам темы; по ходу проверки учитель добивается устранения пробелов в понимании учащимися нового материала.
Ученики анализируют вопросы учителя и ответы учащихся.
Ученики научатся организовывать и контролировать свою учебную деятельность.
Развивать самостоятельность, волю и ответственность, навыки анализа выполняемых работ, вычленение проблем.
Этап самостоятельной работы
Рефлексия достижения цели
Создает ситуацию, связанную с приятными эмоциями, чувством удовлетворения от работы, ощущением собственной компетентности, самоуважения:
предлагает выполнить самостоятельную работу по карточкам.
Отвечают на вопросы (карточка), предложенные учителем в начале урока.
Рефлексия способности организовывать собственную деятельность и прогнозировать. Накопляемость оценок.
Информация о домашнем задании
Обеспечение понимания цели, содержания и способов выполнения заданий дома. Работа с дополнительной литературой.
Объясняет, как выполнить домашнее задание (слайд презентации).
Записывают задания в дневник. Задают вопросы по содержанию домашнего задания.
Созданы условия для активной познавательной деятельности учащихся при выполнении домашнего задания. Ученики приобретут опыт работы с различными источниками информации, разовьют умение создавать сообщения на заданные темы.
Источник