АКРИЛОВАЯ КИСЛОТА
Простейшая ненасыщенная карбоновая кислота, способная к полимеризации.
Представляет собой бесцветную жидкость с резким запахом, вызывает раздражение кожи, глаз и слизистой оболочки. Акриловая кислота хорошо растворяется в воде, спирте, эфире, кипит при температуре 140 °С. Образует соли, хлорангидриды, ангидриды, сложные эфиры, амиды.
Методы получения акриловой кислоты: парофазное окисление пропилена кислородом воздуха на висмутовых, кобальтовых или молибденовах катализаторах через стадию образования акролеина; гидрокарбоксилирование ацетилена; окисление акролеина кислородом воздуха с помощью ванадиевых кислот и т. д.
Некоторые соли акриловой кислоты входят в полимерный состав для крепления грунтов. Акриловая кислота и ее эфиры используют для получения полимерных материалов, в производстве полиакриловой кислоты, ионообменных смол, каучуков.
Кроме того, акриловые эфиры применяют для получения полимерных эмульсий, востребованных в кожевенной и текстильной промышленности, в производстве бумаги. В лакокрасочной промышленности акриловые эмульсии необходимы для приготовления водорастворимых красок.
Также акриловая кислота широко применяется в производстве небьющегося стекла, в электропромышленности, в производстве пластмасс.
При хранении акриловой кислоты необходимо соблюдение температуры помещения в интервале от 20 °С до 30 °С для предотвращения полимеризации и замерзания.
На данный момент нет содержимого, классифицированного этим термином.
Источник
Акриловая кислота
| Акриловая кислота | |
 | |
 | |
| Общие | |
|---|---|
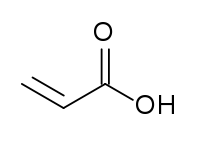
| Химическая формула | СН2=СН–СООН |
| Эмпирическая формула | C3H4O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 72,06 г/моль |
| Плотность | 1.051 г/см³ |
| Термические свойства | |
| Температура плавления | 13 °C |
| Температура кипения | 141 °C |
| Температура вспышки | 68 °C |
| Энтальпия образования (ст. усл.) | -384,09 кДж/моль |
| Удельная теплота испарения | 37,24 Дж/кг |
| Удельная теплота плавления | 11,16 Дж/кг |
| Химические свойства | |
| pKa | 4.25 |
| Растворимость в воде | смешивается г/100 мл |
| Классификация | |
| Рег. номер CAS | 79-10-7 |
| SMILES | C=CC(=O)O |
| Безопасность | |
| Токсичность | сильный ирритант |
Акриловая кислота (пропеновая кислота, этенкарбоновая кислота) СН2=СН-СООН — простейший представитель одноосновных непредельных карбоновых кислот. Бесцветная жидкость с резким запахом, растворима в воде, диэтиловом эфире, этаноле, хлороформе. Легко полимеризуется с образованием полиакриловой кислоты. С другими мономерами образует сополимеры.
Содержание
Синтез
Сейчас применяют парофазное окисление пропилена кислородом воздуха на висмутовых, кобальтовых или молибденовых катализаторах.
Раньше использовалась реакция взаимодействия ацетилена, оксида углерода (II) и воды:
Компанией Rohm and Haas разрабатывается технология синтеза акриловой кислоты из пропана.
Химические свойства
Акриловая кислота образует соли, хлорангидрид, ангидриды, сложные эфиры, амиды и пр. Она вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы натрия в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd в пропионовую кислоту. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещенных производных. Как диенофил акриловая кислота участвует в диеновом синтезе. Конденсируется с солями арилдиазония (реакция Меервейна):
При УФ-облучении или в кислых водных растворах (рН=1), а также в присутствии инициаторов полимеризации образует полиакриловую кислоту ([—СН2—СН(СООН)—]n).
Применение
Для предотвращения полимеризации при хранении добавляют ингибитор-гидрохинон. Перед использованием перегоняют с особой осторожностью — возможна взрывоподобная полимеризация.
Акриловая кислота и ее производные используются при производстве акриловых эмульсий для лакокрасочных материалов, пропитки тканей и кожи, в качестве сырья для полиакрилонитрильных волокон и акрилатных каучуков, строительных смесей и клеев. Значительная часть акриловой кислоты используется также при производстве суперабсорбентов. В производстве полимеров широко применяют сложные эфиры акриловой и метакриловой кислот, главным образом метиловые эфиры: метилакрилат и метилметакрилат.
Безопасность
Акриловая кислота сильно раздражает кожные покровы. Раздражает слизистую оболочку глаз (порог раздражающего действия 0,04 мг/л). При попадании в глаза вызывает сильные ожоги роговицы глаза и может вызвать необратимые повреждения. Вдыхание паров может вызвать раздражение дыхательных путей, головную боль, при больших концентрациях или экспозиции — отёк лёгких. Хотя наличие запаха ещё не означает какой либо угрозы здоровью, необходим мониторинг воздуха. ПДК 5 мг/м³
Примечания
- Kirk-Othmer encyclopedia, 3 ed., v. I, N.Y.-[a.o.], 1978, p. 330-54. А. В. Девекки.
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 121
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Акриловая кислота» в других словарях:
АКРИЛОВАЯ КИСЛОТА — CH2=CHCOOH, бесцветная жидкость с острым запахом, tкип 141 .C. Используют для получения полиакриловой кислоты и различных сополимеров, акрилатов … Большой Энциклопедический словарь
акриловая кислота — CH2 = HCHCOOH, бесцветная жидкость с острым запахом, tкип 141ºC. Используют для получения полиакриловой кислоты и различных сополимеров, акрилатов. * * * АКРИЛОВАЯ КИСЛОТА АКРИЛОВАЯ КИСЛОТА, CH2=CHCOOH, бесцветная жидкость с острым запахом, tкип… … Энциклопедический словарь
акриловая кислота — akrilo rūgštis statusas T sritis chemija formulė CH₂=CHCOOH atitikmenys: angl. acrylic acid rus. акриловая кислота ryšiai: sinonimas – propeno rūgštis … Chemijos terminų aiškinamasis žodynas
Акриловая кислота — органическая кислота CH2=CHCOOH; бесцветная жидкость с острым запахом; tкип 141 С° плотность 1049 кг/м3 во всех отношениях смешивается с водой, спиртом и эфиром. В промышленности её получают из ацетилена: C2H2 + CO + H20 = С2НзСООН, а… … Большая советская энциклопедия
АКРИЛОВАЯ КИСЛОТА — СН2=СНСООН, ненасыщенная карбоновая кислота, бесцв. жидкость с острым запахом, tкип 141 °С. Используют для получения полиакриловой кислоты и разл. сополимеров, акрилатов … Естествознание. Энциклопедический словарь
акриловая кислота — органическое соединение алифатического ряда; бесцветная жидкость; получают синтетически; большое практическое значение имеют соли и эфиры акриловой кислоты акрилаты. Новый словарь иностранных слов. by EdwART, , 2009 … Словарь иностранных слов русского языка
Акриловая кислота — см. Акролеин … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АКРИЛОВАЯ КИСЛОТА — (пропеновая к та, этиленкарбоновая к та) СН 2=СНСООН, мол. м. 72,06; бесцв. жидкость с резким запахом; т. пл. 12 13,5 … Химическая энциклопедия
АКРИЛОВАЯ КИСЛОТА — СН2 = СНСООН бесцветная жидкость с острым запахом; tкип 141 оС. Эфиры А. к. (акрилаты) сырьё в произ ве полиакрилатов … Большой энциклопедический политехнический словарь
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
Источник
Получение акриловой кислоты различными способами
Существует семь промышленных методов получения акриловой кислоты и акрилатов. Если более старые методы базируются в основном на ацетилене, то в будущем решающую роль будут играть процессы, где исходным продуктом является пропилен.
До сих пор важнейшим остается метод, основанный на работах Реппе о присоединении СО и воды или спиртов к ацетилену при каталитическом воздействии Ni(C0)4. Синтез акрилатов протекает при 35—45 °С под давлением стехиометрически по уравнению:
4C2H2 + 4ROH + Ni(CO)4+2HCl ———— ► 4CH2=CH-COOR + №С12 + Н2
Образующийся NiCl2 снова превращается в Ni(C0)4 (метод-фирмы Rohm und Haas Co.).
Процесс фирмы Dow Badische Chemical Co., освоенный с 1960 г., также базируется на трудах Реппе. Ацетилен реагирует с СО и Н20 при 220 °С и давлений 100 кгс/см2 в тетрагидрофуране в присутствии растворимых соединений никеля и дает акриловую кислоту, которая впоследствии зтерифицируется [13].
На фирме Celanese Corp. в 1958 г. внедрен разработанный фирмой В. F. Goodrich Со. метод, основанный на кетене [14—21]. Кетен, получаемый пиролизом уксусной кислоты или ацетона, превращается в p-пропиолактон при 10—20 °С в растворителе, например диалкиловом эфире, в присутствии А1С13 или других катализаторов Льюиса:
P-Пропиолактон переводится в акриловую кислоту в газовой фазе в присутствии фосфорной кислоты при 150—180 °С [22]. Акриловую кислоту можно получать также при 150 °С путем термической деполимеризации поли-р-пропиолактана [23—24], который образуется при длительном хранении р-пропиолактона (полимеризация последнего ускоряется кислотами, основаниями или солями).
Предложен новый усовершенствованный способ прямого получения акрилатов [25, 26]. Кетен взаимодействует при 70—110 °С с метилалем с образованием метилового эфира 3-метоксипропионовой кислоты в присутствии BF3, TiF4, HPF6, BF3-2(С2Н5)20 и других катализаторов. В результате пиролиза этого сложного эфира при 190—220 °С в присутствии кислоты выделяется метилакрилат [27, 28].
Процесс фирмы Union Carbide Corp. основывается на окиси этилена, которая превращается в этиленциангидрин либо при температурах выше 90 °С без катализатора [29], либо при 55—60 °С в присутствии NaOH, CaO, MgC03[30], цианидов щелочноземельных металлов или третичных аминов [31 ]. Этиленциангидрин реагирует при 150 °С с 75 —80%-ной серной кислотой и спиртами и дает акрилати [17, 32-33]:
HOCH2CH2CN+roh+H2SO4 j—> ch2=chc00r+nh4hs04
Фирма Diamond Alkali Co. предложила метод прямого присоединения СО к окиси этилена с образованием акриловой кислоты нри 120—250 °С и давлении 200—500 кгс/см2 в присутствии Со2(СО)8 [34];
Для фирм, производящих акрилонитрил, интерес представляет метод его окисления при 110 °С [35—37]:
H2c=chcn+h2s04+h20 —v h2c=chconh2-h2s04 h2c=chconh2 ■ h2s04+ roh —^ ch2=chcoor + nh4hso4
По этому или подобному методу работают французская фирма Ugilor SA, японские фирмы Tokai Gas and Chemical Co. и Toyo Koatsu Industries Ltd. (опытная установка), американская фирма Sohio Chemical Co. (опытная установка).
До сих пор не внедрены в промышленность следующие методы получения акрилатов: альдольная конденсация формальдегида с уксусной кислотой в паровой фазе на катализаторах из цеолита Са при 375—385 °С [38—39]; взаимодействие формальдегида, спиртов и уксусной кислоты [40]; реакция формальдегида и эфиров в присутствии солей щелочных металлов карбоновых кислот [41], метабора — тов Na или К [42] и цеолитов [43].
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |






