2-метилгексан — 2-Methylhexane
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC |
- 591-76-4
Y
- 11094
Y
- YI4679P2SP
N




 N проверить ( что есть ?)
N проверить ( что есть ?)  Y
Y  N
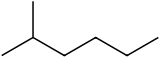
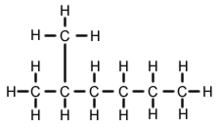
N2-метилгексан ( С 7 Н 16 , также известный как изогептан , ethylisobutylmethane ) представляет собой изомер из гептана . По своей структуре это молекула гексана с метильной группой, присоединенной ко второму атому углерода. Он присутствует в большинстве коммерчески доступных товаров с гептаном в качестве примеси, но обычно не рассматривается как примесь с точки зрения реакций, поскольку имеет очень похожие физические и химические свойства по сравнению с н-гептаном (гептаном с прямой цепью).
Как алкан, 2-метилгексан нерастворим в воде , но растворим во многих органических растворителях, таких как спирты и эфир . Однако 2-метилгексан чаще рассматривается как сам растворитель . Поэтому, даже если он присутствует во многих коммерчески доступных гептановых продуктах, он не считается деструктивной примесью, поскольку гептан обычно используется в качестве растворителя. Тем не менее, с помощью кратких способов дистилляции и очистки можно отделить 2-метилгексан от н-гептана.
Внутри группы изомеров изомеры с большим количеством ответвлений имеют тенденцию легче воспламеняться и сгорать более полно. Таким образом, 2-метилгексан имеет более низкую самовоспламенения температуру и температуру вспышки , по сравнению с гептана. Теоретически 2-метилгексан также горит с менее насыщенным сажей пламенем, испуская более высокочастотное излучение; однако, поскольку гептан и 2-метилгексан отличаются только одним атомом углерода с точки зрения разветвления, оба горят ярко-желтым пламенем при воспламенении.
По сравнению с н-гептаном, 2-метилгексан также имеет более низкие температуры плавления и кипения . У 2-метилгексана более низкая плотность жидкости, чем у гептана.
По шкале NFPA 704 2-метилгексан указан как химическое вещество с нулевым уровнем реакционной способности, наряду с различными другими алканами . Фактически, большинство алканов не реагируют, за исключением экстремальных условий, таких как горение или сильный солнечный свет . В присутствии кислорода и пламени 2-метилгексан, как и гептан, в основном полностью сгорает до воды и углекислого газа . При использовании УФ-света и смешивании с галогенами в растворителях, обычно с бромом в 1,1,1-трихлорэтане , происходит реакция замещения .
Источник
2-метилгексан — 2-Methylhexane
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC |
- 591-76-4
Y
- 11094
Y
- YI4679P2SP
N




 N проверить ( что есть ?)
N проверить ( что есть ?)  Y
Y  N
N2-метилгексан ( С 7 Н 16 , также известный как изогептан , ethylisobutylmethane ) представляет собой изомер из гептана . По своей структуре это молекула гексана с метильной группой, присоединенной ко второму атому углерода. Он присутствует в большинстве коммерчески доступных товаров с гептаном в качестве примеси, но обычно не рассматривается как примесь с точки зрения реакций, поскольку имеет очень похожие физические и химические свойства по сравнению с н-гептаном (гептаном с прямой цепью).
Как алкан, 2-метилгексан нерастворим в воде , но растворим во многих органических растворителях, таких как спирты и эфир . Однако 2-метилгексан чаще рассматривается как сам растворитель . Поэтому, даже если он присутствует во многих коммерчески доступных гептановых продуктах, он не считается деструктивной примесью, поскольку гептан обычно используется в качестве растворителя. Тем не менее, с помощью кратких способов дистилляции и очистки можно отделить 2-метилгексан от н-гептана.
Внутри группы изомеров изомеры с большим количеством ответвлений имеют тенденцию легче воспламеняться и сгорать более полно. Таким образом, 2-метилгексан имеет более низкую самовоспламенения температуру и температуру вспышки , по сравнению с гептана. Теоретически 2-метилгексан также горит с менее насыщенным сажей пламенем, испуская более высокочастотное излучение; однако, поскольку гептан и 2-метилгексан отличаются только одним атомом углерода с точки зрения разветвления, оба горят ярко-желтым пламенем при воспламенении.
По сравнению с н-гептаном, 2-метилгексан также имеет более низкие температуры плавления и кипения . У 2-метилгексана более низкая плотность жидкости, чем у гептана.
По шкале NFPA 704 2-метилгексан указан как химическое вещество с нулевым уровнем реакционной способности, наряду с различными другими алканами . Фактически, большинство алканов не реагируют, за исключением экстремальных условий, таких как горение или сильный солнечный свет . В присутствии кислорода и пламени 2-метилгексан, как и гептан, в основном полностью сгорает до воды и углекислого газа . При использовании УФ-света и смешивании с галогенами в растворителях, обычно с бромом в 1,1,1-трихлорэтане , происходит реакция замещения .
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |







