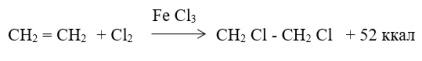
Способ получения 1,2-дихлорэтана
Использование: сырье крупнотоннажных мономеров-винилхлорида, 1-2-дихлорэтан является растворителем с широким спектром свойств и сырьем для получения других хлорсодержащих растворителей (трихлорэтилена, перхлорэтилена и др. ). Сущность: процесс ведут хлорированием этилена хлором в среде жидкого 1,2-дихлорэтана при температуре от 20 град. С до температуры кипения реакционной массы (84 град С и выше) в присутствии комплексных катализаторов в количестве 0,1-2,0 мас.%. В качестве катализаторов используют тройные каталитические системы, включающие комплексы галогенидов металлов таких FeCl2, FeCl3, SnCl4, SbCl5 с азотсодержащими донорами, такими как гексаметилфосфортриамид, пиридин и ингибиторы радикальных реакций-2,6-ди-трет-бутил-4 метил-фенол, n-нитрофенол, 2,2-ди(n-оксифенил)пропан. 2 табл.
Изобретение относится к способу получения 1,2-дихлорэтана (ДХЭ), используемого как сырье для одного из самых важных крупнотоннажных мономеров — винилхлорида, используемого для производства полимеров и сополимеров, ДХЭ является также растворителем с широким спектром свойств и сырьем для получения других хлорсодержащих растворителей (трихлорэтилена, перхлорэтилена и др.).
Известны способы получения ДХЭ хлорированием этилена в среде ДХЭ при температурах 20 64 o C в присутствии хлорного железа в качестве катализатора (патент ФРГ N 2540291, публ. 1977; N 31448450, публ. 1983; патент США N 4072728, публ. 1978).
Селективность процесса по ДХЭ в указанных условиях составляет 98 99% Основными недостатками этих способов являются: необходимость очистки ДХЭ-сырца от катализатора и связанных с этим сточных вод; значительные потери этилена с абгазами, поскольку процесс ведут при соотношении хлор:этилен 1:1,1 1,2.
Известны способы получения ДХЭ хлорированием этилена хлором в среде кипящего ДХЭ в присутствии 0,06 0,60% безводного хлорного железа (патенты США N 2929852, публ. 1960, N 4172099, публ. 1979; заявка ФРГ N 3137513, публ. 1975). Селективность процесса по ДХЭ в этих методах хлорирования составляет 97% Основными недостатками этих способов получения ДХЭ являются: быстрое накопление высокохлорированных соединений и олигомеров (осмолов) в реакционной массе, что вызывает дезактивацию катализатора и перерасход сырья; необходимость частного обновления реакционной массы в реакторе хлорирования из-за накопления в ней катализатора, осмолов и высокохлорированных продуктов.
Из известных способов наиболее близким к предлагаемому нами является способ получения ДХЭ взаимодействием этилена и хлора при повышенной температуре (40 150 o C) при атмосферном давлении или под давление 1,3 — 1,5 ат в присутствии катализатора безводного тетрахлорферрата щелочного или щелочно-земельного металла, или аммония или смесь хлорида железа (III) и соли щелочного или щелочно-земельного металла, или аммония, а так же ингибитора — кислорода воздуха (патент СССР N 1277887).
Предлагаемое изобретение направлено на увеличение длительности работы каталитических систем при высокой селективности процесса хлорирования этилена до 1,2-дихлорэтана.
В качестве катализатора предлагаем использовать комплексные системы, включающие галогениды металлов FeCl2, FeCl3, SnCl4, SbCl5 и азотсодержащие электронодонорные соединения: гексаметилфосфортриамид (ГМФП), пиридин (Ру), а также соединения, ингибирующие радикальные реакции: 2,2-ди-(n-оксифенил)-пропан (ДФП); 2,6-дитретбутил-4-метил-фенол (ионол); n-нитрофенол (НФ).
Об эффективности используемых комплексных каталитических систем при получении ДХЭ хлорированием этилена судили по следующим показателям: содержание (мас.) целевого продукта и продуктов побочного хлорирования в выходящем из реактора ДХЭ-сырце без предварительной очистки; сроку действия катализатора; расходу катализатора на единицу (кг) получаемого ДХЭ.
Хлорирование этилена проводили на лабораторных установках, включающих систему осушки хлора, подаваемого из баллона, реактор хлорирования и систему улавливания абгазов.
Для исключения возможного накопления и каталитического влияния хлорного железа, легко генерируемого в присутствии хлора стальными реакторами в опытах применялись реакторы хлорирования из свинца и стекла.
Хлорирование этилена проводили при температуре кипения ДХЭ (84,5 o C) и температурах 20, 45 o C также в среде ДХЭ. Для хлорирования этилена при температуре кипения ДХЭ применяли реактор барботажного типа, изготовленный из свинца (Н=800 мм, d=70 мм), снабженный конденсатором и «рубашкой» для обогрева. В реактор загружали свежеперегнанный ДХЭ с содержанием не менее 99,9% и комплексную каталитическую систему 0,1 2,0 мас. Затем ДХЭ нагревали до 60 o C и подавали хлор 12,0 л/ч и этилен 12,5 л/ч. За счет тепла реакции температура в реакторе поднимается до температуры кипения ДХЭ. Пары ДХЭ из реактора поступают для охлаждения и конденсации в конденсатор, из которого часть ДХЭ возвращается в реактор, а часть отбирается непрерывно с такой скоростью, чтобы обеспечить постоянный уровень жидкой фазы в реакторе. Содержание ДХЭ и примесей в отбираемом продукте и реакционной массе определяли ГЖХ-анализом.
Для хлорирования этилена при 20 и 45 o C применяли стеклянный реактор (V= 1000 мл). В нижнюю часть реактора через барботеры подавали этилен и хлор с расходами 7,5 и 7,0 л/ч, соответственно. Полученный ДХЭ-сырец непрерывно отводится в приемник. После отгонки ДХЭ кубовый остаток, содержащий каталитическую систему, возвращали в реактор синтеза ДХЭ для поддержания исходной концентрации катализатора. В результате опытов установлено, что используемая каталитическая система стабильна и не теряет активности при рецикле (более 10 раз).
Далее приводим примеры хлорирования этилена в присутствии предлагаемых каталитических систем.
Пример 1. Хлорирование этилена в присутствии каталитической системы (дихлорид железа, ГМФТ, ДФП) 2 мас. при температуре 84 o C.
В реактор загружают 1000 г ДХЭ (99,9%), 4,5 г дихлорид железа, 5,85 г ГМФТ и 10,0 г ДФП. Хлор и этилен подают с расходами 12,0 и 12,5 л/ч, соответственно. Длительность опта 450 ч. За это время получили 23770 г продукта с содержанием ДХЭ 99,9% (трихлорэтана 0,10%). В конце опыта содержание ДХЭ в отбираемом продукте составило 99,85 мас. (трихлорэтана — 0,15%).
Аналогично проводят процесс хлорирования этилена в примерах 2 23. Условия и результаты опытов приведены в табл. 1.
Пример 24. В стеклянный реактор (V=1000 мл), снабженный мешалкой, барботерами хлора и этилена, загружают 800 г ДХЭ (99,9%) и 3,8 г комплекса трихлорида железа с гексаметилфосфортриамидом и 4,0 г ДФП. Хлор и этилен подают с расходами 7,0 и 7,5 л/ч, соответственно. Температуру в реакторе поддерживают 45 o C. Образующийся ДХЭ через боковой отвод в реакторе сливают в приемник. Полученный продукт в количестве 500 мл подвергают разгонке, при этом куб разгонки, содержащий катализатор, возвращают в реактор хлорирования. За время опыта (400 ч) наработано 12370 г продукта с содержанием ДХЭ 99,95% (трихлорэтана 0,05%).
Аналогично ведут процесс хлорирования этилена в примерах 25 35. Условия и результаты опытов приведены в табл. 2.
Способ получения 1,2-дихлорэтана хлорированием этилена хлором в среде жидкого 1,2-дихлорэтана при температуре от 20 o С до температуры кипения реакционной массы в присутствии металлокомплексного катализатора в количестве 0,1 2,0 мас. и ингибитора радикальных реакций, отличающийся тем, что в качестве катализатора используют комплекс галогенида металла, выбранного из группы FeCl2, FeCl3, SnCl4, SbCl5, с азотсодержащим соединением, выбранным из группы гексаметилфосфортриамид, пиридин, а в качестве ингибитора радикальных реакций используют 2,2-ди-(n-оксифенил)-пропан, 2,6-ди-третбутил-4-метилфенол, n-нитрофенол.
Источник
Информация о способах получения



Московский Технологический Университет
ИТХТ имени М. В. Ломоносова
Кафедра Общей химической технологии
Курсовая работа
«Производство 1,2-дихлорэтана (ДХЭ)»
Студентка: Машкова А.А,
Преподаватель: Брук Л.Г.
Введение
Задача заключается в разработке технологического процесса производства 1,2-дихлорэтана окислительным хлорированием этилена.
В процессах заместительного хлорирования и расщепления хлорпроизводных всегда образуется HCI, который утилизируют в виде соляной кислоты или иногда применяют для гидрохлорирования. Но эти пути утилизации HCI ограничены, в частности из-за недостаточной чистоты получаемой соляной кислоты и превращения ее общего производства над потреблением. Поэтому задача более полного использования хлора, замены его на HCI или устранения побочного образования HCI становилось все более важной для экономики хлорорганических производств. Она решается за счет окислительного хлорирования (или оксихлорирования).
Объединение стадий хлорирования и оксихлорирования позволяет создавать сбалансированные по хлору производства.
Дихлорэтан используется в качестве растворителя в самых различных областях: для экстрагирования жиров, для обезжиривания шерсти, мехов, для очистки нефтепродуктов от парафина, а также металлических изделий перед хромированием или никелированием, для извлечения восков (монтан-воск) из бурых углей. Его также используют в качестве инсектицида для обеззараживания зерна,зернохранилищ и почвы виноградников.
Гидролизом дихлорэтана получают этиленгликоль, а поликонденсацией с полисульфидом натрия — каучуки специального назначения (тиоколы). Он является также полупродуктом для многих промышленных синтезов. Значительные количества дихлорэтана расходуются на получение хлористого винила, важного исходного соединения для синтеза полимерных материалов, в частности — поливинилхлорида.
Области применения дихлорэтана весьма разнообразны. Самым крупным потребителем его является химическая промышленность, на долю которой приходится около 80% общего потребления этого продукта в нашей стране.
Каждый год в США, Европе и Японии производится более 17,5 млн. тонн 1,2-дихлорэтана. В настоящее время свыше 90% производимого 1,2-дихлорэтана перерабатывается в винилхлорид. (Данные на 2014г.)
1,2-дихлорэтан — хлорорганическое соединение, прозрачная бесцветная жидкость с сильным запахом, напоминающий хлороформ, со сладковатым привкусом. Вещество практически не растворяется в воде, но хорошо растворяется в большинстве органических растворителях, липидах, само также является хорошим растворителем для многих органических веществ. Легко испаряется.Физические свойства вещества: плотность 1,253 г/см 2 ; молярная масса 98,96 г/моль; температура плавления –35°C; температура кипения +83,5–84,0 °C. Стоек к действию кислот и щелочей.
Необходимо учитывать, что1,2-дихлорэтан (ДХЭ)является сильным наркотическим веществом, оказывающим на человека канцерогенное действие. Пары 1,2-дихлорэтана проникают в организм через дыхательные пути. Этот препарат в жидком состоянии может проникать в организм через неповрежденную кожу. В нашей стране отравления ДХЭ (одно из наиболее тяжелых) в течение последних нескольких лет составляют около 5 % общего числа отравлений, причем только 3 % из них ингаляционные. Среди пострадавших преобладают мужчины, употребляющие ДХЭ с целью опьянения (внешнее сходство препарата со спиртом). Больничная летальность при данной патологии составляет около 50 %.
Информация о способах получения
Существуют несколько способов получения дихлорэтана из этилена:
1) взаимодействие этилена с хлором в среде жидкого дихлорэтана при 20—30° С;
2) пропускание этилена через жидкий хлор при повышенном давлении и температуре не выше 0° С;
3) взаимодействие этена с хлором при повышенных температурах (до 120° С) над различными катализаторами (CuCl2, FeCl3, SbCl5, уголь и др.);
4) взаимодействие этилена, хлористого водорода и кислорода воздуха над медным катализатором при 300°С:
Источник
Совершенствование процесса получения 1,2-дихлорэтана в производстве винилхлорида
Дата публикации: 01.05.2021 2021-05-01
Статья просмотрена: 48 раз
Библиографическое описание:
Кумова, К. В. Совершенствование процесса получения 1,2-дихлорэтана в производстве винилхлорида / К. В. Кумова. — Текст : непосредственный // Молодой ученый. — 2021. — № 18 (360). — С. 8-10. — URL: https://moluch.ru/archive/360/80669/ (дата обращения: 20.11.2021).
В статье описывается реализованный в промышленности процесс получения 1,2-дихлорэтана (ДХЭ). Выявлены достоинства и недостатки процесса производства ДХЭ. В статье предложен способ совершенствования синтеза 1,2-дихлорэтана.
Ключевые слова: 1,2-дихлорэтан, хлорирование этилена, ацетилен.
Дихлорэтан находит широкое применение в различных областях промышленности как растворитель: для очистки нефтепродуктов от парафинов, для экстрагирования жиров, для обезжиривания шерсти, мехов, а также для очистки металлических изделий перед хромированием или никелированием. Производство дихлорэтана является одним из важнейших этапов в производственной цепи получения полимеров. [1] Значительные количества дихлорэтана расходуются на получение хлористого винила.
Получение 1,2 — дихлорэтана методом прямого хлорирования этилена основано на реакции взаимодействия испаренного хлора и этилена в жидкой фазе при температуре 85°С. Процесс непрерывный. Реакция протекает очень быстро. Для подавления побочных реакций используют ингибирующее действие кислорода и катализаторы. Широкое применение в качестве катализатора данного процесса получила апротонная кислота FеС13. Соотношение органического реагента и хлора близко к стехиометрическому. Небольшой избыток этилена необходим для обеспечения полного вступления хлора в реакцию [1].
Реакция протекает в присутствии катализатора — безводного хлорида железа по следующей схеме:
При осуществлении процесса хлорирования этилена в слое жидкого
дихлорэтана из-за присутствия в газах пиролиза углеводородного сырья таких компонентов, как остаточный винилхлорид, пропилен,а так же влаги возможно протекание побочных реакций:
Образование большого количества трихлорэтана вызывает не только потери этилена и хлора, но и приводит к потере щелочи на стадии очистки горючего газа.
Безводный хлорид железа благоприятствует протеканию процесса в необходимом направлении и препятствует протеканию реакции хлорирования этилена до трихлорэтана. Массовая доля хлорного железа в реакционной массе должна быть 0,6–1,2 %. Присутствие влажного хлорного железа резко увеличивает выход трихлорэтана и хлористого водорода, что приводит к порче оборудования в результате сильной коррозии.
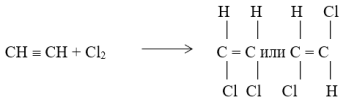
- При существующих условиях 5‑7 % ацетилена вступает в реакцию с образованием цис‑ или транс — дихлорэтилена:
- Половина всего винилхлорида, содержащегося в газах, вступает в реакцию с образованием трихлорэтана:
- Пропилен при данных условиях легче этилена вступает в реакцию хлорирования с образованием дихлорпропана:
- Высшие ацетилены и диолефины также легко хлорируются.
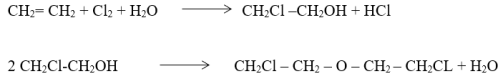
- Присутствие воды в системе крайне нежелательно, так как вода приводит к образованию примесей с выделением хлористого водорода, потере этилена, хлора и катализатора, вызывает усиленную коррозию оборудования. Кроме того, она приводит к образованию побочных продуктов: этиленхлоргидрида и ,`‑дихлор-этилового эфира, снижающих качество дихлорэтана.
Остальные примеси, содержащиеся в пирогазе, в условиях данного процесса в реакцию хлорирования не вступают и не мешают протеканию основной реакции.
В результате проведенного анализа способа получения 1,2 — дихлорэтана, реализованного на промышленном аналоге, можно сделать вывод о наличии достоинств и недостатков подсистем:
Достоинством высокотемпературного процесса является экономичность: выделяющееся тепло расходуется на испарение и ректификацию продуктов, оборотные воды отсутствуют, расход катализатора минимален, а недостатком процесса является низкая селективность, связанная с увеличением скорости побочных реакций при росте температуры, побочные продукты — трихлорэтан, трихлорэтилен и другие высшие хлор-производные этана — образуются в реакторе в результате реакций замести-тельного хлорирования 1,2-дихлорэтана в жидкой фазе [1].
Жидкофазное хлорирование этилена имеет следующие основные недостатки:
- Интенсивное образование в зоне реакции повышенного количества экологически вредных побочных продуктов реакции высококипящих соединений и прежде всего трихлорэтана (до 1–3 %). Причина их образования заключается в недостаточно активном теплосъеме в зоне реакции, обусловленном малой по расходу интенсивностью циркуляции дихлорэтана через зону реакции, малым перепадом температур дихлорэтана между нижней и верхней границами зоны реакции, а также неравномерностью перемешивания и распределения хлора и этилена по сечению восходящего потока реакционной среды. В связи с этим температура нагрева дихлорэтана поднимается выше его температуры кипения, вследствие чего в парогазовой фазе резко возрастает скорость реакции синтеза высококипящих соединений.
- Образование повышенного количества высококипящих соединений снижает экономические показатели данного способа вследствие необходимых затрат на их утилизацию и уменьшения степени конверсии хлора, часть которого расходуется на синтез высококипящих соединений.
В результате патентно-информационного поиска был найден патент RU 2292945 C2, на основе которого будет предложено усовершенствование производства ДХЭ.
Таким образом, к усовершенствованию принимается метод жидкофазного хлорирования этилена, заключающееся в реконструкции основного аппарата. В качестве контактного устройства в реакторе используют два слоя металлической насадки (кольца Рашига). Сверху на насадку подают жидкий 1,2-дихлорэтан, в пространство между слоями подают газообразный хлор, а под нижний слой насадки подают крекинг-газ, что позволяет уменьшить диаметр реактора в 1,5–2 раза за счет увеличения эффективности перемешивания и создания развитой поверхности контакта фаз. Температуру жидкости поддерживают ниже температуры кипения. Технический результат-увеличение селективности процесса, снижение выхода побочных продуктов, уменьшение габаритных размеров реактора.
Использование проектного решения позволит увеличить производительность производства по дихлорэтану приблизительно на 5–10 %.
- Лебедев, Н. Н. Химия и технология основного органического и нефтехимического синтеза / Н. Н. Лебедев. — М.: Химия, 1981.-608с.
- Пат. 2292945 Российская Федерация, C07C017/02 C07C019/045, Насадочный реактор для получения 1,2-дихлорэтана/ А. В. Бальчугов, Е. В. Подоплелов, Б. А. Ульянов; заявитель и патентообладатель «Ангарская государственная техническая академия». — № 2005112116/04; заявл. 22.04.2005; опубл. 10.02.2007.
Источник