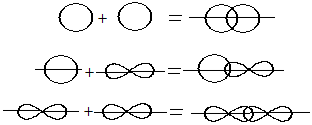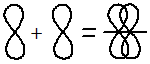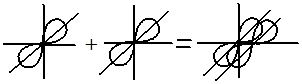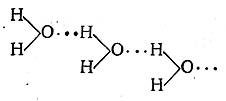- Способы перекрывания электронных облаков
- Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
- ХИМИЧЕСКАЯ СВЯЗЬ
- МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
- Эволюция метода валентных связей
- Основные положения метода валентных связей
- Гибридизация атомных орбиталей
- sp-гибридизация
- sp 2 -гибридизация
- sp 3 -гибридизация
- Валентность по обменному механизму метода
Способы перекрывания электронных облаков



1. Вдоль межъядерной оси – сигма связь (σ)
2. По обе стороны от межъядерной оси – за счёт бокового перекрывания орбиталей — Пи-связь (π)
Перекрывание электронных облаков над и под линией, соединяющей ядра атомов, осуществляется за счёт так называемой π – связи. Если d – электронные облака, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лепестками, то такую связь называют дельта связью (δ). В молекулах с двойной и тройной связью имеются и σ — и π – связи.
Следует различать понятия «полярность связи» и «полярность молекулы». Например, и σ- и π- связь С=О полярны, а молекула СО2 неполярна, т.к. суммарный дипольный момент молекулы равен нулю.
Ионная связь.Такой тип химической связи возникает только при взаимодействии атомов, которые сильно отличаются по электроотрицательности, т.е. между типичными металлами и типичными неметаллами.
При химическом взаимодействии типичные металлы, имеющие на внешнем энергетическом уровне 1 – 2 электрона, отдают их атому неметалла, который приобретает завершённый энергетический уровень и превращается в отрицательно заряжённый ион, а атом, отдавший электроны – в положительно заряженный ион. Например NaCl:
Na 0 1s 2 2s 2 2p 6 3s 1 — e → Na + 1s 2 2s 2 2p 6 3s 0
Сl 0 1s 2 2s 2 2p 6 3s 2 3p 5 + е → Сl ¯ 1s 2 2s 2 2p 6 3s 2 3p 6
Между образовавшимися ионами осуществляется электростатическое взаимодействие, приводящее к образованию химического соединения. Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной или электровалентной связью.
Соединения, которые образовались за счёт притяжения ионов, называются гетерополярными или ионными. Ионные соединения состоят из молекул только в парообразном состоянии.
Ионная связь в отличие от ковалентной характеризуется ненаправленностью в пространстве и ненасыщаемостью. Квантово — механическая теория валентности указывает, что резкого различия между ионной и ковалентной полярной связью не существует. Ионная связь это предельный случай полярной ковалентной связи.
Металлическая связь – сильно делокализованная химическая связь. Возникает в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, валентные электроны слабо удерживаются ядром из – за малой энергии ионизации. Наличие в металле так называемых свободных электронов (электронного газа) характеризует многие общие для всех металлов свойства: металлический блеск, теплопроводность и электрическую проводимость.
Свободные электроны связывают друг с другом ионы.
Данный вид связи характерен для металлов и их сплавов, а так же для интерметаллических соединений, она ненасыщенна и ненаправлена.
Водородная связь. Межмолекулярное взаимодействие может осуществляться не только за счёт донорно – акцепторных связей, но и за счёт сил Ван-дер-Ваальса (дисперсионного, ориентационного и индукционного взаимодействия) и водородной связи. Водородная связь обусловлена тем, что атом водорода, химически связанный в одной молекуле с атомом высокой элктроотрицательностью (например, фтора, кислорода) может соединиться ещё с атомом этого же элемента из другой молекулы. Водородную связь обозначают пунктиром
Водородная связь менее прочна чем обычная химическая связь, но оказывает влияние на многие свойства веществ. Различают межмолекулярную водородную связь и внутримолекулярную.
Контрольные задания.
99-118. Укажите тип химической связи в молекулах соединений вашего варианта. Составьте электронные схемы образования молекул с ковалентной связью. Электроны каких орбиталей атомов принимают участие в образовании ковалентной связи? Определите валентность и степени окисления атомов в молекуле. Изобразите электронными уравнениями процессы образования ионов из атомов для соединений с ионной связью.
Источник
Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами .
Атомы стремятся завершить свой внешний уровень (до 8 электронов, исключение водород, гелий до 2 электронов)
В образовании химической связи участвуют валентные электроны. Число валентных электронов определяется по номеру группы, в которой находится атом, образующий химическую связь. Число неспаренных валентных электронов Nе — =8-N группы
Классификация химических связей
1. По способу достижения завершенной электронной оболочки
2. По механизму образования химической связи
3. По способу перекрывания электронных орбиталей
I. По способу достижения завершенной электронной оболочки
КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар: H 2 , HCl, H 2 O, O 2
ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности: NaCl, K 2 O, LiF.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
II. По механизму образования химической связи (только для ковалентной связи)
III. По способу перекрывания электронных орбиталей (только для ковалентной связи)
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H 2 , HCl, H 2 O, O 2 ).
По степени смещения общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, H 2 , O 2 , О 3 ).
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) — образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl, H 2 O) .
Образующиеся общие электронные пары смещены в сторону более электроотрицательного элемента согласно ряду электроотрицательности элементов, предложенному американским химиком Л. Полингом.
В результате на более электроотрицательном элементе образуется избыток электронной плотности ( частичный отрицательный заряд δ- ), а на менее электроотрицательном элементе образуется недостаток электронной плотности ( частичный положительный заряд δ+ ).
Электроотрицательность (ЭО) — это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F.
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
AlCl 3 , разница в электроотрицательности ∆ Э.О.
Рассмотрим механизм образования молекул с ковалентной полярной и неполярной связями: Cl 2 , O 2 , HCl.
Источник
ХИМИЧЕСКАЯ СВЯЗЬ
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ
Эволюция метода валентных связей
Впервые приближенное решение уравнения Шредингера для одной из простейших молекул — молекулы водорода было произведено в 1927 г. В. Гейтлером и Ф. Лондоном. Эти авторы сначала рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга. При этом условии можно учитывать только взаимодействие каждого электрона со «своим» ядром, а всеми остальными взаимодействиями (взаимное отталкивание ядер, притяжение каждого электрона к «чужому» ядру, взаимодействие между электронами) можно пренебречь. Тогда оказывается возможным выразить зависимость волновой функции рассматриваемой системы от координат и тем самым определить плотность общего электронного облака (электронную плотность) в любой точке пространства.
Далее Гейтлер и Лондон предположили, что найденная ими зависимость волновой функции от координат сохраняется и при сближении атомов водорода. При этом, однако, необходимо уже учитывать и те взаимодействия (между ядрами, между электронами и т. д.), которыми при значительном удалении атомов друг от друга можно было пренебрегать. Эти дополнительные взаимодействия рассматриваются как некоторые поправки («возмущения») к исходному состоянию электронов в свободных атомах водорода.

В результате были получены уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. В последнем случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При противоположно направленных спинах сближение атомов до некоторого расстояния го сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т.е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов электронов образуется молекула Н2 — устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов. Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула.
Таким образом, проведенное исследование позволило сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам. Разработанная на этой основе теория химической связи и для более сложных молекул получила название метода валентных связей. Важным положением является то, что всякий раз, когда химическая связь образуется, спины пары электронов должны быть антипараллельными. Это находится в соответствии с принципом Паули и подчеркивает, что при образовании химической связи электроны переходят в новое квантовое состояние.
Наличие спаренных электронов является «индикатором» наличия химической связи, но не причиной ее образования. Изучение причины образования химической связи к настоящему времени показало, что энергия системы из двух атомов понижается тогда, когда электроны с большей вероятностью находятся в межъядерном пространстве (как бы «задерживаются» в этой области). Такая задержка приводит к понижению их кинетической энергии, в результате отрицательная составляющая полной энергии молекулы преобладает, молекула становится устойчивой или, как говорят, образуется химическая связь.
Метод валентных связей дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул. Хотя этот метод не оказался универсальным и в ряде случаев не в состоянии правильно описать структуру и свойства молекул, все же он сыграл большую роль в разработке квантово-механической теории химической связи и не потерял своего значения до настоящего времени в качественном понимании природы химической связи.
Основные положения метода валентных связей
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
- Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
Оба электрона общей электронной пары удерживаются одновременно двумя ядрами, что энергетически более выгодно, чем нахождение каждого электрона в поле «своего» ядра.
Такая химическая связь является двухцентровой.
- При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R1 и R2), тем прочнее химическая связь.
Например, изобразим образование молекулы F2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F: 1s 2 2s 2 2p 5 ):
Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих энергетических подуровнях).
- Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав.
Например, при образовании молекулы метана СН4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода, образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН5, СН6 и т.д. не существуют.
(Примечание: взаимодействие валентнонасыщенных соединений между собой возможно с образованием одной или нескольких дополнительных донорно-акцепторных связей по особому механизму).
- Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи — s-, р-, d- или f-электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают σ- (сигма), π- (пи) и δ (дельта)-связи.
Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра — это σ-связь; если облака перекрываются вне этой линии, возникают π- и δ-связи.
Если между атомами возникла одна общая электронная пара (обычно σ-связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной.

Например, образование молекулы азота N2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных р-электрона, направленных в трехмерном пространстве под углом 90 0 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и р-орбиталей, диктуемые магнитным квантовым числом).
Два атома азота, соединяясь в молекулу N2, могут образовать одну σ-связь (перекрываются облака, ориентированные вдоль оси х) и две π-связи (перекрываются облака, ориентированные вдоль осей у и z).
Гибридизация атомных орбиталей
Cтруктура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул влияет явление гибридизации орбиталей.
называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Смешанные, гибридные орбитали на схемах изображают условно:
sp-гибридизация
Из одной s-орбитали и одной р-орбитали образуются две гибридные, смешанные орбитали sp-типа, направленные по отношению друг к другу на 180°.
Например: линейную форму имеют молекулы ВеН2 и SnCl2 с sp-гибридизацией атома бериллия и олова соответсвенно.
sp 2 -гибридизация
Из одной s-орбитали и двух р-орбиталей образуются три sp 2 -гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Взаимная ориентация трех sp 2 -гибридных орбиталей — тригональная. Концепцию sp 2 -гибридизации применяют для описания плоских молекул тригональной формы.
Например: молекула фторида алюминия A1F3. Возбуждение атома алюминия сопровождается распариванием s 2 -электронов внешнего уровня на p-подуровень. Следовательно, электронная конфигурация внешнего уровня атома алюминия в возбужденном состоянии — 3s 1 3p 2 . Заселенные электронами орбитали атома алюминия гибридизируются и ориентируются в одной плоскости под углом 120° друг к другу. Каждое из трех электронных облаков гибридных sp 2 -орбиталей перекрывается с электронными облаками p-орбиталей трех атомов фтора.
sp 3 -гибридизация
sp 3 -гибридизация имеет место, если объединяются одна s-орбиталь и три р-орбитали; образуются четыре sp 3 -гибридные орбитали, ориентированные уже не в одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109°28′.
Например: строение молекулы метана СН4. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р-электрона. Казалось бы, четыре химические связи, образованные ими с s-электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН4 совершенно идентичны по длине и энергии, а углы между связями составляют 109°28′. Следовательно, в молекуле СН4 имеет место sp 3 -гибридизация.
Возможны более сложные случаи гибридизации с участием d-электронов, (например, sp 3 d 2 — гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp 3 -гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две — одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н2O в целом.
Валентность по обменному механизму метода
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется . Согласно обменному механизму метода валентных связей каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода валентных связей считают число неспаренных электронов у атома в основном или возбужденном состоянии атома. Это неспаренные электроны внешних оболочек у s- и p-элементов, внешних и предвнешних оболочек у d-элементов, внешних, предвнешних и предпредвнешних оболочек у f-элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары (или пар) электронов и переходе одного электрона (или нескольких электронов, равных числу разъединенных пар) в свободную орбиталь той же оболочки.
Например: электронная конфигурация кальция в основном состоянии записывается как:
В соответствии с обменным механизмом метода валентных связей валентность его равна нулю В=0. У атома кальция в четвертой оболочке (n=4) имеются вакантные р-орбитали. При возбуждении атома происходит распаривание электронов и один из 4s-электронов переходит в свободную 4р-орбиталь. Валентность кальция в возбужденном состоянии равна двум, т.е. при распаривании валентность увеличивается на две единицы:
В отличие от кислорода и фтора, электронные пары которых не могут разъединяться, так как во второй оболочке нет вакантных орбиталей, электронные пары атомов серы и хлора могут распариваться в вакантные орбитали 3d-подоболочки, соответственно сера кроме валентности основного состояния 1 и 2 , имеет еще валентности 4 и 6 в возбужденном состоянии, а хлор кроме валентности 1 в основном состоянии, имеет валентности 3, 5 и 7 в возбужденном состоянии.
| Элемент | Основное состояние | Возбужденное состояние | ||||||||
| Электронная конфигурация | Заполнение орбиталей | Валентность | Электронная конфигурация | Заполнение орбиталей | Валентность | |||||
| s | p | d | s | p | d | |||||
| Водород | 1s 1 |  | 1 | |||||||
| Гелий | 1s 2 |  | 0 | |||||||
| Бериллий | 2s 2 |  |  | 0 | 2s 1 2p 1 |  |  | 2 | ||
| Углерод | 2s 2 2p 2 |  |  | 1,2 | 2s 1 2p 3 |  |  | 1,2,4 | ||
| Кислород | 2s 2 2p 4 |  |  | 1,2 | ||||||
| Фтор | 2s 2 2p 5 |  |  | 1 | ||||||
| Сера | 3s 2 3p 4 |  |  |  | 1,2 | 3s 1 3p 3 3d 2 |  |  |  | 1,2,4,6 |
| Хлор | 3s 2 3p 5 |  |  |  | 1 | 3s 1 3p 3 3d 3 |  |  |  | 1,3,5,7 |
У атомов большинства d- и f-элементов на внешних оболочках в основном состоянии нет неспаренных электронов, поэтому их валентность в основном состоянии равна нулю, несмотря на то, что на предвнешних d- и f-подоболочках имеются неспаренные электроны. Последние не могут образовывать электронные пары с электронами других атомов, так как закрыты электронами внешней оболочки. При возбуждении атома распаренные электроны внешней оболочки вступают в химическую связь и открывают внутренние электронные оболочки.
Например: валентность железа в основном состоянии равна нулю:
В возбужденном состоянии происходит разъединение 4s-пары электронов:
Валентность железа в возбужденном состоянии определяется не только 4s-, 4p-, но и 3d-неспаренными электронами. Однако пара 3d-электронов не может разъединиться, потому что в третьей оболочке нет вакантных орбиталей, поэтому максимальная валентность железа равна шести.
У осмия при возбуждении могут разъединяться не только внешние 6s-электроны, но и предвнешние 5d-электроны, поскольку в пятой оболочке имеется еще 5f-подоболочка со свободными орбиталями, поэтому максимальная валентность осмия равна восьми:
Источник