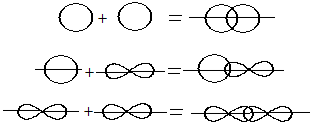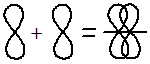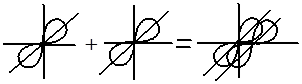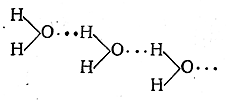- Способы перекрывания электронных облаков
- 3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
- Типы связей по способу перекрывания орбиталей
- Как узнать, когда в молекуле есть π- и ϭ-связи?
- Гибридизация орбиталей атома углерода
- Как определить тип гибридизации атома углерода в органической молекуле?
- Радикал. Функциональная группа
- Гибридизация электронных орбиталей и геометрия молекул
- Типы связей по способу перекрывания орбиталей
- Как узнать, когда в молекуле есть π- и ϭ-связи?
- Видео
- Отличительные черты строения алкенов
- Образование ароматических веществ
- Способы определения
- Примеры решения задач
Способы перекрывания электронных облаков



1. Вдоль межъядерной оси – сигма связь (σ)
2. По обе стороны от межъядерной оси – за счёт бокового перекрывания орбиталей — Пи-связь (π)
Перекрывание электронных облаков над и под линией, соединяющей ядра атомов, осуществляется за счёт так называемой π – связи. Если d – электронные облака, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лепестками, то такую связь называют дельта связью (δ). В молекулах с двойной и тройной связью имеются и σ — и π – связи.
Следует различать понятия «полярность связи» и «полярность молекулы». Например, и σ- и π- связь С=О полярны, а молекула СО2 неполярна, т.к. суммарный дипольный момент молекулы равен нулю.
Ионная связь.Такой тип химической связи возникает только при взаимодействии атомов, которые сильно отличаются по электроотрицательности, т.е. между типичными металлами и типичными неметаллами.
При химическом взаимодействии типичные металлы, имеющие на внешнем энергетическом уровне 1 – 2 электрона, отдают их атому неметалла, который приобретает завершённый энергетический уровень и превращается в отрицательно заряжённый ион, а атом, отдавший электроны – в положительно заряженный ион. Например NaCl:
Na 0 1s 2 2s 2 2p 6 3s 1 — e → Na + 1s 2 2s 2 2p 6 3s 0
Сl 0 1s 2 2s 2 2p 6 3s 2 3p 5 + е → Сl ¯ 1s 2 2s 2 2p 6 3s 2 3p 6
Между образовавшимися ионами осуществляется электростатическое взаимодействие, приводящее к образованию химического соединения. Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной или электровалентной связью.
Соединения, которые образовались за счёт притяжения ионов, называются гетерополярными или ионными. Ионные соединения состоят из молекул только в парообразном состоянии.
Ионная связь в отличие от ковалентной характеризуется ненаправленностью в пространстве и ненасыщаемостью. Квантово — механическая теория валентности указывает, что резкого различия между ионной и ковалентной полярной связью не существует. Ионная связь это предельный случай полярной ковалентной связи.
Металлическая связь – сильно делокализованная химическая связь. Возникает в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, валентные электроны слабо удерживаются ядром из – за малой энергии ионизации. Наличие в металле так называемых свободных электронов (электронного газа) характеризует многие общие для всех металлов свойства: металлический блеск, теплопроводность и электрическую проводимость.
Свободные электроны связывают друг с другом ионы.
Данный вид связи характерен для металлов и их сплавов, а так же для интерметаллических соединений, она ненасыщенна и ненаправлена.
Водородная связь. Межмолекулярное взаимодействие может осуществляться не только за счёт донорно – акцепторных связей, но и за счёт сил Ван-дер-Ваальса (дисперсионного, ориентационного и индукционного взаимодействия) и водородной связи. Водородная связь обусловлена тем, что атом водорода, химически связанный в одной молекуле с атомом высокой элктроотрицательностью (например, фтора, кислорода) может соединиться ещё с атомом этого же элемента из другой молекулы. Водородную связь обозначают пунктиром
Водородная связь менее прочна чем обычная химическая связь, но оказывает влияние на многие свойства веществ. Различают межмолекулярную водородную связь и внутримолекулярную.
Контрольные задания.
99-118. Укажите тип химической связи в молекулах соединений вашего варианта. Составьте электронные схемы образования молекул с ковалентной связью. Электроны каких орбиталей атомов принимают участие в образовании ковалентной связи? Определите валентность и степени окисления атомов в молекуле. Изобразите электронными уравнениями процессы образования ионов из атомов для соединений с ионной связью.
Источник
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp 3 -гибридных орбитали:
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp 3 , либо в состоянии sp 2 , либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp 3 | CH4 – метан |
| 3 атома | sp 2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
- Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp 3 -гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp 2 -гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Источник
Гибридизация электронных орбиталей и геометрия молекул
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Видео
Отличительные черты строения алкенов
Гомологический ряд этилена, имеющий общую формулу СnН2n, характеризуется sp гибридизацией атома углерода. Алкены имеют треугольное строение, валентный угол составляет 120 °.
Атом углерода, у которого после нагревания, из-за перехода электрона с 2s на 2p энергетический подуровень, в процессе образования связи принимают участие 1s и 2p электроны. Они становятся гибридными, образуя в пространстве треугольник. Вершины полученных гибридных облаков перекрываются с негибридными атомами водорода, образуя одинарную связь. Sp2-гибридизация характерна для представителей всего ряда этилена.
Гомологический ряд алкенов начинается с этилена (этена), имеющего два атома углерода. У каждого из них остается по одному негибридному атому углерода, которые перекрываются друг с другом. Отличительной чертой этого класса органических соединений является наличие не только простых «сигма» связей, но и присутствие двойной «пи» связи.
Именно она объясняет специфические свойства представителей этого гомологического ряда. В отличие от насыщенных углеводородов ряда метана, этилен и его гомологи вступают в реакции электрофильного присоединения. В частности, выделяют следующие качественные реакции на двойную связь:
- обесцвечивание йодной (бромной) воды;
- изменение окраски перманганата калия (марганцовки).
Среди примеров неорганических веществ, имеющих этот тип гибридизации, приведем: хлорид алюминия (AlCl3), фторид бора (BF 3).
Образование ароматических веществ
Представители этого класса имеют общую формулу СnН2n-6. Их особенностью является наличие в молекуле единого электронного облака, образуемого 6 негибридными облаками. Бензол считается родоначальником гомологического ряда ароматических углеводородов. Замкнутая формула молекул представителей этого класса объясняется наличием sp2 гибридизации каждого из шести углеродных атомов.
Три гибридных облака используются для образования простой «сигма» связи с соседними атомами, а также с одним облаком водорода. Оставшийся негидридный p -электрон участвует в формировании единой системы (бензольного кольца). Особенности строения объясняют химическую инертность бензола. Этот арен способен вступать в реакции замещения только при жестких условиях.
Способы определения
Поговорим подробнее о том, как определить тип гибридизации. В химическом понимании данный термин предполагает изменение энергии и формы орбиталей. Наблюдается подобный процесс в тех случаях, когда для образования связи используют электроны, которые принадлежат различным типам.
Чтобы понять, как определить тип гибридизации, рассмотрим молекулу метана. Данное вещество является первым представителем гомологического ряда насыщенных (предельных) углеводородов. В пространстве молекула СН4 является тетраэдром. Единственный атом углерода образует с водородами связи, сходные по энергии и длине. Для того чтобы образовались такие гибридные облака, используются три р- и один эс-электрон.
Четыре облака смешиваются, и возникает четыре одинаковых (гибридных) вида, имеющих форму неправильной восьмерки. Называют такой тип гибридизации sp3. Все углеводороды, в составе которых только простые (одинарные) связи, характеризуются именно таким типом гибридизации атома углерода. Валентный угол составляет 109 градусов 28 минут.
Продолжим разговор о том, как определить тип гибридизации. Примеры ненасыщенных углеводородов ряда этилена дают представление о sp2-гибридизации. Например, в молекуле этилена из четырех валентных электронов в образовании химической связи используется только три. Оставшийся негибридный р-электрон уходит на образование двойной связи.
Ацетилен является простейшим представителем класса СпН2п-2. Особенностью этого класса углеводородов является наличие тройной связи. Из четырех валентных электронов углеродного атома только два меняют свою форму и энергию, становясь гибридными. Два оставшихся электрона принимают участие в образовании двух двойных связей, определяя ненасыщенный характер этого класса органических соединений.
Примеры решения задач
Задание Определите с помощью метода валентных связей тип гибридизации молекулы метана (CH4) и его геометрическую структуру по методу Гиллеспи Решение 6С 2s22s22p2 1H1s1 Чтобы принять 4 лиганда атому углерода необходимо перейти в возбужденное состояние, следовательно электроны 2s-орбитали распарятся и один из них перейдет на p-орбиталь – в гибридизации будут участвовать все валентные орбитали атома углерода. Тип гибридизации sp3. Рассчитываем НЕП : (4 – 4)/2=0, следовательно метан имеет тетраэдрическую структуру. Ответ Тип гибридизации sp. Метан имеет тетраэдрическую структуру.
Задание Определите с помощью метода валентных связей тип гибридизации молекулы BCl3 и его геометрическую структуру по методу Гиллеспи Решение 5B 1s22s22p1 17Сl 1s22s22p63s23p5 Атому бора необходимо перейти в возбужденное состояние, чтобы принять 3 атома хлора: Тип гибридизации sp2. Рассчитываем НЕП : (3 – 3)/2=0, следовательно молекула BCl3 имеет структуру плоского треугольника. Ответ Тип гибридизации sp. Молекула BCl3 имеет структуру плоского треугольника.
Источник