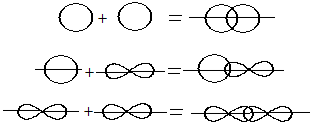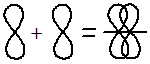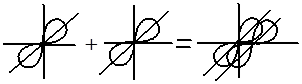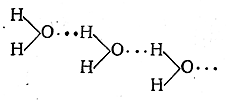- Способы перекрывания атомных орбиталей
- sp-Гибридизация
- Видео
- Как различить сигма-, пи- и дельта-связи?
- Виды гибридизации атомных орбиталей
- Способы перекрывания электронных облаков
- Гибридизация атомных орбиталей
- Типы связей в молекулах органических веществ
- Гибридизация атомных орбиталей углерода
- sp 3 -Гибридизация
- sp 2 -Гибридизация
- sp-Гибридизация
- Добавить комментарий Отменить ответ
Способы перекрывания атомных орбиталей
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Видео
Как различить сигма-, пи- и дельта-связи?
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов.
Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов.
Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.
σ– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей:
σ– связь обладает свойствами локализованной двухцентровой связи, каковой она и является.
π– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:
Итак, s— элементы способны к образованию только σ– связи,
р— элементы — σ– и π– связи,
d— элементы — σ–, π– и δ‑ связи,
f— элементы — σ– , π– , δ-связи.
При совместном образовании π– и σ- связей получается двойная связь.
Если же одновременно возникают две π–и σ- связь, то образуется тройная связь.
Количество возникших связей между атомами, называется кратностью связи.
Между двумя атомами может возникнуть только одна сигма-связь.
Виды гибридизации атомных орбиталей
sp–гибридизация является результатом смешивания одной s– и одной p–орбиталей. В результате формируется пара равноценных sp-атомных орбиталей. Они расположены линейно под углом 180° и направлены в разные стороны по отношению к ядру центрального атома. Две оставшиеся негибридные p–орбитали расположены в плоскостях, являющихся взаимно перпендикулярными. Данные орбитали принимают участие в формировании π–связей.
Источник
Способы перекрывания электронных облаков



1. Вдоль межъядерной оси – сигма связь (σ)
2. По обе стороны от межъядерной оси – за счёт бокового перекрывания орбиталей — Пи-связь (π)
Перекрывание электронных облаков над и под линией, соединяющей ядра атомов, осуществляется за счёт так называемой π – связи. Если d – электронные облака, расположенные в параллельных плоскостях, перекрываются всеми четырьмя лепестками, то такую связь называют дельта связью (δ). В молекулах с двойной и тройной связью имеются и σ — и π – связи.
Следует различать понятия «полярность связи» и «полярность молекулы». Например, и σ- и π- связь С=О полярны, а молекула СО2 неполярна, т.к. суммарный дипольный момент молекулы равен нулю.
Ионная связь.Такой тип химической связи возникает только при взаимодействии атомов, которые сильно отличаются по электроотрицательности, т.е. между типичными металлами и типичными неметаллами.
При химическом взаимодействии типичные металлы, имеющие на внешнем энергетическом уровне 1 – 2 электрона, отдают их атому неметалла, который приобретает завершённый энергетический уровень и превращается в отрицательно заряжённый ион, а атом, отдавший электроны – в положительно заряженный ион. Например NaCl:
Na 0 1s 2 2s 2 2p 6 3s 1 — e → Na + 1s 2 2s 2 2p 6 3s 0
Сl 0 1s 2 2s 2 2p 6 3s 2 3p 5 + е → Сl ¯ 1s 2 2s 2 2p 6 3s 2 3p 6
Между образовавшимися ионами осуществляется электростатическое взаимодействие, приводящее к образованию химического соединения. Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной или электровалентной связью.
Соединения, которые образовались за счёт притяжения ионов, называются гетерополярными или ионными. Ионные соединения состоят из молекул только в парообразном состоянии.
Ионная связь в отличие от ковалентной характеризуется ненаправленностью в пространстве и ненасыщаемостью. Квантово — механическая теория валентности указывает, что резкого различия между ионной и ковалентной полярной связью не существует. Ионная связь это предельный случай полярной ковалентной связи.
Металлическая связь – сильно делокализованная химическая связь. Возникает в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, валентные электроны слабо удерживаются ядром из – за малой энергии ионизации. Наличие в металле так называемых свободных электронов (электронного газа) характеризует многие общие для всех металлов свойства: металлический блеск, теплопроводность и электрическую проводимость.
Свободные электроны связывают друг с другом ионы.
Данный вид связи характерен для металлов и их сплавов, а так же для интерметаллических соединений, она ненасыщенна и ненаправлена.
Водородная связь. Межмолекулярное взаимодействие может осуществляться не только за счёт донорно – акцепторных связей, но и за счёт сил Ван-дер-Ваальса (дисперсионного, ориентационного и индукционного взаимодействия) и водородной связи. Водородная связь обусловлена тем, что атом водорода, химически связанный в одной молекуле с атомом высокой элктроотрицательностью (например, фтора, кислорода) может соединиться ещё с атомом этого же элемента из другой молекулы. Водородную связь обозначают пунктиром
Водородная связь менее прочна чем обычная химическая связь, но оказывает влияние на многие свойства веществ. Различают межмолекулярную водородную связь и внутримолекулярную.
Контрольные задания.
99-118. Укажите тип химической связи в молекулах соединений вашего варианта. Составьте электронные схемы образования молекул с ковалентной связью. Электроны каких орбиталей атомов принимают участие в образовании ковалентной связи? Определите валентность и степени окисления атомов в молекуле. Изобразите электронными уравнениями процессы образования ионов из атомов для соединений с ионной связью.
Источник
Гибридизация атомных орбиталей
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь С–С, С–Н, С–О | Двойная связь С=С, С=О | Тройная связь С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 


В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp 3 , sp 2 и sp-гибридизация.
sp 3 -Гибридизация
В sp 3 -гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp 3 -гибридные орбитали:
Изображение с портала orgchem.ru
| Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому четыре гибридные орбитали углерода в состоянии sp 3 -гибридизации направлены в пространстве под углом 109 о 28’ друг к другу, что соответствует тетраэдрическому строению.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
sp 2 -Гибридизация
В sp 2 -гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
| Три sp 2 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным. |
Поэтому три sp 2 -гибридные орбитали атома углерода направлены в пространстве под углом 120 о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
| Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp 2 -гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей. |
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник